
Решение задач по органической химии
.pdfФедеральное агентство по образованию
Московская государственная академия тонкой химической технологии имени М.В.Ломоносова
Кафедра органической химии
Помогаев А.И., Лонина Н.Н.
РЕШЕНИЕ
ЗАДАЧ ПО ОРГАНИЧЕСКОЙ ХИМИИ
Часть 1
Учебно-методическое пособие
Москва 2005
http://www.mitht.ru/e-library
УДК 547
ББК 24.2
Рецензент: д.х.н., проф. Мочалин В.Б. (МИТХТ, кафедра органической химии)
Помогаев А.И., Лонина Н.Н.
Решение задач по органической химии. Часть 1. Учебно-методическое пособие М., МИТХТ им. М.В.Ломоносова, 2005
Утверждено Библиотечно-издательской комиссией МИТХТ им. М.В.Ломоносова в качестве учебно-методического пособия.
Поз. 138/2005.
Данное учебно-методическое пособие предназначено для студентов направлений бакалавриата, изучающих теоретический курс органической химии в виде двух частей и сдающих экзамен в осеннем и весеннем семестрах. В пособии приведены решения типовых задач (более 40) по материалу первой части курса органической химии (разделы «Теоретические основы», «Углеводороды», «Галогенопроизводные углеводородов»), вызывающих наибольшие трудности при выполнении контрольных работ и экзаменационных заданий.
©МИТХТ им. М.В.Ломоносова, 2005
2
http://www.mitht.ru/e-library
Содержание
Строение и реакционная способность |
............................. 4 |
Механизмы реакций.......................................................... |
34 |
Установление строения.................................................... |
61 |
Синтетические задачи ...................................................... |
67 |
3
http://www.mitht.ru/e-library

Строение и реакционная способность
При решении задач по вопросам строения и реакционной способности органических соединений студент должен продемонстрировать знания теории строения органических соединений: электронное строение атомов, простейших неорганических и органических молекул, свойства ковалентных связей, взаимное влияние атомов, смещения электронной плотности в молекулах органических соединений, вызванные индуктивными и мезомерными эффектами, пространственное строение органических соединений, конформационная и конфигурационная изомерия. Студент должен показать понимание вопроса, знание определений тех понятий, которые фигурируют в задаче, умение использовать эти определения.
Чрезвычайно важным является знание валентности элементов, атомы которых входят в состав органических и используемых в органической химии неорганических соединений. Поэтому, прежде чем приступить к рассмотрению конкретных задач, остановимся на том, какие валентности проявляют важнейшие атомы в стабильных соединениях и в интермедиатах, встречающихся в механизмах органических реакций.
Атом водорода в соединениях всегда одновалентен.
Атом углерода в устойчивых соединениях, как правило, четырехвалентен, т.е. связан четырьмя ковалентными связями с двумя, тремя или четырьмя соседними атомами. Кроме того, атом углерода может быть:
двухвалентным; в этом случае он связан двумя связями с двумя соседними атомами и имеет неподеленную пару электронов, например:
CH3 CH |
CH3 N C |
трехвалентным с положительным зарядом; в этом случае он связан тремя связями с двумя или тремя соседними атомами и имеет вакантную орбиталь, например:
4
http://www.mitht.ru/e-library

CH3
CH3 |
|
C |
|
|
|
CH |
|
C |
|
CH |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|||||||
|
|
|
|
|
2 |
3 |
|||||
CH3
трехвалентным с отрицательным зарядом; в этом случае он связан тремя связями с одним, двумя или тремя соседними атомами и имеет неподеленную пару электронов, например:
CH2 CH O |
CH C CH3 |
C CH |
OCH3
трехвалентным с неспаренным электроном (радикал), например:
CH3 C CH3
CH3
Атом кислорода может быть:
одновалентным с отрицательным зарядом (связан с одним соседним атомом и имеет три неподеленные пары электронов);
CH3 O
одновалентным с положительным зарядом (связан одной связью с соседним атомом и имеет две неподеленные пары электронов и одну вакантную орбиталь)
CH3
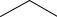
 C O
C O
CH3
5
http://www.mitht.ru/e-library

двухвалентным (связан двумя связями с одним или двумя соседними атомами и имеет две неподеленные пары электронов)
CH3 O H CH3 CH O
трехвалентным с положительным зарядом (связан тремя связями с двумя или тремя соседними атомами и имеет неподеленную пару электронов)
CH3 |
|
O |
|
CH3 |
CH3 |
|
C |
|
O |
|
H |
||
|
|
|
|
||||||||||
|
|
|
|
||||||||||
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
CH3 |
||||||
Атом азота может быть:
одновалентным (связан одной связью с одним соседним атомом и имеет две неподеленные пары электронов)
O
CH3 C
N
двухвалентным с положительным зарядом (связан двумя связями с соседним атомом и имеет неподеленную пару электронов)
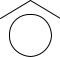
 N
N N
N
двухвалентным с отрицательным зарядом (связан двумя связями с соседними атомами и имеет две неподеленные пары электронов)
CH3 N CH3
трехвалентным (связан тремя связями с одним, двумя или тремя атомами и имеет неподеленную пару электронов)
6
http://www.mitht.ru/e-library
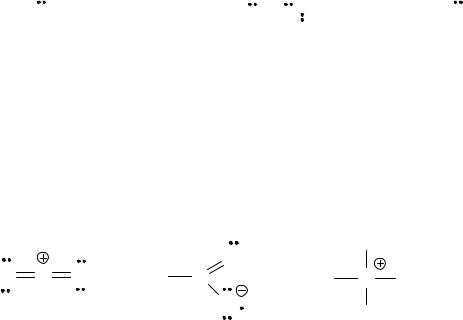
CH3 |
|
N |
|
H |
(CH3)2CH |
|
N |
|
O |
CH3 |
|
C |
|
N |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
||||||||||
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3
четырехвалентным с положительным зарядом (связан четырьмя связями с двумя, тремя или четырьмя соседними атомами)
H
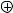 O
O
O N O CH3 N |
CH N H |
|
3 |
O
H
7
http://www.mitht.ru/e-library

Задача 1. Изобразите электронное строение следующих со-
единений и частиц: а) дихлоркарбен; б) диазометан; в) нитрометан; г) нитрит-анион; д) озон. В случае делокализованных связей изобразите набор граничных структур.
Электронное строение соединений описывают электронными формулами, в которых показывают все валентные электроны атомов, входящих в состав этих объектов. Электроны, обеспечивающие связи, изображают обычно черточками, а несвязанные электроны – точками. При составлении электронных форму необходимо помнить, что согласно октетному правилу Льюиса атомы второго периода при образовании ковалентных связей стремятся заполнить электронами свою внешнюю электронную оболочку (четыре атомные орбитали), поэтому они не могут иметь более 8 валентных электронов.
а) дихлоркарбен
Дихлоркарбен – ССl2 – электронейтральная частица, в которой атом углерода образует только две ковалентные связи, используя для их образования два из четырех валентных электрона, а оставшиеся два электрона либо образуют неподеленную пару (синглетная форма), либо находятся на двух орбиталях как неспаренные (триплетная форма).
Cl
 C
C
Cl
б) диазометан
Молекула диазометана СН2N2 является электронейтральной частицей. Атом углерода имеет 4 электрона, два атома водорода – по одному электрону каждый, и два атома азота – по пяти электронов каждый, т.е. в молекуле диазометана распределены 16 электронов. Известно, что атом углерода связан только с тремя соседними атомами, с которыми он может образовать три простые связи (это шесть электронов), и тогда два электрона образуют неподеленную пару, а атом углерода имеет отрицательный заряд (первая граничная структура), либо он может образовать две простые связи с атомами водорода и одну двойную связь с атомом азота, оставаясь при этом нейтральным (вторая граничная структура). Атом азота, как и атом
8
http://www.mitht.ru/e-library

углерода, может быть максимально четырехвалентным, образуя четыре связи (в этом случае он заряжен положительно), трехвалентным (электронейтрален) или двухвалентным (в этом случае у него имеется две неподеленные пары и отрицательный заряд).
Таким образом, молекула диазометана может быть описа-
CH2 N N |
CH N N |
CH N N |
|
2 |
2 |
на либо набором граничных структурных формул (граничных распределений электронов), каждая из которых не отражает адекватно истинное распределение электронов, либо мезомерной формулой с изображение смещения электронной плотности в виде изогнутых стрелок (р-π-сопряжение). Кроме того, возможно и еще одно распределение электронов в диазониевой группе:
 CH2 N
CH2 N N
N
в) нитрометан
Атом азота нитрогруппы связан с тремя атомами, при этом он использовал все свои валентные электроны. Два атома кислорода образуют с атомом азота две σ- и одну двухэлектронную трехцентровую π-связь: на трех р-орбиталях (одна орбиталь атома азота и по одной орбитали двух атомов кислорода) размещены два электрона. Это можно описать мезомерной формулой, показав р-π-сопряжение изогнутыми стрелками, или набором двух граничных структур.
CH3 N |
O |
N |
O |
O |
CH |
CH3 |
N |
||
|
3 |
|
||
|
O |
|
O |
O |
г) нитрит-анион
Нитрит-анион, в котором существует делокализованная связь (пара электронов принадлежит не двум, а трем атомам), может быть описан набором двух эквивалентных граничных структур или мезомерной структурной формулой.
9
http://www.mitht.ru/e-library

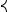
 O N
O N O
O 
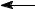

 O
O N O
N O 


 O N
O N O
O 
д) озон
18 валентных электронов распределены между тремя атомами кислорода в молекуле озона следующим образом.
 O O O
O O O 


 O
O O O
O O


 O O O
O O O 
 O O
O O O
O 


 O
O O O
O O


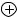 O O O
O O O
10
http://www.mitht.ru/e-library
