
КХ часть 2
.pdfфиксируют обращение эмульсии и рассчитывают ГЛБ, считая это свойство аддитивным, по формуле:
ГЛБСМ |
WA ГЛБA WB ГЛБB |
|
(7.3) |
|
WA WB |
||||
|
|
|||
где ГЛБСМ – число ГЛБ смеси ПАВ, обеспечивающее получение |
||||
устойчивой эмульсии стандартного масла, WA |
- количество |
|||
эмульгатора А с известным ГЛБ, WB - количество эмульгатора с неизвестным ГЛБ. Для оксиэтилированных продуктов применяется формула Гриффина:
ГЛБ (СЭТ ССП )/5 |
(7.4) |
где CЭТ и ССП – соответствующее содержание этиленоксида и спирта, % масс.
Число ГЛБ для данного ПАВ можно рассчитать по аддитивной формуле, зная числа ГЛБ для каждой структурной единицы. Так для гидрофильных групп число ГЛБ положительно и имеет следующие значения: -СООК – 21; -СООН - 2,4; -ОН - 1,9; для гидрофобных групп -
СН- , -СН2- , -СН3 - число ГЛБ отрицательно и равно –0,475.
ГЛБПАВ 7 (ГЛБ)Г (ГЛБ)Л (Метод Девиса)
При низком значении числа ГЛБ (1÷4) ПАВ не растворяются и не диспергируются в воде. При значении числа ГЛБ от 8 до 10 они образуют в воде стабильные дисперсии типа молока, а выше 13 -
образуют прозрачные растворы.
В зависимости от числа ГЛБ изменяется функциональное назначение ПАВ, чем определяются следующие их области применения: эмульгаторы в/м - 3÷6, смачиватели - 7÷9, моющие вещества - 13÷15.
74
Термодинамические функции не зависят от пути процесса, dUs –
полный дифференциал.
Уравнение (5.3) и (5.5) совместимы при условии:
s d SS dT NiS d i |
0 |
(5.6) |
Это общий вид адсорбционного уравнения Гиббса. Введем некоторые ограничения. При T const уравнение Гиббса принимает вид:
s d NiS d i 0|:s ,
Все экстенсивные параметры поверхности (U , S , N ) зависят от площади поверхности s и, поэтому их удобно относить к единице площади.
|
|
|
d Гi d i |
0 |
(5.7) |
т. к. Гi |
|
NS |
|
|
|
|
i |
– мера избыточного |
содержания |
компонента в |
|
|
|||||
|
|
s |
|
|
|
поверхностном слое, мера адсорбции, т. е. величина гиббсовой адсорбции.
d Гi |
d i |
(5.8) |
Для бинарной системы: |
|
|
d Г1 d 1 Г2 d 2 |
(5.9) |
|
где индекс 1 относится к растворителю, 2 – к растворенному |
||
веществу. Изменение связано с |
адсорбцией и с |
изменением |
концентрации растворителя и растворенного вещества. Это уравнение содержит два неизвестных, Г1 , Г2 и поэтому однозначное его решение отсутствует. Один из путей его решения следующий.
Величины адсорбции зависят от положения разделяющей поверхности. В зависимости от выбора положения разделяющей
11
www.mitht.ru/e-library

поверхности адсорбция первого компонента оказывается
положительной, отрицательной или равной нулю. Гиббс показал, что
разделяющую поверхность можно провести так чтобы и
Гi 0. При таком выборе разделяющей поверхности можно считать,
что адсорбция растворителя отсутствует d Г d .
Перейдем к концентрации.
R T lna R T lnC , где C – равновесная концентрация в
объеме. |
|
|
|
|
||
d R T d lnC; d Г R T |
dC |
; Г |
С |
|
d |
; |
|
|
|
||||
|
C |
R T dC |
||||
Это одно из наиболее важных уравнений коллоидной химии. Оно связывает величину адсорбции с поверхностным натяжением.
Уравнение Гиббса подтверждено экспериментально методом среза тонких слоев и их анализа.
Из этого уравнения видно, что для ПАВ величина адсорбции растет с увеличением концентрации и понижением температуры.
Величину |
d |
называют поверхностной активностью и |
|
|
|
||
dC C 0
обозначают символом g в честь Гиббса. Единицей измерения поверхностной активности служит 1 Гиббс.
Проведем анализ уравнения Гиббса. Если d 0, то Г 0, что dC
характерно для ПИАВ, проявляющих отрицательную адсорбцию.
12
Рис. 7.7 Зависимость ККА (1) и ККМ (2) карбоновых кислот в CCI4 от числа
атомов углерода в молекуле.
7.10. Оценка дифильных свойств ПАВ
Оценка дифильных свойств ПАВ проводится разными способами.
Одной из характеристик дифильных свойств коллоидных ПАВ является гидрофильно-липофильный баланс (ГЛБ), характеризующий соотношение масс гидрофильной полярной группы и липофильного углеводородного радикала. Система ГЛБ предложена Гриффином в
1949 г. Она является эмпирической. Число ГЛБ определяют путём сравнения способности различных ПАВ к стабилизации эмульсий. Для олеиновой кислоты число ГЛБ условно выбрано равным 1, для олеата натрия оно равно 18. Чем выше гидрофильность, тем выше число ГЛБ,
которое изменяется от 1 до 40.
Девис установил количественную связь ГЛБ от состава и структуры ПАВ. Каждая структурная единица вносит свой вклад в числа ГЛБ.
Определение чисел ГЛБ проводят следующим образом. Готовят эмульсии из воды и стандартного масла с эмульгатором из смесей ПАВ с известным и неизвестным значением ГЛБ. Эмульсии выдерживают 24 часа, затем определяют наиболее устойчивую или
73
www.mitht.ru/e-library
энтропийную, а энергетическую природу. Она заключается в выгодности замены связи полярная группа – углеводород при молекулярном растворении на связь между полярными группами при их объединении в ядро мицеллы. Энергетический выигрыш системы при объединении полярных групп настолько велик, что при самых малых концентрациях истинных растворов ПАВ находится не в виде отдельных молекул, а в виде предмицеллярных ассоциатов.
В неводных растворах следует различать два уровня ассоциации:
первичную ассоциацию, связанную с образованием ди - и тетраметров и мицеллообразование, то есть образование частиц микрофазы.
Помимо ККМ, такие системы характеризуются ещё другим параметром, называемым критической концентрацией ассоциации
(ККА). Следует отметить, что в ряду жирных кислот влияние длины углеводородного радикала на ККА и ККМ неоднозначно. С
увеличением длины углеводородного радикала значения ККА увеличиваются, а значения ККМ – уменьшаются (рис. 7.7) .
Это объясняется лиофобным взаимодействием углеводородных радикалов в мицелле, тогда как в ассоциате радикалы преимущественно взаимодействуют с растворителем. Это взаимодействие затрудняет образование димеров, а взаимодействие радикалов во внешней части мицеллы между собой облегчает образование мицелл.
72
Если |
d |
0, |
то Г 0, что характерно |
для ПАВ, |
|
||||
|
dC |
|
|
|
проявляющих положительную адсорбцию. Если d 0, то Г 0, dC
что характерно для неактивных веществ.
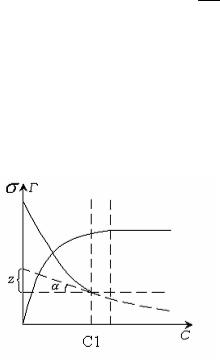
Используя уравнение Гиббса, можно найти величину адсорбции Г для любого значения С , из тангенса угла наклона касательной к экспериментальной кривой С . Таким путем можно перейти от изотермы поверхностного натяжения к изотерме адсорбции (рис.5.5).
Рис. 5.5. Переход от изотермы поверхностного натяжения к изотерме
адсорбции.
tg |
|
Z |
|
d |
|
(5.10) |
||||||
|
|
|
|
dC |
||||||||
|
|
|
|
C1 |
|
|
|
|||||
Г |
1 |
|
C1 |
|
|
Z |
|
|
Z |
(5.11) |
||
R T |
|
C |
|
R T |
||||||||
|
|
|
|
|
|
|
||||||
|
|
|
|
1 |
|
|
|
|
|
|||
Решив уравнение Гиббса для ряда точек, строят изотерму
адсорбции.
13
www.mitht.ru/e-library
5.5. Строение адсорбционного слоя ПАВ на границе
раствора с газом
Мы рассмотрели основные закономерности адсорбции ПАВ на границе раствора с газом с термодинамической точки зрения.
Рассмотрим теперь ориентацию молекул ПАВ на поверхности и строение адсорбционного слоя.
Пленки ПАВ, образующиеся на поверхности воды, могут находиться в трех агрегатных состояниях: твердом, жидком,
газообразном. Агрегатное состояние пленки определяется силами межмолекулярного взаимодействия и площадью, занимаемой молекулой на поверхности. Выталкивание молекул ПАВ на поверхность и их упаковка в адсорбционном слое приводят к растяжению адсорбционного слоя и к существованию поверхностного давления . Силы поверхностного натяжения, наоборот, сжимают поверхностный слой.
Если между молекулами действуют слабые силы, а поверхность велика, то молекулы на поверхности вследствие теплового движения находятся в состоянии двумерного газа. Газообразные пленки образуют дифильные органические вещества с определенной длиной углеводородного радикала, например, жирные кислоты с числом атомов углерода от 11 до 14.
В зависимости от длины углеводородного радикала ПАВ и площади, занимаемой молекулой, монослои ПАВ обладают полиморфизмом, т.е. способны к фазовым переходам. Сжатие монослоя обеспечивается плавучим барьером, на который действует определенная сила. При отсутствии действия силы на подвижный барьер монослой находится в газообразном состоянии (рис. 5.6, а) .
14
Растворы неионогенных ПАВ обладают специфической способностью существенно изменять свои физико-химические свойства при нагревании. Это связано с изменением их растворимости. Растворимость ПАВ уменьшается с повышением температуры. Растворы неионогенных ПАВ имеют нижнюю критическую температуру расслаивания. Для них характерна точка помутнения. Растворимость оксиэтилированных ПАВ в воде обусловлена образованием гидратов вследствие возникновения водородных связей между молекулами воды и эфирными кислородными атомами полиэтиленгликолевого остатка. При нагревании эти связи ослабевают, происходит дегидратация молекул ПАВ, то есть уменьшение растворимости молекул ПАВ, что приводит к агрегации молекул и к появлению опалесценции, а затем и к помутнению раствора.
При дальнейшем нагревании этого раствора происходит укрупнение частиц вплоть до выделения капелек ПАВ в виде отдельной фазы, то есть их “высаливание”. Температура помутнения раствора (TП ) и температура высаливания раствора (TВ ) ПАВ часто используются в качестве характеристики степени полиоксиэтилирования промышленных продуктов и влияния различных добавок на их растворимость .
7.9.Мицеллообразование в неводных средах
Вневодных средах образуются мицеллы с противоположной ориентацией молекул (обратные мицеллы). Степень ассоциации в обратных мицеллах значительно ниже, чем в прямых, и в отсутствие добавок числа агрегации обычно лежат в интервале 3÷40.
Структура растворителя в присутствии ПАВ существенно не нарушается. Мицеллообразование в неполярных средах имеет не
71
www.mitht.ru/e-library
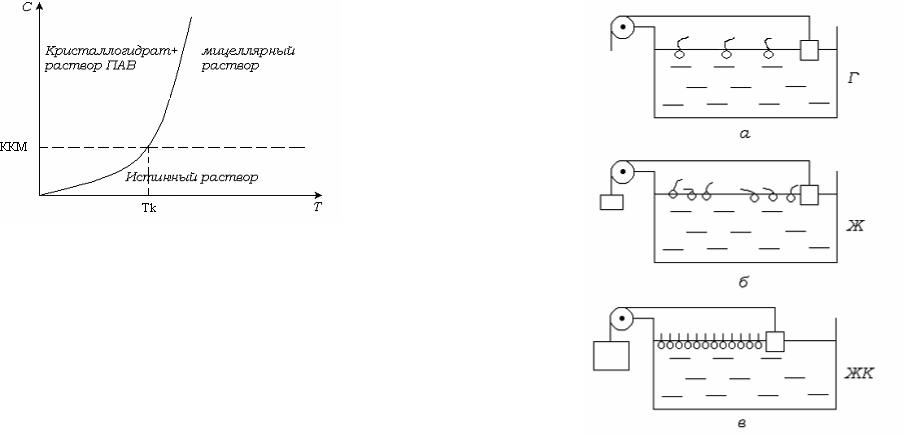
Рис. 7.6. Зависимость растворимости ионогенных ПАВ от температуры.
Точка Крафта наряду с ККМ является важной физико-химической характеристикой ПАВ. Величина ККМ характеризует нижний предел
концентрации, а Tk - нижний предел температуры существования
мицеллярных растворов.
С повышением температуры растворимость медленно увеличивается, и при температуре Крафта достигает критической концентрации мицеллообразования. В форме мицелл может быть диспергировано относительно большое количество ПАВ, вследствие чего наблюдается сильное увеличение растворимости. Температурная зависимость растворимости выше точки Крафта называется линией
Крафта. Ниже Tk существует равновесие между кристаллогидратами
ПАВ и истинным раствором ПАВ, концентрация которого медленно
растет с температурой. Выше Tk существует равновесие между
мицеллярным раствором и истинным раствором, концентрация которого остаётся постоянной.
70
Рис.5.6. Агрегатные состояния поверхностных пленок ПАВ.
Под действием сравнительно небольшой силы на плавучий барьер монослой переходит в жидкое состояние. Молекулы ПАВ на поверхности группируются и образуют островки (рис. 5.6, б). При дальнейшем увеличении действующей на барьер силы, т. е.
уменьшении площади, занимаемой молекулой ПАВ, монослой переходит в жидко-кристаллическое состояние (рис. 5.6, в).
15
www.mitht.ru/e-library
5.6.Уравнение состояния двумерного газа
Вдвумерном газе действует поверхностное давление, которое является растягивающим, в противоположность поверхностному
натяжению, сжимающему поверхность. Это давление равно
0 . При малом содержании ПАВ, т.е. в состоянии двумерного
газа 0 K C. После дифференцирования получим:
d d K dC |
(5.12) |
Подставим уравнение (5.12) в уравнение Гиббса:
Г |
C |
|
d |
|
C K |
|
|
(5.13) |
R T |
dC |
|
R T |
|||||
|
|
|
R T |
|
||||
Площадь, занимаемую одним молем ПАВ, обозначим через sм .
Тогда
Г |
1 |
; |
1 |
|
|
|
|
sм |
|
sм |
R T |
||
sм |
R T |
(5.14) |
||||
Это уравнение состояния двумерного газа аналогично уравнению газа P V R T .
Для реального двумерного газа справедливо уравнение Фрумкина,
аналогичное уравнению Ван-дер Ваальса:
( |
|
) (s |
м ) R T |
(5.15) |
|
||||
|
sм2 |
|
|
|
где - константа взаимодействия молекул ПАВ в поверхностном слое, - эффективная площадь сечения молекулы.
В конденсированных пленках молекулы ПАВ находятся в виде отдельных островков (жидкие пленки) или частокола Ленгмюра
(твердые пленки).
16
Количественной оценкой гидрофобного взаимодействия является изменение энергии Гиббса при переходе углеводородного радикала из воды в мицеллу ( 8,8кДж/ мольдля CH и 2,9кДж/ моль для
CH2 групп).
Вещества с гидрофобными группами нарушают структуру воды и увеличивают свободную энергию системы. Возможны два пути снижения свободной энергии. Первый путь – это адсорбция, когда молекулы ПАВ концентрируются на поверхности и контакт гидрофобных групп с водой уменьшается. Второй, альтернативный путь - это агрегация молекул ПАВ, т. е. мицеллообразование. При образовании мицелл также устраняется контакт гидрофобных групп с водой и снижается свободная энергия системы.
7.8. Зависимость растворимости ПАВ в воде от
температуры
Растворимость ионогенных ПАВ в воде вначале медленно, а затем быстро увеличивается с повышением температуры, их фазовое состояние определяется точкой Крафта (1895г.). Это объясняется тем, что неассоциированные ПАВ имеют низкую растворимость, а
мицеллы хорошо растворимы. Ниже температуры Крафта растворимость ПАВ недостаточна для мицеллообразования (рис. 7.6) .
69
www.mitht.ru/e-library
7.7. Термодинамика мицеллообразования в водной
среде
Причиной мицеллообразования в водной среде являются
гидрофобные взаимодействия, т. е. стремление воды к ликвидации внутренних полостей и выталкиванию гидрофобных тел. Этот эффект обусловлен межмолекулярными взаимодействиями и структурой воды,
существованием в воде системы водородных связей.
Экспериментально показано, что в водных растворах величина энтальпии мицеллообразования мала и может быть отрицательной.
Следовательно, определяющее значение в мицеллообразовании имеют энтропийные изменения. Но следует учесть, что при объединении молекул ПАВ в мицеллу энтропия уменьшается, т. к.
число степеней свободы ПАВ уменьшается. Для того чтобы понять причину положительного энтропийного эффекта при мицеллообразовании, необходимо рассмотреть изменение энтропии всей системы, обоих ее компонентов, ПАВ и воды. Движущей силой мицеллообразования является увеличение энтропии системы в целом за счет разрушения упорядоченного расположения молекул воды,
связанных водородными связями. Упорядоченные “льдоподобные” структуры существуют вокруг углеводородных радикалов, когда молекулы ПАВ находятся в молекулярно - растворенном состоянии.
Углеводородные радикалы молекул ПАВ оказывают упорядочивающее воздействие на ближайшую к ним область водной среды (вследствие образования Н-связей). Поэтому концентрация Н-
связей в 1 моле воды выше вблизи углеводородных цепей. Когда молекулы ПАВ образуют мицеллу, водородные связи в воде разрушаются, молекулы воды приобретают больше степеней свободы,
и энтропия воды, а, следовательно, всей системы увеличивается.
68
5.7. Диаграммы состояния поверхностных пленок
Фазовое состояние поверхностных пленок описывается
диаграммой состояния или изотермой сжатия, которая может быть построена в координатах sм .
Поверхностное давление измеряют непосредственно с помощью весов Ленгмюра. Этот метод основан на прямом измерении горизонтальной силы, которая действует на поплавок, отделяющий пленку от поверхности чистого растворителя. Современные весы позволяют определять поверхностные давления с точностью до сотых долей дины\см. В общем случае при уменьшении площади реализуются газообразное, жидкое и твердое состояние монослоя.
Каждое состояние монослоя характеризуется определенной ориентацией молекул, зависящей от sм , адгезионных и когезионных свойств систем. В диапазоне давления и площади, занимаемой 1
молем ПАВ, отвечающем всем трем агрегатным состояниям пленки,
диаграмма состояния имеет вид, показанный на рисунке 5.7 .
Рис. 5.7. Диаграмма состояния поверхностных пленок.
Участок a соответствует двумерному газу и аналогичен кривой сжатия газа. На участке b происходит конденсация. В этом состоянии
17
www.mitht.ru/e-library
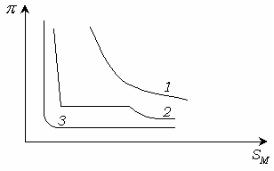
пленка называется растянутой жидкой пленкой и способна к сжатию,
которому соответствует участок c. На участке d происходит фазовый
переход, участку e соответствует конденсированная (твердая)
пленка. Участку f соответствует разрушение мономолекулярной
пленки, т. е. образование капли для жидкой пленки или многослойных образований для твердой пленки. Поверхностные пленки реальных
ПАВ описываются диаграммами состояния, отвечающими
определенному участку общей диаграммы состояния. Это зависит от длины углеводородного радикала молекулы ПАВ. Так, лауриновая кислота C11H23COOH благодаря сравнительно короткому радикалу образует только газообразные пленки (кривая 1, рис. 5.8).
Рис. 4.8. Диаграммы состояния поверхностных пленок лауриновой (1),
миристиновой (2) и пальмитиновой (3) кислот.
Миристиновая кислота C13H27COOH образует как газообразные,
так и конденсированные пленки (кривая 2, рис. 5.8). Пальмитиновая
кислота C15H31COOH при обычной температуре образует только
конденсированные пленки вследствие большой длины углеводородного радикала (кривая 3, рис. 5.8).
18
Благодаря экранирующему действию недиссоциированных полярных групп спирта уменьшаются силы электрического отталкивания между одноимённо заряженными полярными группами ПАВ, что способствует мицеллообразованию и снижению ККМ. Низкомолекулярные добавки
(метанол, ацетон и др.) понижают ККМ за счёт их хорошей растворимости.
Существует два подхода к мицеллообразованию: квазихимический
и фазовый. При квазихимическом подходе к мицеллообразованию мицелла рассматривается как большая молекула, состоящая из многих малых молекул ПАВ. Мицеллообразование можно рассматривать как быструю квазихимическую реакцию, протекающую по схеме:
ni Ai M
где ni - число агрегации, Ai - молекула ПАВ, M - мицелла.
Равновесный мицелярный раствор характеризуется узким распределением мицелл по размеру, форме и составу, т. е. их монодисперсностью. Эта реакция протекает настолько быстро, что время жизни молекулы ПАВ в мицелле составляет 10 7 с.
При фазовом подходе к мицеллообразованию мицелла рассматривается как микрофаза. Но эта микрофаза не имеет макроскопического аналога т. к. при равновесии мицеллярного раствора с твердой фазой мицелла не является зародышем. Мицеллы существуют в нерасторжимом единстве с окружающей жидкой средой и не могут быть из неё выделены.
67
www.mitht.ru/e-library

положительное изменение энтропии, обусловленное разрушением
упорядоченного расположения молекул воды вокруг углеводородных
радикалов при их ассоциации.
7.6.2. Влияние строения углеводородного радикала
Величина ККМ при равном количестве атомов возрастает (по сравнению с парафиновой цепью): а) при включении циклов в цепь
(алкилсульфонаты по сравнению с алкилбензолсульфонатами); б) при введении в углеводородный радикал полярных групп, гетероатомов
(олеат натрия по сравнению с рициноолеатом натрия). Наличие ароматических циклов, кратных связей, гетероатомов приводит к уменьшению гидрофобности углеводородного радикала и следовательно к повышению ККМ.
7.6.3. Влияние добавок электролитов
Введение электролитов в раствор ПАВ снижает величину ККМ по различным причинам. Во-первых, электролит уменьшает гидратацию полярных групп ионов ПАВ, так как он связывает воду за счёт гидратации своих ионов. Уменьшение гидратации иона ПАВ повышает их склонность к ассоциации. Во-вторых, добавленный электролит уменьшает эффективную степень диссоциации поверхностно-
активного электролита как в истинном растворе, так и в мицеллярном состоянии.
7.6.4. Влияние полярных органических веществ
Их введение в раствор ПАВ заметно влияет на ККМ. Характер влияния зависит от длины углеводородного радикала. Так длинноцепочечные спирты уменьшают ККМ, одновременно возрастает размер образующихся мицелл и вязкость раствора ПАВ. Эти факты объясняются образованием смешанных мицелл ПАВ+спирт.
66
5.8. Химические реакции в поверхностных пленках
Поверхностные пленки обладают электрическим зарядом, который влияет на химические реакции, идущие по ионному механизму. К
таким реакциям относится большинство жизненно важных биохимических каталитических реакций (ферментативный синтез,
протеолиз, лактонизация кислот, омыление жиров).
Введение в поверхностную пленку веществ, вызывающее изменение величины или знака ее электрического потенциала, может изменить скорость химической реакции в пленках на несколько порядков. Заряд поверхности изменяет свою величину, и знак при переходе от пленок жирных кислот к пленкам, которые образуют их соли (рис.5.9) .
Пленки жирных кислот, спиртов, сложных эфиров со стороны газовой фазы обладают положительным зарядом вследствие избытка электронной плотности на атомах кислорода (рис. 5.9).
Рис. 5.9.
Соли жирных кислот образуют отрицательно заряженные пленки,
так как диполь карбоксильной группы перекрывается большим по величине и противоположным по направлению диполем ионной пары.
19
www.mitht.ru/e-library
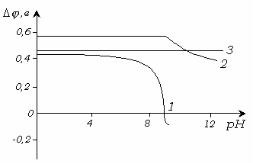
Для кислот значения электронного потенциала поверхности резко уменьшается, и затем изменяют свой знак с увеличением pH
раствора (рис. 5.10, кривая 1)
Рис. 4.10.
Для спиртов значения уменьшаются в щелочной области в связи с образованием алкоголятов (кривая 2), а для сложных эфиров значение потенциала поверхности не зависит от pH (прямая 3).
5.9. Самоорганизованные монослои и пленки,
перенесенные на твердую подложку с поверхности
вода-воздух (пленки Ленгмюра –Блоджетт)
Метод переноса пленок с поверхности воды на твердые пластины разработаны Ленгмюром и Блоджетт в 1935 году.
В связи с этим методом, который в настоящее время получил важнейшие технологические применения, интересно сделать небольшой исторический экскурс.
Впервые толщину монослоя оливкового масла на поверхности
воды измерил Б. Франклин в 1774г. Она оказалась равной 25A .
В 90-х г.г. прошлого века Поккельс обнаружила возможность
регулирования площади пленки с помощью подвижного барьера. Она
20
вводимое вещество переходит в мицеллярное состояние, повышая концентрацию вещества, находящегося в растворе.
Смиц С0 См m nмиц / NA |
(7.1) |
Концентрация молекулярно-растворенного вещества Cм остается
почти постоянной (рис. 7.5).
7.6. Влияние различных факторов на ККМ
Величина ККМ зависит как от особенностей молекулярного строения ПАВ, так и от внешних факторов - температуры, присутствия в растворе электролитов, полярных и неполярных органических веществ и др.
7.6.1. Влияние длины углеводородного радикала
Склонность к мицеллообразованию, как и поверхностная активность, существенно возрастает при увеличении длины углеводородного радикала. Поэтому величина ККМ в водных растворах резко уменьшается в гомогологических рядах ПАВ с увеличением молекулярной массы. В ряду гомологов величина ККМ изменяется обратно пропорционально поверхностной активности, так что отношение ККМ соседних гомологов соответствует коэффициенту правила Дюкло-Траубе:
(ККМ)n |
|
gn 1 |
3,2 |
(7.2) |
(ККМ)n 1 |
|
|||
|
gn |
|
||
Увеличение склонности к мицеллообразованию в ряду гомологов объясняется увеличением Ван-дер-вальсова взаимодействия цепей с ростом их длины, что повышает выигрыш энергии при переходе цепей из воды в неполярную фазу – ядро мицеллы. Cущественна и роль энтропийного фактора: с увеличением длины цепи возрастает
65
www.mitht.ru/e-library
