
КХ часть 2
.pdfмакромолекул из раствора на поверхность, происходящий в критической точке, является фазовым переходом II рода, о чем свидетельствуют изломы в энергии и энтропии системы.
Рост термодинамической жесткости цепи (увеличение сегмента)
приводит к убыванию критической энергии 0 , требуемой для начала адсорбции. Это объясняется тем, что энтропийные потери цепи при адсорбции убывают с ростом жесткости, т.е. для их компенсации требуется меньшая энергия связывания с поверхностью.
Вторичная структура макромолекулы влияет на ее адсорбцию, т. к.
сорбционная активность спиральных и клубковых звеньев различна. И
наоборот, степень спиральности адсорбированных цепей отличается от исходной степени спиральности макромолекул в растворе.
При рассмотрении адсорбции полимеров из разбавленного раствора необходимо принимать во внимание конформацию макромолекулы, характеризуемую средними размерами цепи (r2 )1/ 2 и
(h2 )1/ 2 .
Изотермы адсорбции полимеров из раствора отличаются от изотерм Ленгмюра. Иногда изотермы представляют собой кривые с одним или двумя максимумами. Один максимум имеет изотерма адсорбции полиметилметакрилата из толуольного раствора.
При адсорбции макромолекул на твердой поверхности различают четыре типа центров поверхности: занятые ( 1), экранированные
макромолекулой ( 2 ), находящиеся между адсорбированными макромолекулами в количестве, меньшем минимально необходимого для удержания макромолекулы на поверхности ( 3 ), свободные
54
B |
Гmax R T |
(5.31) |
|
0 |
|||
|
|
Уравнение Шишковского связывает термодинамические представления, на основе которых получено уравнение Гиббса, с
молекулярно-кинетическими, на основе которых получено уравнение Ленгмюра.
Это свидетельствует о единстве явления адсорбции, его единой физико-химической природе и о правомерности использования при его рассмотрении подходов (методов) физической химии:
термодинамического, дающего общую картину явления и молекулярно-кинетического, позволяющего представить конкретный механизм этого явления.
5.14. Правило Траубе
Экспериментально установлено, что Гmax const для всех его
членов данного гомологического ряда ПАВ. |
Гmax f (n), где n - |
|||||
число групп CH2 |
в соединении. |
Это означает, |
что адсорбционный |
|||
слой ПАВ |
при |
Гmax |
мономолекулярен, |
и |
неполярные части |
|
ориентированы вертикально (частокол Ленгмюра). |
|
|||||
Гmax |
определяет |
площадь |
поперечного |
сечения молекулы, |
||
следовательно, и |
B |
определяет площадь |
поперечного сечения |
|||
молекулы и мало зависит от природы ПАВ. Из уравнения Шишковского следует, что при малых значениях C :
|
d |
0 |
B |
1 |
(5.32) |
|
dC |
A |
|||||
|
|
|
|
31
www.mitht.ru/e-library

Оказалось, что поверхностная активность d в гомологическом dC
ряду ПАВ изменяется в геометрической прогрессии при увеличении длины цепи в арифметической. Правило Траубе гласит, что в
гомологическом ряду алифатических соединений при увеличении длины цепи на одну группу CH2 поверхностная активность увеличивается в 3,2 раза. Правило Траубе относится только к границе водный раствор – воздух. Его можно записать в виде:
d |
d |
3,2 |
|
||||
|
|
|
|
|
|
(5.33) |
|
|
|
||||||
dC n 1 |
dC n |
|
|
||||
Согласно уравнению (5.32) 0 B постоянно для всех членов ряда
d 1
- |
|
~ |
|
~ К. |
|
|
dC A
Следовательно,
Kn 1 |
3,2 |
(5.34) |
|
Kn |
|||
|
|
На рис. 5.17 показано влияние низших членов гомологического ряда низших алифатических спиртов на поверхностное натяжение воды. Чем длиннее углеводородная цепь, тем меньше растворимость спирта в воде, тем больше способность молекулы спирта адсорбироваться на поверхности раздела воды с воздухом и снижать поверхностное натяжение.
32
микрогетерогенных систем (наполненные полимеры, блок-
сополимеры, аморфно-кристаллические полимеры). Эффекты адсорбции макромолекул определяют адгезию полимеров к
различным субстратам, проявляются при взаимодействии
биополимеров с поверхностями клеток. Нативная структура биополимеров образуется в результате адсорбции макромолекулы на
самой себе (белковая глобула) или на комплементарной цепи
(двойная спираль ДНК).
Особенностью адсорбции в полимерных системах является
существование фазовых переходов различного рода. Важнейшим отличием адсорбции полимеров от адсорбции низкомолекулярных соединений является наличие порогового эффекта. Если значение энергии притяжения звена цепи к поверхности меньше критической
энергии ( 0 ), требуемой для начала адсорбции ( ) 0
полимерные клубки остаются в растворе, доля связанного полимера m мала и не зависит от . При больших энергиях притяжения 0 ,
все полимерные цепи связаны с поверхностью, доля свободных молекул в растворе (I - m ) - уменьшается до нуля с ростом . С
увеличением молекулярной массы при N связывание молекул осуществляется скачкообразно: m 0 в докритической области и
m 1 непосредственно при переходе через критическую точку 0 .
При этом изменяется конформация цепей. В докритической области макромолекула представляет собой невозмущенный гауссов клубок.
После адсорбции, при слабом покрытии поверхности, макромолекулы теряют свойства гауссовых клубков в направлении, перпендикулярном поверхности адсорбента и представляют собой последовательность адсорбированных участков и соединяющих их петель, средние размеры которых определяются величиной энергии сорбции. Переход
53
www.mitht.ru/e-library
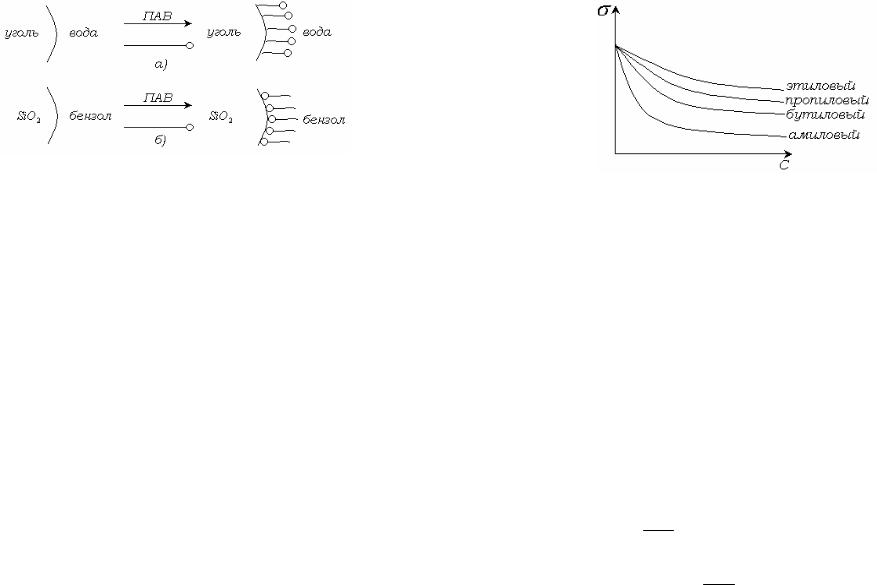
Рис. 6.6. Ориентация молекул ПАВ на границе твердое тело – раствор, а -
неполярный адсорбент из полярной среды, б - полярный адсорбент из неполярной среды.
Неполярная поверхность угля, обращенная к воде, становится более полярной, разность полярностей уменьшается, поверхностное натяжение и свободная энергия на межфазной границе уменьшаются в самопроизвольном процессе адсорбции и ориентации. При адсорбции из неводного раствора на полярном адсорбенте разность полярностей фаз уменьшается вследствие обратной ориентации молекул ПАВ,
обращенных полярными группами к полярному адсорбенту (рис. б).
При этом процесс протекает также самопроизвольно вследствие уменьшения свободной энергии на поверхности раздела фаз.
Правило Ребиндера выполняется только для физической адсорбции и не выполняется для хемосорбции.
Рис. 5.17. Влияние спиртов на поверхностное натяжение воды.
Траубе установил, что для отдельных гомологических рядов ПАВ концентрация, необходимая для одинакового снижения поверхностного натяжения в разбавленном растворе, уменьшается в
3,2 раза на каждую дополнительную группу CH2 . Рассмотрим причины этого.
Правило Траубе связано с работой адсорбции. Работа адсорбции,
т.е. работа переноса одного моля вещества с поверхности в объем затрачивается на перенос углеводородного радикала. Для переноса функциональной группы не надо совершать работу, т.к. она не выходит из водного окружения. Работа адсорбции A R T ln K .
Разность работ адсорбции двух членов гомологического ряда равна:
6.7. Адсорбция полимеров из растворов на твердой
поверхности
Взаимодействие макромолекулы с твердой поверхностью лежит в основе многих физико-химических процессов и явлений: гель-
хроматографии полимеров, стабилизации коллоидов полимерами.
Испытываемые молекулами внешние пространственные ограничения определяют структуру цепей в аморфных прослойках
52
An 1 An R T ln Kn 1 R T ln Kn
R T ln Kn 1 2 300 2,3 0,5 690кал/ моль;
Kn
Kn 1 3,2
Kn
При переходе каждой группы CH2 из водного окружения на границу с воздухом выделяется энергия, равная 690кал/ моль. При
33
www.mitht.ru/e-library
переходе в объем такая энергия затрачивается. Эта величина равна работе раздвижения диполей воды на величину объема, занимаемого группой CH2 , и является постоянной величиной для различных рядов ПАВ. Сущность правила Траубе в том, что работа адсорбции на каждый моль групп CH2 постоянна и равна
Таким образом, увеличение адсорбируемости в гомологическом ряду определяется одинаковым вкладом группы CH2 в работу адсорбции.
6. АДСОРБЦИЯ НА ГРАНИЦЕ РАЗДЕЛА ТВЕРДОЕ ТЕЛО – РАСТВОР
6.1. Введение
После рассмотрения адсорбции на границе твердой или жидкой фаз с газом перейдем к рассмотрению поверхностных явлений на границе двух конденсированных фаз. Именно этот вид адсорбции определяет образование и разрушение лиозолей, а также их устойчивость. В практическом плане адсорбция из растворов на твердой поверхности имеет большое значение, т.к. лежит в основе модификации поверхностей, многих процессов очистки жидкостей от примесей, например, осветления сахарного сиропа,
хроматографических методов разделения и анализа многокомпонентных смесей, а также обогащения полезных ископаемых путем флотации.
Классификация видов адсорбции в этом случае проводится по адсорбату. Различают молекулярную адсорбцию, т.е. адсорбцию неэлектролитов и ионную адсорбцию, т.е. адсорбцию электролитов.
При молекулярной адсорбции адсорбируются молекулы, при ионной -
34
частицы через A , растворенного вещества через Б , растворителя –
через В (рис. 6.5).
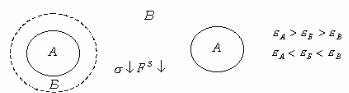
Рис. 6.5. Пояснение правила Ребиндера.
При резком различии полярностей дисперсной фазы и дисперсионной среды межфазное поверхностное натяжение велико,
свободная энергия на межфазной границе велика.
Это создает благоприятные условия для адсорбции растворенного вещества, обладающего промежуточной полярностью, а не растворителя. Адсорбция приведет к уменьшению разности полярностей, снижению поверхностного натяжения и свободной энергии на межфазной границе, FS . Поэтому для адсорбции жирных кислот из водного раствора необходимо применять неполярный адсорбент - уголь, а для адсорбции кислот из бензольного раствора - полярный адсорбент, силикагель.
Молекулы ПАВ ориентируются так, чтобы максимально скомпенсировать, уравнять разность полярностей фаз. Для ПАВ правило Ребиндера проявляется путем ориентации молекул ПАВ на границе раздела. Так, при адсорбции на угле из водных растворов молекула кислоты ориентируется полярной группой к воде (рис. 6.6).
51
www.mitht.ru/e-library
При адсорбции из органических жидкостей правило Траубе
обращается, т. к. при увеличении длины цепи растворимость увеличивается, а адсорбционная способность уменьшается.
Другой причиной обращения правила Траубе является пористость адсорбента. С увеличением пористости адсорбента увеличивается удельная поверхность и, следовательно, адсорбционная способность.
Для тонкопористых адсорбентов это увеличение идет до определенного предела. Мелкие поры становятся недоступными для вещества, длинные цепи не могут туда проникнуть, следовательно,
удельная поверхность адсорбента, участвующая в адсорбции,
уменьшается. Поэтому адсорбция с увеличением длины цепи уменьшается. Происходит обращение правила Траубе.
6.6. Правило выравнивания полярностей
Правило выравнивания полярностей Ребиндера определяет усло-
вия выбора того или иного адсорбента и структуру поверхностного слоя. Оно заключается в том что процесс адсорбции идет в сторону выравнивания полярностей фаз и тем сильнее, чем больше первоначальная разность полярностей. Растворенное вещество обладает обычно промежуточной полярностью и способностью скомпенсировать существующий на границе раздела скачок полярностей двух разнородных веществ. При выполнении этого условия уменьшается межфазное натяжение и свободная поверхностная энергия, что и является причиной адсорбции.
Правило Ребиндера можно пояснить следующим образом. Пусть дисперсная фаза и дисперсионная среда резко различаются по своей полярности, т. е. интенсивности поля межмолекулярного взаимодействия, характеризуемой значением диэлектрической постоянной . Обозначим диэлектрическую постоянную твердой
50
ионы, адсорбция которых приводит к образованию двойного электрического слоя.
В адсорбции из раствора на поверхности твердого тела участвуют все три компонента, т.е. адсорбент, адсорбат и растворитель. Этот вид адсорбции является адсорбцией из смеси.
6.2.Правило вытеснения
Кмолекулярной адсорбции из раствора применимы закономерности, установленные для адсорбции смеси газов.
Адсорбция из раствора описывается уравнениями:
а1с |
к1l1c1 |
|
|
; |
а2с |
|
|
к2l2c2 |
|
|
|
|
(6.1) |
|||||||||
1 l c |
l |
c |
2 |
1 l c |
|
l |
2 |
c |
2 |
|
||||||||||||
1 |
1 |
2 |
|
|
|
|
|
|
|
|
1 |
1 |
|
|
|
|
||||||
где а1с и а2с - величины адсорбции растворителя и растворённого |
||||||||||||||||||||||
вещества из раствора, к1 , к2 , |
l1 , |
l2 – |
|
константы, c1 |
и c2 – |
|||||||||||||||||
концентрации растворителя и растворённого вещества. |
|
|||||||||||||||||||||
В случае независимой адсорбции отдельных компонентов |
||||||||||||||||||||||
справедливы выражения: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
а |
|
|
к1l1c1 |
; |
а |
2 |
|
к2l2c2 |
|
|
|
|
|
(6.2) |
|||||||
|
1 l c |
|
|
|
|
|
|
|
||||||||||||||
1 |
|
|
|
|
|
1 l |
2 |
c |
2 |
|
|
|
|
|
|
|||||||
|
|
|
|
1 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Поделив выражения для величин совместной адсорбции (а1с и
а2с ) на выражения для независимой адсорбции (а1 и а2 ), получим:
а |
1 l1c1 |
|
а |
2с |
|
1 l2c2 |
|
|
1с |
|
|
; |
|
|
|
(6.3) |
|
|
1 l1c1 l2c2 |
|
|
1 l1c1 l2c2 |
||||
а1 |
|
а2 |
|
|||||
Следовательно а1с а1; а2с а2 , т. е. присутствие второго компонента снижает адсорбцию первого при одинаковых равновесных концентрациях. Этот вывод, полученный для адсорбции смеси газов,
35
www.mitht.ru/e-library

справедлив и для растворов и известен как правило вытеснения.
Компонент, сильнее адсорбирующийся отдельно, сильнее адсорбируется и из смеси. Если
Адсорбция зависит от взаимодействия всех компонентов, т.е.
взаимодействия твердого тела с растворителем, твердого тела с адсорбатом и адсорбата с растворителем. Следовательно,
необходимо учитывать межмолекулярные взаимодействия в жидкой фазе, т. к. они часто имеют решающее значение.
Изотерма адсорбции может быть описана уравнениями Фрейндлиха и Ленгмюра. Экспериментальная техника изучения адсорбции достаточна проста. Величину адсорбции определяют по разности концентрации вещества в растворе до адсорбции и после установления равновесия, определенной подходящим аналитическим методом (весовым, объемным, спектральным, рефрактометрическим и т.д.)
Прежде всего, адсорбция зависит от взаимодействия адсорбента и среды, которое характеризуется теплотой смачивания и определяет условия смачивания, растекания, адгезии и когезии. Эти явления сопровождают друг друга, и каждое из них вносит вклад в межфазное взаимодействие.
6.3. Когезия и адгезия
Когезией называют явление сцепления молекул в объеме однородного тела. Чтобы установить связь поверхностной энергии с энергией межмолекулярного взаимодействия в объеме, вводят величину, называемую работой когезии Wk . Работа когезии - это обратимая изотермическая работа разрушения столбика жидкости с сечением, равным единице. Так как после разрушения образуются
36
Обращение правила Траубе при адсорбции из водных и углеводородных растворов
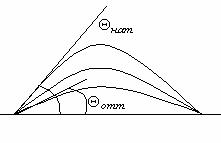
Взаимодействие адсорбента и среды характеризуется теплотой смачивания. При увеличении теплоты смачивания величина адсорбции уменьшается, т.к. поверхность адсорбента занимает растворитель, а не адсорбат. Значения теплоты смачивания из водных растворов для угля и SiO2 равны соответственно 6 и 400 кал/см2. Вода не смачивает уголь, и адсорбция на угле идет сильно, т.к. создаются условия для адсорбции растворенного вещества.
Вода сильно смачивает силикагель, поэтому адсорбция жирных кислот из водных растворов на силикагеле не идет. Адсорбция на силикагеле интенсивно протекает из углеводородных растворов. Чем меньше растворимость вещества, тем сильнее оно адсорбируется.
При адсорбции из водных растворов соблюдается правило Траубе. Как было указано выше, согласно этому правилу адсорбционная способность возрастает в гомологическом ряду жирных кислот или спиртов в 3,2 раза при удлинении цепи на одну группу СH2 .
На рис. 6.4 показаны изотермы адсорбции жирных кислот из водных растворов на угле (а) и из толуольных растворов на силикагеле (б)
Рис. 5.4. Изотерма адсорбции жирных кислот: а) из водных растворов на угле,
б) из толуольных растворов на силикагеле.
49
www.mitht.ru/e-library
6.5. Практическое значение смачивания
Одним из химико-технологических процессов, основанных на смачивании и адсорбции из растворов, является флотация, т. е.
метод обогащения полезных ископаемых, основанный на различии смачивания минеральных частиц водой. При пенной флотации в суспензию минерала (флотационную пульпу) вводят пузырьки воздуха.
При всплывании пузырьки собирают на своей поверхности гидрофобные частицы, плохо смачиваемые водой. Для повышения эффективности флотации поверхность частиц минералов модифицируют ПАВ, гидрофобизирующими поверхность и называемыми собирателями (коллекторами). ПАВ адсорбируются на поверхности за счет хемосорбции, что приводит к селективной гидрофобизации поверхности.
Элементарный акт пенной флотации состоит во взаимодействии частицы минерала, обладающей гидрофобной поверхностью, с
пузырьком воздуха. При этом происходит переход от менее устойчивого состояния, когда частицы минерала и пузырьки воздуха разобщены, к более устойчивому состоянию, когда частицы прилипли к пузырькам воздуха.
Флотационные методы обогащения применяются не только для руд, но и для углей. В гидроотвалы шахт обогатительных фабрик выбрасывается до 10% угля в виде угольных шламов. Уголь находится в шламах в виде мельчайших частиц, которые трудно поддаются флотации в силу малой инерционности. Для флотации тонких угольных шламов применяется флокулярная флотация. Суть этого процесса состоит в укрупнении частиц угля путем флокуляции высокомолекулярными флокулянтами, например, полиэтиленоксидом или полиакриламидом. Укрупненные частицы в дальнейшем
подвергаются флотации.
48
две поверхности единичного сечения, то работа когезии,
затрачиваемая на образование этих поверхностей, равна удвоенному значению поверхностного натяжения: Wk 2 . Под термином
"когезия" понимают идеальную прочность тела.
Адгезией называют явление взаимодействия двух разнородных конденсированных фаз, состоящее в приведении их в контакт и в образовании связей между ними за счет сил притяжения. Одна из фаз называется субстратом, другая - адгезивом. Большинство адгезивов являются полимерными, т.к. они сочетают высокую липкость и прочность, позволяющую передавать нагрузки от одного субстрата к другому. Адгезив более адгезионно активен, чем субстрат, т.е. более способен реализовать адгезионное взаимодействие. В результате адгезионного взаимодействия образуется гетерогенная система,
называемая адгезионным соединением и состоящая из субстрата и адгезива, или двух слоев субстрата и адгезива. При деформации адгезионного соединения возникает сложно-напряженное состояние,
вследствие чего может произойти разрушение адгезионного соединения.
Существуют два подхода к рассмотрению явления адгезии:
механический и термодинамический. Согласно механическому подходу, количественной характеристикой адгезионного соединения является адгезионная прочность, т. е. напряжение, необходимое для разрушения адгезионного соединения, разделения его на компоненты:
P |
|
F |
, где F - значение силы при разрушении, s - площадь |
|
|||
адс |
|
s |
|
контакта. При определении адгезионной прочности, как правило,
измеряются три показателя: средняя прочность, максимальное напряжение и энергия разрушения. Необходимо отметить, что
адгезионная прочность характеризует не интенсивность межфазного
37
www.mitht.ru/e-library

взаимодействия, т.е. работу адгезии, а систему в целом. Работа разрушения адгезионнoгo соединения складывается из работы адгезии и работы, затрачиваемой на деформацию:
(6.4)
Работа деформации несоизмеримо выше работы адгезии, поэтому энергия межфазного разрушения на несколько порядков выше энергии
адгезионных сил.
Характер разрушения может быть различным. Если разрыв произошел по первоначальной границе раздела, то такой характер разрушения называют адгезионным. При адгезионном разрушении обе поверхности остаются чистыми. Если разрыв произошел по одному из элементов, то такой характер разрушения называют когезионным. При когезионном разрушении разрыв происходит не по межфазной границе, а по менее прочной фазе, часть которой остается на более прочной фазе после разрушения. Возможен и смешанный характер разрушения адгезионного соединения, при котором часть менее
прочной фазы остается на более плотной фазе в виде остравков.
Условие |
адгезионного |
разрушения |
можно записать в виде: |
||
Pадг Pког , где Pадг F /s, |
Pког F |
/s ; |
F и F |
- значения силы |
|
при адгезионном и когезионном разрушении образца, |
s - площадь кон- |
||||
такта. |
|
|
|
|
|
Согласно |
термодинамическому |
подходу, |
количественной |
||
характеристикой адгезионного соединения является работа адгезии,
которая является термодинамической характеристикой адгезионного соединения. Работа адгезии определяется как обратимая изотермическая работа разделения двух конденсированных фаз вдоль межфазной поверхности, равной единице.
38
т тж жг cos раст |
(6.20) |
Условие самопроизвольного смачивания может быть записано в виде:
тг тж жг или т тж тж раст |
(6.21) |
При 00 жидкость смачивает твердое тело полностью и самопроизвольно растекается по поверхности со скоростью,
зависящей от вязкости жидкости и от чистоты или рельефа поверхности.
ПАВ увеличивают смачивание гидрофобных поверхностей водой,
т.к. снижают поверхностное натяжение, и капля лучше растекается на поверхности (рис. 6.3) .
Рис. 6.3. Растекание капли жидкости под действием ПАВ.
По величине краевого угла на границе твердое тело - вода - воздух судить о гидрофильности поверхности трудно, т.к. вода хорошо сма-
чивает большинство поверхностей. Для разделения поверхностей на гидрофильные и гидрофобные используют избирательное смачивание водой в присутствии неполярной жидкости, например, гептана.
Гидрофильные |
поверхности |
избирательно |
смачиваются |
водой, |
900 . Для гидрофобных |
поверхностей |
углеводород |
частично |
|
вытесняет воду и |
900 . |
|
|
|
47
www.mitht.ru/e-library
Т. к. скорость ньютоновского течения V пропорциональна напряжению сдвига, то
V k |
d |
C |
(6.17) |
|
|||
|
dc |
|
|
где k - коэффициент пропорциональности, а C |
- разность |
||
концентраций, т. к. градиент концентрации чрезвычайно трудно определить. Следовательно, скорость течения раствора тем выше,
чем больше поверхностная активность и чем больше разность концентраций в направлении движения.
Эффект Марангони имеет большое значение в процессах разделения, таких как экстракция, абсорбция и др. Он определяет прочность пенных плёнок. Его можно легко наблюдать на примере разрыва тонкой плёнки воды на ровной поверхности под действием капли спирта. Другой простой опыт состоит в том, что в тарелку с водой помещают спички, собирают их в центре и капают на них мыльную воду. В результате течения поверхностного слоя спички
переносятся к краям тарелки.
Поверхностное натяжение на границе твердого тела с газом меньше поверхностного натяжения твердого тела в вакууме ( т ) из-
за адсорбции газа. тг т . Разность поверхностных |
натяжений |
выражается через равновесное давление растекания: |
|
p0 |
|
раст т тг RT Гd(ln p) |
(6.18) |
0 |
|
где p0 - равновесное давление газа, Г - поверхностная концентрация |
|
адсорбированного газа. Запишем уравнение Юнга в виде: |
|
тг т раст тж жг cos |
(6.19) |
46 |
|
Определение работы адгезии может быть дано в терминах свободной энергии. Согласно этому определению, работа адгезии -
это свободная энергия равновесного обратимого разделения фаз на бесконечно большое расстояние в изобарно-изотермических условиях. При таком разделении образуются две поверхности раздела с газом и исчезает межфазная поверхность между конденсированными фазами. Таким образом, при рассмотрении адгезионного соединения,
состоящего из твердой и жидкой фаз, работа адгезии равна:
(6.5)
Это выражение для работы адгезии известно как уравнение Дюпре. Оно отражает закон сохранения энергии при адгезионном расслаивании. Из него следует, что работа адгезии тем больше, чем больше поверхностное натяжение исходных компонентов, взятых для образования адгезионного соединения, и чем меньше конечное межфазное натяжение в адгезионном соединении. Работа адгезии характеризует родственность контактирующих фаз, т е. степень
насыщения нескомпенсированных поверхностных сил при контакте.
Для двух жидкостей с высокой точностью соблюдается правило Антонова, полученное эмпирическим путем. Согласно этому правилу удельная межфазная энергия 12 равна разности между
поверхностными натяжениями более полярной 1 и менее полярной
2 жидкостей:
12 1 2 |
(6.6) |
Для взаимно растворимых жидкостей величины 1 и 2 |
относятся |
к насыщенным растворам.
Сопоставление выражения для работы адгезии с правилом Антонова приводит к следующему результату:
39
www.mitht.ru/e-library
WA 1 2 1 2 |
2 2 |
Wk(2) |
(6.7) |
т.е. работа адгезии в этом случае равна работе когезии менее полярной жидкости. Нарушение контакта жидкостей происходит по менее полярной фазе, взаимодействие в которой слабее, чем в полярной, т.е. наблюдается когезионный характер разрушения. На более полярной фазе остается адсорбированный слой менее полярной фазы.
Существует три теории адгезии: молекулярная (адсорбционная),
электрическая и диффузионная. Молекулярная теория в качестве основной причины адгезии рассматривает силы Ван-дер-Ваальса. В
электрической теории причиной адгезии считается контактная электризация. При контактировании фаз образуется плоский конденсатор, энергия которого определяет работу адгезии:
W a |
2 s2 h |
|
|
(6.8) |
|
|
||
|
|
|
где Wa – работа адгезии, ρs – плотность поверхностного заряда, h –
расстояние между обкладками, ε – диэлектрическая проницаемость.
Диффузионная теория адгезии разработана для полимерных адгезивов и в качестве причины адгезии рассматривает диффузии макромолекулы или ее сегмента в субстрат.
6.4. Смачивание и растекание
Под смачиванием понимают совокупность поверхностных явлений, происходящих на границе раздела трех контактирующих фаз, т.е. на линии трехфазного контакта. Оно зависит от взаимодействия молекул внутри каждой из фаз и между фазами и сопровождается убылью свободной энергии. При смачивании рассматриваются системы жидкость - газ - твердое тело или жидкость
40
равн |
|
наи отт |
(6.15) |
|
|||
|
2 |
|
|
Рис. 6.2. Определение равновесного угла смачивания.
При растекании жидкости с малым поверхностным натяжением по поверхности жидкости с большим поверхностным натяжением проявляется эффект Марангони, т.е. течение жидкости под действием градиента поверхностного натяжения, возникающего из-за локальных неоднородностей состава и температуры в разных участках межфазной поверхности. Жидкость течёт из области малых в область больших поверхностных натяжений вследствие самопроизвольного уменьшения поверхностной энергии Гиббса. При
ньютоновском течении напряжение сдвига P пропорционально градиенту поверхностного натяжения d /dx , где x - расстояние в направлении движения жидкости, P d /dx. Для раствора ПАВ
градиент поверхностного натяжения можно разложить на два множителя:
d |
|
d |
|
dc |
(6.16) |
dx |
dc |
|
dx |
||
|
|
|
где первый множитель - поверхностная активность, а второй -
градиент концентрации.
45
www.mitht.ru/e-library
