
Class
.pdf
|
|
Ф.И.О: |
|
|
Лабораторная работа № 1 |
Дата: |
|
|
|
|
|
|
Важнейшие классы неорганических соединений. |
Балл: |
|
|
|
|
|
|
Цель работы :изучение химических свойств важнейших классов неорганических соединений. |
|
|
|
|
|
|
|
|
|
|
№ опыта. |
Перечень оборудования ,уравнения реакций ,наблюдаемые явления ,выводы. |
Пометки |
|
|
|
преподавателя. |
|
|
|
|
|
|
I. Разделы курса, необходимые для подготовки к лабораторной работе. |
|
|
Простые вещества. Аллотропия. Сложные вещества. Органические и неорганические вещества. Основные классы неорганических соединений.
Оксиды, их состав и номенклатура. Солеобразующие и индифферентные (безразличные) оксиды. Оксиды основные,
кислотные и амфотерные. Химические свойства оксидов. Способы получения.
Кислоты, их состав и номенклатура. Классификация кислот. Основность кислот. Получение кислот и их характерные свойства.
Основания, их состав и номенклатура. Классификация оснований. Способы получения и свойства оснований. Щелочи.
Амфотерные гидроксиды.
Соли, их состав и номенклатура. Классификация солей. Соли средние, кислые, основные и двойные. Способы получения солей. Химические свойства солей.
Условия протекания ионообменных реакций до конца.
Генетическая связь между классами неорганических соединений.
Использование веществ, принадлежащих к основным классам неорганических соединений, в нефтяной и газовой промышленности.
Опыт № 1 Изменение окраски раствора индикатора в зависимости от реакции среды.
В три пробирки налейте приблизительно по 1 мл дистиллированной воды, разбавленной хлороводородной кислоты и разбавленного раствора гидроксида натрия. Добавьте в каждую пробирку 1-2 капли метилоранжа, отметьте в таблице изменение
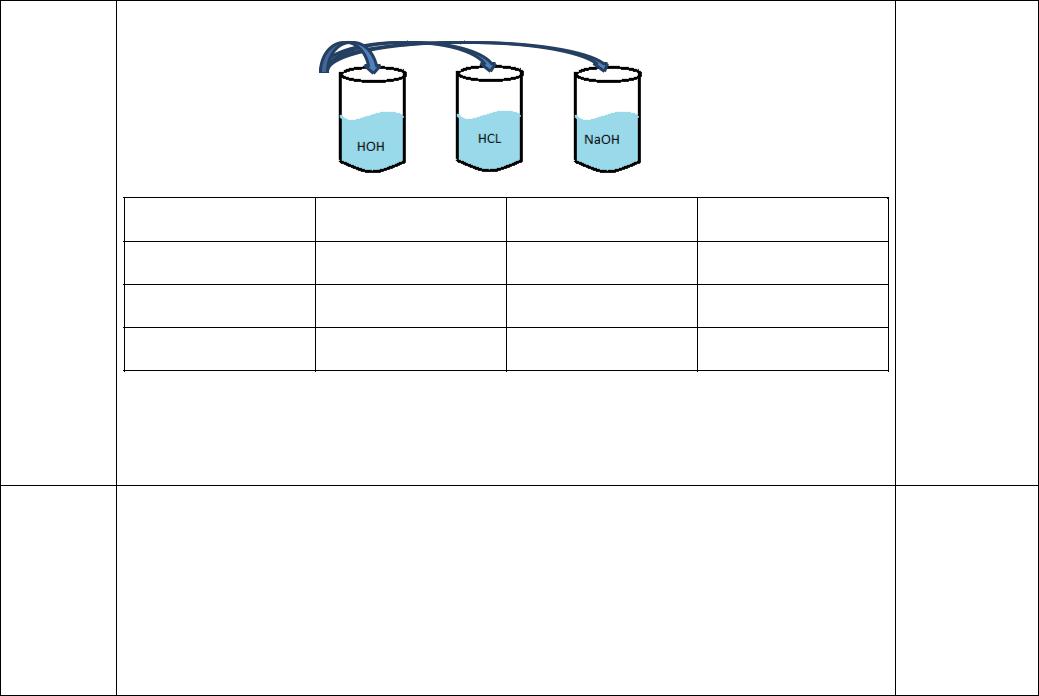
окраски растворов. Опыт повторите ещё 2 раза. Один раз в каждую пробирку добавьте 1-2 капли лакмуса, второй раз – столько же фенолфталеина.Сделайте вывод о изменении окраски индикаторов в зависимости от среды раствора.
Метилоранж
(1-2)капли
Вода дистиллир. |
Раствор кислоты |
Раствор щелочи |
Метилоранж
Лакмус
Фенолфталеин
Вывод:
Опыт № 2 |
Химические свойства кислот. |
А) |
Взаимодействие хлороводородной (соляной) кислоты и разбавленной серной кислоты с металлами. |
|
Испытайте действие разбавленных растворов соляной и серной кислот на цинк и медь. В 2 пробирки налейте |
|
приблизительно по 1 мл разб. соляной и серной кислот и опустите туда по 1 грануле цинка. В две другие пробирки также |
|
налейте по 1 мл разбавленных соляной с серной кислот и опустите туда по небольшому кусочку медной проволоки. |
|
Через некоторое время отметьте, в каких пробирках происходит выделение газа. Дайте объяснение наблюдаемому |
|
различию в действии цинка и меди на разбавленные растворы выбранных кислот с помощью понятия «активность |
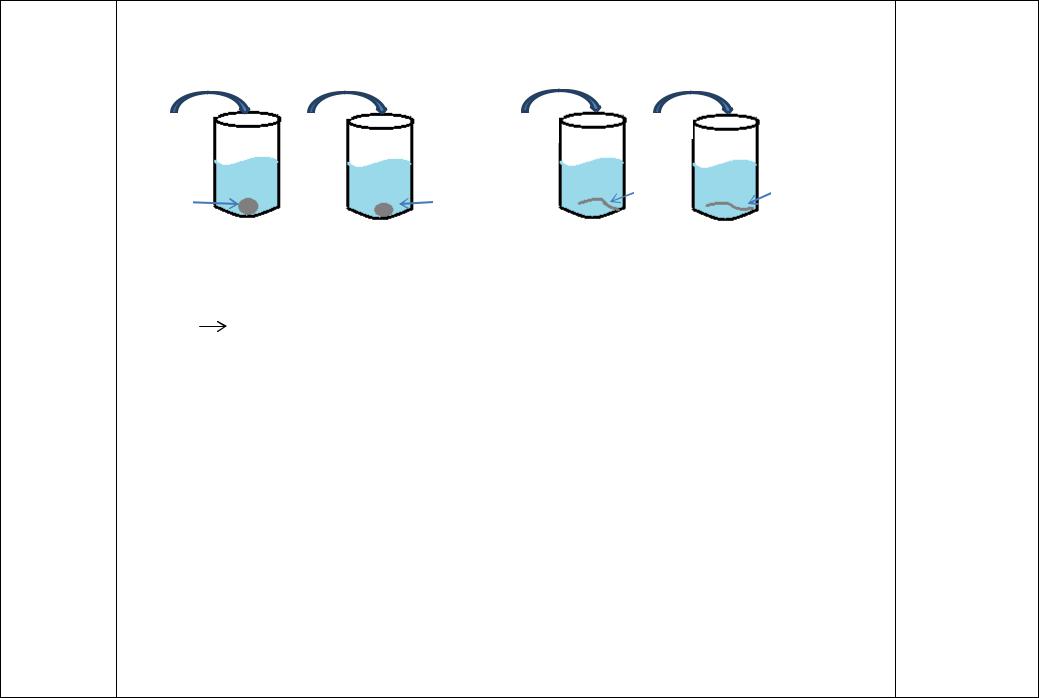
металла». Обратите внимание на положение цинка и меди относительно водорода в ряду стандартных электродных потенциалов. Напишите уравнения реакций. К какому типу относятся эти реакции?
1) |
|
2) |
|
|
HCl |
H2SO4 |
HCl |
H2SO4 |
|
Zn |
|
Zn |
Cu |
Cu |
|
|
|
Zn + HCl 
H2SO4 + Zn
Условия протекания:
Cu + H2SO4 
Cu + HCl
Наблюдаемые явления:
Вывод:

Б) |
Взаимодействие кислот с основными оксидами. |
|
Испытайте действие разбавленной соляной кислоты на оксид кальция. Что наблюдается? Напишите уравнение |
|
реакции. |
|
Примечание: При использовании оксида кальция, находившегося длительное время на воздухе, можно наблюдать |
|
побочную реакцию, протекающую с выделением газа. С чем это связано? |
|
Основная реакция: CaO + HCl |
|
Побочная реакция: CaO + CO2 |
|
CaCO3 + HCl |
|
Наблюдаемые явления : |
Вывод:
Взаимодействие кислот с основаниями (реакция нейтрализации).
В)
Налейте в пробирку 1 мл раствора гидроксида натрия, добавьте 1-2 капли лакмуса. Отметьте цвет раствора. По каплям добавляйте в пробирку раствор хлороводородной (соляной) кислоты. Как меняется цвет раствора? При каких соотношениях объёмов основания и кислоты произошла полная нейтрализация основания? Напишите уравнение прошедшей реакции.
Лакмус
(1-2 капли)
NaOH

NaOH + HCl 
Наблюдаемые явления :
Вывод:
Опыт № 3 |
Химические свойства оснований. |
А) |
Получение и термическое разложение оснований. |
|
Пользуясь растворами соли меди (II) и гидроксида натрия, получите гидроксид меди (II). Укажите цвет осадка. |
|
Осторожно нагрейте содержимое пробирки в пламени газовой горелка. Для предупреждения выброса нагревайте |
|
верхнюю часть содержимого пробирки. Что наблюдается? Сделайте вывод о разложении гидроксида меди (II) при |
|
нагревании. Напишите уравнения реакций. |
|
Cu(OH)2 |
|
CuSO4 + NaOH |
|
Вывод: |
Б) |
Получение и свойства амфотерных гидроксидов. |
|
|
|
Налейте в. пробирку несколько капель раствора сульфата цинка. Осторожно (резкое вдыхание аммиака может |
|
привести к потере сознания) добавьте несколько капель разбавленного раствора гидроксида аммония (водного |
|
раствора аммиака). Что образуется? Содержимое пробирки разделите на две части.Испытайте отношение гидроксида |
цинка к раствору соляной кислоты и избытку раствора гидроксида натрия. Что наблюдается? Напишите уравнения соответствующих реакций, учитывая, что при растворении гидроксида цинка в растворе гидроксида натрия образуется тетрагидроксоцинкат натрия Na2 Zn(OH)4 .
NH4OH
ZnSO4
ZnSO4 + NH4OH 
Zn(OH)2 + HCl
+ HCl 
Zn(OH)2 + NaOH
+ NaOH 
Наблюдаемые явления :
Вывод:
Опыт № 4 |
Получение и свойства оксидов. |
А) |
Получение основного оксида. |
|
В металлическую ложечку для сжигания положите магниевой стружки и нагрейте ее в пламени газовой горелки |
|
до воспламенения магния. Осторожно! Магний горит очень ярко. Напишите уравнение реакции. Отметьте цвет оксида. |
|
Сохраните полученный оксид для следующего опыта. |
|
Mg + O2 |
|
|
Наблюдаемые явления : |
|
|
Вывод: |
|
Б) |
Взаимодействие основного оксида с водой. |
|
|
|
|
|
Полученный в предыдущем опыте оксид перенесите в пробирку и добавьте 1-2 мл воды и 2-3 капли |
|
|
фенолфталеина. Как изменилась окраска? Напишите уравнение реакции взаимодействия оксида магния с водой. |
|
|
H2O+фенолфталеин |
|
|
MgO |
|
|
MgO + H2O |
|
|
Наблюдаемые явления : |
|
|
Вывод: |
|
|
|
|

В)
Г)
Получение кислотного оксида.
Положите в пробирку кусочек мела и прибавьте несколько капель раствора соляной кислоты. Что наблюдается?
Получите углекислый газ в аппарате Киппа, в котором протекает аналогичная реакция соляной кислоты с мрамором.
Напишите уравнение реакции. Сделайте заключение о устойчивости угольной кислоты.
HCl
CaCO3 
CaCo3 + HCl 
Наблюдаемые явления :
Вывод:
Взаимодействие кислотного оксида с водой.
Пропустите ток углекислого газа из аппарата Киппа в пробирку с водой. Добавьте к содержимому пробирки 2-3
капли раствора индикатора метиловый красный. Отметьте изменение окраски и объясните причину. Напишите уравнение реакции взаимодействия углекислого газа с водой. Будет ли происходить изменение окраски, если использовать индикатор метилоранж? Сделайте заключение о силе угольной кислоты.
CO2 + H2O 
|
Наблюдаемые явления : |
|
|
Вывод |
|
|
|
|
Опыт № 5 |
Получение и химические свойства солей. |
|
А) |
Взаимодействие солей с металлами. |
|
|
Налейте в одну пробирку раствор сульфата меди (II) и опустите кусочек цинка. Что наблюдается? Напишите |
|
|
уравнение происходящей реакции. В другую пробирку налейте раствор сульфата цинка и опустите туда кусочек медной |
|
|
проволоки. Будет ли взаимодействовать медь с раствором соли цинка? Обратите внимание на положение меди и цинка |
|
|
в ряду активности металлов. Сделайте обобщающий вывод о взаимодействии растворов солей с металлами. |
|
|
CuSO4 |
ZnSO4 |
|
Zn |
Cu |
CuSO4 + Zn 
ZnSO4 + Cu 
Наблюдаемые явления :
Вывод:

Б) |
Получение солей реакцией обмена. |
|
|
Налейте в пробирку несколько капель раствора хлорида натрия и добавьте 2-3 капли нитрата серебра. Что |
|
|
является признаком протекания этой реакции? Напишите уравнение реакции. |
|
|
AgNO3 |
|
|
NaCl |
|
|
NaCl + AgNO3 |
|
|
Наблюдаемые явления : |
|
|
Вывод: |
|
В) |
Получение средней соли и переход её в кислую соль. |
|
|
Налейте в пробирку раствор гидроксида кальция (известковой воды) и пропустите через раствор углекислый газа из |
|
|
аппарата Киппа до помутнения раствора. Какая соль при этом образовалась? Продолжайте пропускать углекислый газ |
|
|
через раствор до полного растворения первоначально выпавшего осадка. Какая соль образуется при пропускании через |
|
|
известковую воду избытка углекислого газа? Напишите уравнения реакций. К какому типу солей относятся |
|
|
образовавшиеся соли? |
|
|
Ca(OH)2 + CO2 |
|
|
CaCO3 + H2O + CO2 |
|
|
|
|
