
Кинетика.
Кинетика – это наука о скоростях процессов.
Химическая кинетика рассматривает скорости и механизм химических реакций. Важнейший параметр кинетики – время протекания процесса.
Скорости реакций зависят от многих факторов: природы реагирующих веществ, концентрации, температуры, давления, присутствия катализаторов, а в случае фазовых превращений – также от ряда других условий (состояния поверхности раздела фаз, условий тепло- и массообмена и др.). Задача кинетики состоит в выяснении роли этих факторов и в установлении механизма реакций и фазовых превращений.
Химическая кинетика включает в себя два раздела:
1) формально-математическое описание скорости реакции без учета действительного механизма самой реакции (формальная кинетика);
2) учение о механизме химического взаимодействия.
Формальная кинетика.
В формальной кинетике скорость химической реакции представляется в зависимости только от концентрации реагирующих веществ.
Закономерности формальной кинетики позволяют:
1) определить кинетические параметры химической реакции (константу скорости, период полупревращения и др.);
2) распространить полученные закономерности на сложные многостадийные химические реакции, характерные для технологических процессов;
3) классифицировать химические реакции.
Вещества, вступающие в процесс химического превращения, называются исходными веществами.
Вещества, образующиеся в процессе химического превращения и не претерпевающие в ходе этого процесса дальнейших химических изменений, называются продуктами реакции.
Вещества, образующиеся в одних стадиях процесса химического превращения и расходующиеся в других стадиях этого же процесса, называются промежуточными веществами.
Реакции образования и расходования промежуточных веществ называются промежуточными реакциями.
Химическая реакция, протекающая в одной фазе, называется гомогенной химической реакцией (реакция в растворе).
Химическая реакция, протекающая на границе раздела фаз, называется гетерогенной химической реакцией (реакция на поверхности катализатора). Следует отметить, что в гетерогенном процессе оба реагирующих вещества могут находиться в одной фазе. Так, гидрирование этилена
С2Н4 + Н2 → С2Н6
идет на поверхности катализатора, например, никеля. Однако оба реагирующих вещества находятся в одной фазе (в газовой фазе над поверхностью катализатора).
Сложные химические реакции, в которых одни стадии являются гомогенными, другие – гетерогенными, называют гомогенно-гетерогенными.
Гомофазным называется процесс, в котором все компоненты: исходные, промежуточные и конечные вещества – находятся в пределе одной фазы. (Например, реакция нейтрализации кислоты щелочью в растворе является гомогенным гомофазным процессом).
Гетерофазным называется процесс, в котором компоненты образуют более чем одну фазу (например, гидрирование этилена на никелевом катализаторе является гетерогенным гомофазным процессом – процесс идет на границе фаз металла и газа, а исходные вещества и продукт реакции находятся в одной газовой фазе).
Основной величиной в химической кинетике является скорость реакции.
Скорость химической реакции – это изменение концентрации вещества в единицу времени в единице объема. В общем случае скорость реакции меняется с течением времени и поэтому её лучше определять как производную от концентрации реагирующего вещества по времени (при постоянном объеме системы):
![]() ,
,
где
![]() – скорость, выраженная убылью концентрации
с реагирующего вещества;
– скорость, выраженная убылью концентрации
с реагирующего вещества;
![]() – время. Так как с течением времени
концентрация реагирующих веществ
уменьшается, поэтому перед производной
ставят знак «минус» («–»), (скорость –
величина положительная).
– время. Так как с течением времени
концентрация реагирующих веществ
уменьшается, поэтому перед производной
ставят знак «минус» («–»), (скорость –
величина положительная).
При взаимодействии двух или более веществ скорость реакции можно выразить через производную от концентрации любого вещества.
аА + bВ → сС + dD
![]()
Равенство имеет место при соблюдении стехиометрического соотношения между участниками реакции.
Изменение концентрации от времени
выражается кинетической кривой (![]() ).
).
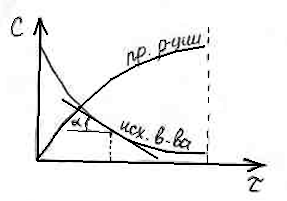
Зная кинетическую кривую для какого-либо компонента, можно легко определить скорость его накопления или расходования графическим дифференцированием кинетической кривой.
Тангенс угла наклона касательной к кинетической кривой есть графическая интерпретация скорости химической реакции.
![]()
Крутизна кинетической кривой характеризует истинную скорость химической реакции в определенный момент времени. Кроме того, по кинетическим кривым можно определить порядок и константу скорости реакции.
В общем случае химическая кинетика изучает оптимальные условия ведения процесса только для термодинамически разрешенных реакций.
Химическая кинетика имеет 2 постулата:
I. О независимости протекания реакции.
Если процесс протекает через ряд стадий, то предполагается, что скорость каждой отдельной стадии не зависит от скорости остальных стадий.
II. Скорость химической реакции прямо пропорциональна концентрации исходных веществ (ЗДМ).
аА + bВ → сС + dD
![]()
Данная запись выражения скорости реакции называется кинетическим уравнением.
![]()
![]()
Скорость химической реакции зависит от концентрации исходных веществ, от температуры, времени, катализатора и природы веществ.
k – константа скорости. Она численно равна скорости реакции при концентрации веществ, равных единице.
Константа скорости k
не зависит от концентрации реагентов
и времени (![]() ).
Она зависит от температуры, наличия
катализатора и природы веществ
(
).
Она зависит от температуры, наличия
катализатора и природы веществ
(![]() катализатор,
природа вещества
катализатор,
природа вещества![]() ).
).
![]()
Порядок – это показатель степени при концентрации данного вещества в кинетическом уравнении.
В случае одностадийного процесса
показатели степеней равны стехиометрическим
коэффициентам:
![]() ;
;
![]() .
.
Сумму порядков реакции по всем реагирующим
веществам называют порядком реакции
(![]() ).
).
Константы скорости реакций различного порядка имеют разную размерность и являются разными физическими величинами, сопоставление их абсолютных значений лишено какого бы то ни было смысла.
Константа скорости первого порядка:
![]() ;
;
Константа скорости второго порядка:
![]() ;
;
Константа скорости третьего порядка:![]() .
.
