
Классификация химических реакций:
I. По порядку реакции. n = 0, 1, 2, 3, дробный;
II. По молекулярности.
Молекулярность реакции – это количество молекул, которые принимают участие единовременно в одном акте столкновений. Молекулярность можно определить, лишь установив механизм реакции. В зависимости от числа реагирующих молекул (частиц), участвующих в элементарном акте, различают одномолекулярные (мономолекулярные), двухмолекулярные, тримолекулярные реакции.
К одномолекулярным реакциям типа А→Р относятся процессы распада молекулы на более простые составные части и реакции изомеризации. Двухмолекулярными называются элементарные реакции вида: А+В→Р и 2А→Р (Н2+J2=2HJ, HJ+HJ=H2+J2, CH3COOCH3+H2O=CH3COOH+CH3OH и т.д.). Значительно реже встречаются трехмолекулярные реакции А+2В→Р или 3А→Р. Во всех случаях вид и количество образующихся продуктов реакции не имеет значения, так как молекулярность определяется только числом молекул веществ, реагирующих в элементарном акте.
Порядок реакции устанавливается экспериментально.
Молекулярность и порядок реакции могут совпадать, а могут и различаться. Молекулярность и порядок реакции совпадают только для простых реакций, протекающих только в одну элементарную стадию без участия посторонних молекул.
Молекулярность и порядок реакции не совпадают в трех основных случаях:
1) для сложных реакций;
2) для гетерогенных реакций;
3) для реакций с избытком одного из реагирующих веществ.
Кинетические уравнения реакций различного порядка.
Разграничение реакций по порядку происходит по формальному признаку – сумме показателей степеней в кинетических уравнениях химических реакций, что ограничивает возможности формальной кинетики. Тем не менее формальная кинетика дает возможность использовать математические зависимости для нахождения кинетических параметров. Все приведенные ниже зависимости справедливы для простых гомогенных реакций в закрытых системах при постоянных объеме и температуре (V=const, T=const).
Реакции нулевого порядка (n=0).
В этом случае скорость реакции постоянна,
так как постоянны концентрации компонентов
реакции.
![]() .
.
Рассмотрим реакцию омыления сложного эфира:

Скорость омыления эфира будет описываться следующим уравнением:
![]()
// \
1 избыток
Если взять большой избыток воды, то её концентрация будет постоянной и кинетическое уравнение примет вид:
![]()
Можно сказать, что порядок реакции по частному порядку компонента воды будет нулевым.
Таким образом, большой избыток одного из реагентов уменьшает порядок реакции на определенную величину.
В общем случае кинетическое уравнение реакции нулевого порядка имеет вид:
![]()
![]() – кинетическое уравнение
нулевого порядка
– кинетическое уравнение
нулевого порядка
Например, реакция А→Р и её скорость
описывается уравнением
![]() ,
если вещество А взять в большом избытке,
то получим:
,
если вещество А взять в большом избытке,
то получим:
![]()
\\
1
Константа скорости данной реакции равна:
![]()
Разделим переменные и проинтегрируем данное уравнение:
![]()
При
![]() постоянная интегрирования равна
начальной концентрации С0 (const=
С0), тогда получаем:
постоянная интегрирования равна
начальной концентрации С0 (const=
С0), тогда получаем:
![]() ;
;
![]() при n=0
при n=0
В качестве критерия скорости реакции
нередко используется время половинного
превращения
![]() ,
называемое периодом полураспада.
,
называемое периодом полураспада.
Период полураспада
![]() – это время, в течение которого
прореагирует половина взятого вещества.
– это время, в течение которого
прореагирует половина взятого вещества.
![]() →
→
![]() ;
;
![]()
![]() – период полураспада для
реакции нулевого порядка
– период полураспада для
реакции нулевого порядка
Нулевой порядок встречается в гетерогенных и фотохимических реакциях.
Реакции ПЕРвого порядка (n=1).
Примером реакции, строго подчиняющейся уравнению первого порядка, является реакция термического разложения ацетона (хотя реакция в действительности протекает по сложному механизму):
СН3СОСН3 → СО + СН3СН3
Если обозначить концентрацию ацетона
в каждый момент времени
![]() через С, то при постоянной температуре
скорость реакции будет:
через С, то при постоянной температуре
скорость реакции будет:
![]()
Разделив переменные и проинтегрировав уравнение, получим:

При
![]() постоянная интегрирования const=
lnС0, тогда:
постоянная интегрирования const=
lnС0, тогда:
![]() (1)
(1)
![]() (2)
(2)
Уравнения (1) и (2) – различные формы кинетического уравнения реакции первого порядка. Они дают возможность вычислить концентрацию реагирующего вещества в любой момент времени по известной величине константы скорости или, наоборот, найти константу скорости реакции при заданной температуре путем определения концентрации в любой момент времени. Выразим период полураспада для реакции первого порядка:

Таким образом, время полупревращения реакции первого порядка не зависит от начальной концентрации исходного вещества и обратно пропорционально константе скорости реакции.
Эту зависимость можно представить
графически в координатах
![]() .
Так как время половинного превращения
в этом случае будет одинаковым, то в
каждый момент времени можно определить
концентрацию реагирующего вещества.
.
Так как время половинного превращения
в этом случае будет одинаковым, то в
каждый момент времени можно определить
концентрацию реагирующего вещества.

Для практических целей выгоднее выражать
скорость по убыли вещества. Пусть
V=const, в
момент начала реакции
![]() ,
число молей реагирующего вещества равно
а. Через
,
число молей реагирующего вещества равно
а. Через
![]() секунд прореагировало х молей вещества
А. Тогда в этот момент времени концентрация
вещества А будет
секунд прореагировало х молей вещества
А. Тогда в этот момент времени концентрация
вещества А будет
![]() или
или
![]() ,
где
,
где
![]() .
После разделения переменных и
интегрирования уравнение будет иметь
вид:
.
После разделения переменных и
интегрирования уравнение будет иметь
вид:
![]()
При
![]() ,
х=0
,
х=0
![]()
![]() ,
поэтому
,
поэтому
![]()
А→Р (V=const)
Исходное количество молей (![]() =0)
=0)
![]()
Через время
![]() (сек)
(сек)
![]()
Концентрация через время
![]() (сек)
(сек)
![]()
РЕАКЦИИ ВТОРОГО ПОРЯДКА (n=2).
Кинетическое уравнение реакции второго порядка:
![]()
Если
![]() ,
то
,
то
![]() .
.
![]() .
Разделим переменные и проинтегрируем:
.
Разделим переменные и проинтегрируем:
![]() и получим:
и получим:
![]() уравнения реакций второго порядка;
уравнения реакций второго порядка;
![]()
Для реакций второго порядка время полупревращения и константа скорости реакции обратно пропорциональны начальной концентрации исходного вещества С0.
Уравнение будет несколько сложнее для
реакции между веществами, концентрации
которых неодинаковы (![]() ).
).
А+В→Р (V=const)
Исходное количество молей (![]() =0)
=0)
![]()
![]()
Через время
![]() (сек)
(сек)
![]()
![]()
Концентрация через
![]() (сек)
(сек)
![]()
![]()
Окончательно получим: (![]() )
)
![]() уравнение реакции второго порядка;
уравнение реакции второго порядка;
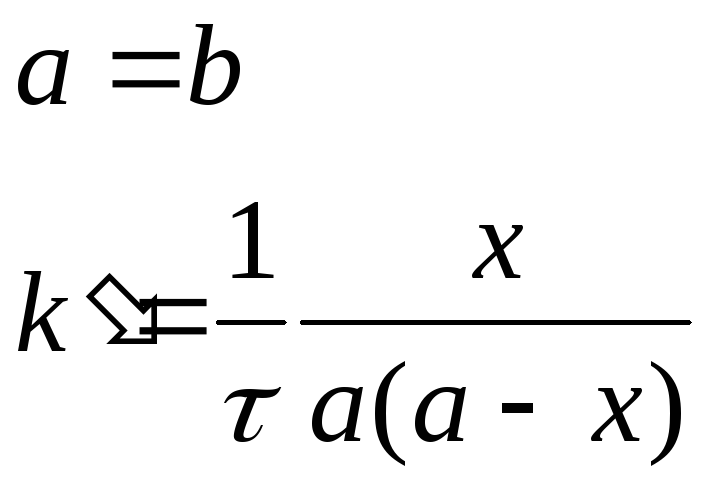
РЕАКЦИИ ТРЕТЬЕГО ПОРЯДКА (n=3).
Эти реакции встречаются очень редко. Примерами могут служить реакции:
2NO+O2 → 2NO2; 2CO+O2 → 2CO2
Основное кинетическое уравнение для реакции третьего порядка имеет вид:
![]()
Если
![]() ,
уравнение примет вид:
,
уравнение примет вид:
![]() .
.
![]()
![]()
![]()
![]()
Время полупревращения и константа скорости реакции третьего порядка обратно пропорциональны квадрату начальной концентрации вещества.
Для любого n-го порядка время полупревращения можно выразить по формуле:
![]() кроме
реакции первого порядка (n=1)
кроме
реакции первого порядка (n=1)
Для каждого порядка реакции существует своя собственная зависимость концентрации от времени.

