
- •3.Расчет интерференционной картины от двух источников.
- •6.Графическое вычисление результирующей амплитуды.Дифракция Френеля на круглом отверстии и на диске.
- •Дифракция френеля на круглых отверстиях
- •4. Интерференция света в тонких пластинах. Полосы равной толщины и полосы равного наклона.
- •5. Принцип Гюйгенса-Френеля. Зоны Френеля. Прямолинейное распространение света. Принцип гюйгенса-френеля
- •Метод зон френеля
- •7.Дифракция в паралллных лучах.Дифракция от одной щели.Условия максимумов и минимумов
- •§5 Дифракционная решетка.
- •8.Дифракционная решетка.Дифракционные спектры.Условия главных максимумов
- •9.Пространственная решетка. Формула Вульфа Брегга.Исследования структуры кристаллов. Оптически однородная среда.
- •15.Дисперсия света.Спектры.Электронная теория дисперсии света.
- •2. Электронная теория дисперсии света
- •13.Двойное лучепреломление.Построения Гюйгенса для одноосных кристаллов.
- •14.Давление света.Опыты Лебедева.Классическое и квантовое объяснение давления..
- •16.Тепловое излучение.Испускательная и поглощательная способности.Абсолютно черное тело.Законкиргофа.
- •22 Формулы де Бройля. Опытное обоснование корпускулярно-волнового дуализма свойств вещества. Дифракция электронов.
- •23 Излучение Вавилова-Черенкова.
- •24 Волновая функция и уравнение Шредингера. Статический смысл волновой функции.
- •25 Уравнение Шредингера для стационарных состояний. Условия, налагаемые на волновую функцию. Нормировка волновой функции.
- •26 Частица в одномерной прямоугольной потенциальной яме бесконечной глубины. Квантование энергии. Принцип соответствия Бора.
- •27 Туннельный эффект. Линейный гармонический осциллятор.
- •28 Основное состояние атома водорода по Шредингеру. Энергия основного cостояния. Размеры атома водорода.
- •29.Постулаты Бора. Теория атома водорода по Бору. Недостатки теории Бора.
- •30.Спектр атома водорода и его объяснение. Спектральные закономерности Ридберга
- •31.Атом водорода в квантовой механике. Главное , орбитальное и магнитное поле.
- •32.Спин электрона. Спиновое квантовое число. Опыт Штерна и Герлаха.
- •33.Поглощение свет. Спонтанное и вынужденное испускание излучения. Инверсная населенность. Усиливающая среда
- •34.Оптические квантовые генераторы(лазеры). Метастабильный уровень. Особенности лазерного излучения.
- •§2 Трехуровневая схема
- •35.Лазеры. Усиливающая среда. Порог генерации лазерного излучения.
- •36 Цепная реакция деления.Критическиеразмеры.Коэффициент размножения нейтронов.Мгновенные и запаздывающие нейтроны.
- •37 Принцип Паули.Распределение электронов в атоме по состояниям.Периодическая система Менделеева.
- •40 Радиоактивность. Закон радиоактивного распада.Закономерностипроисхождения α- β-и γ-излучения атомных ядер.Правила смещения
- •41 Ядерные реакции и законы сохранения.Эффективное поперечное сечение.
- •46. Понятие о ядерной энергетике. Ядерные реакторы. Понятие трансурановых элементов
37 Принцип Паули.Распределение электронов в атоме по состояниям.Периодическая система Менделеева.
При́нципПа́ули (принцип запрета) — один из фундаментальных принципов квантовой механики, согласно которому два и более тождественных фермиона (частиц с полуцелым спином) не могут одновременно находиться в одном квантовом состоянии. Распределение электронов в атоме происходит по принципу Паули, который может быть сформулирован для атома в простейшем виде: в одном и том же атоме не может быть более одного электрона с одинаковым набором четырех квантовых чисел: n, l,m,ms
Металлические свойства элементов в группе сверху вниз усиливаются, т.к. увеличивается количество энергетических уровней, отсюда увеличивается радиус атома , ослабевает притяжение электронов последнего энергетического уровня, уменьшается электроотрицательность, и следовательно усиливаются металлические свойства. В периоде от начала периода к концу металлические свойства ослабевают Т.К. возрастает заряд ядра атома элемента, усиливается притяжение электронов последнего энергетического уровня , возрастает электроотрицательность и ослабевают металлические свойства.
38Соотношение неопределенностей и его физический смысл
Если
имеется несколько (много) идентичных
копий системы в данном состоянии, то
измеренные значения координаты и
импульса будут подчиняться
определённомураспределению
вероятности —
это фундаментальный постулат квантовой
механики. Измеряя величину среднеквадратического
отклонения ![]() координаты
и среднеквадратического отклонения
координаты
и среднеквадратического отклонения![]() импульса,
мы найдем что:
импульса,
мы найдем что:![]() где ħ — приведённая
постоянная Планка.
Предыдущие математические результаты
показывают, как найти соотношения
неопределённостей между физическими
переменными, а именно, определить
значения пар переменных
где ħ — приведённая
постоянная Планка.
Предыдущие математические результаты
показывают, как найти соотношения
неопределённостей между физическими
переменными, а именно, определить
значения пар переменных ![]() и
и![]() ,
коммутатор которых имеет определённые
аналитические свойства.
,
коммутатор которых имеет определённые
аналитические свойства.
самое известное отношение неопределённости — между координатой и импульсом частицы в пространстве:
![]() отношение
неопределённости между двумя
ортогональными компонентами
оператора полного
углового момента частицы:
отношение
неопределённости между двумя
ортогональными компонентами
оператора полного
углового момента частицы:
![]() где
где ![]()
![]()
![]() различны
и
различны
и![]() обозначает
угловоймомент вдоль оси
обозначает
угловоймомент вдоль оси .следующее
отношение неопределённости междуэнергией и
временем часто представляется в
учебниках физики, хотя его интерпретация
требует осторожности, так как не
существует оператора, представляющего
время:
.следующее
отношение неопределённости междуэнергией и
временем часто представляется в
учебниках физики, хотя его интерпретация
требует осторожности, так как не
существует оператора, представляющего
время:
![]() Следует
подчеркнуть, что для выполнения условий
теоремы, необходимо, чтобы оба
самосопряженных оператора были
определены на одном и том же множестве
функций. Примером пары операторов, для
которых это условие нарушается, может
служить оператор проекции углового
момента
Следует
подчеркнуть, что для выполнения условий
теоремы, необходимо, чтобы оба
самосопряженных оператора были
определены на одном и том же множестве
функций. Примером пары операторов, для
которых это условие нарушается, может
служить оператор проекции углового
момента ![]() и
оператор азимутального угла
и
оператор азимутального угла![]() .
Первый из них является самосопряженным
только на множестве 2π-периодичных
функций, в то время как оператор
.
Первый из них является самосопряженным
только на множестве 2π-периодичных
функций, в то время как оператор![]() ,
очевидно, выводит из этого множества.
Для решения возникшей проблемы можно
вместо
,
очевидно, выводит из этого множества.
Для решения возникшей проблемы можно
вместо![]() взять
взять![]() ,
что приведет к следующей форме принципа
неопределенности[**
1]:
,
что приведет к следующей форме принципа
неопределенности[**
1]:![]()
Однако,
при ![]() условие
периодичности несущественно и принцип
неопределенности принимает привычный
вид:
условие
периодичности несущественно и принцип
неопределенности принимает привычный
вид:
![]() .
.
39 Заряд,масса и размеры атомных ядер.Зарядовые и массовые числа.Механический момент импульса ядра и его магнитный момент.Составядра.Нуклоны.атомные ядра имеют размеры примерно 10-14 -10-15 м (линейные размеры атома примерно 10~10 м). Атомное ядро состоит из элементарных частиц - протонов и нейтронов (протон-но-нейтронная модель ядра была предложена российским физиком Д. Д. Иваненко (р. 1904), а впоследствии развита В. Гейзенбергом).
Протон (р) имеет положительный заряд, равный заряду электрона, и массу покоя mp = 1,6726× 10- 27 кг »1836 те, где те - масса электрона. Нейтрон (n) - нейтральная частица с массой покоя тп-1,6749× 10- 27 кг »1839 те. Протоны и нейтроны называются нуклонами (от лат. nucleus - ядро). Общее число нуклонов в атомном ядре называется массовым числом А. Атомное ядро характеризуется зарядом Ze, где Z - зарядовое число ядра, равное числу протонов в ядре и совпадающее с порядковым номером химического элемента в Периодической системе элементов Менделеева. Известные в настоящее время 107 элементов таблицы Менделеева имеют зарядовые числа ядер от Z= 1 до Z= 107.
Ядро обозначается тем же символом, что и нейтральный атом: AZХ, где X - символ химического элемента, Z - атомный номер (число протонов в ядре), А - массовое число (число нуклонов в ядре).
Орбитальный
механический момент импульса атома
равен геометрической (векторной) сумме
орбитальных моментов всех электронов
атома: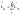 ,Z
– число электронов.
,Z
– число электронов.
4.
Орбитальный магнитный момент импульса
атома равен геометрической (векторной)
сумме магнитных моментов всех электронов
атома: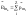 Нукло́ны (от лат. nucleus —
ядро) — общее название
для протонов и нейтронов.С
точки зрения электромагнитного
взаимодействия протон
и нейтрон разные частицы, так как протон
электрически заряжен, а нейтрон —
нет. Однако с точки зрениясильного
взаимодействия,
которое является определяющим в масштабе
атомных ядер, эти частицы неразличимы,
поэтому и был введен термин «нуклон»,
а протон и нейтрон стали рассматриваться
как два различных состояния нуклона,
различающихся проекцией изотопического
спина.
Близость свойств изоспиновых состояний
нуклона является одним из
проявлений изотопической
инвариантности
Нукло́ны (от лат. nucleus —
ядро) — общее название
для протонов и нейтронов.С
точки зрения электромагнитного
взаимодействия протон
и нейтрон разные частицы, так как протон
электрически заряжен, а нейтрон —
нет. Однако с точки зрениясильного
взаимодействия,
которое является определяющим в масштабе
атомных ядер, эти частицы неразличимы,
поэтому и был введен термин «нуклон»,
а протон и нейтрон стали рассматриваться
как два различных состояния нуклона,
различающихся проекцией изотопического
спина.
Близость свойств изоспиновых состояний
нуклона является одним из
проявлений изотопической
инвариантности
