- •Часть 2
- •Правила по технике безопасности
- •Лабораторная работа «окислительно-восстановительные реакции»
- •1. Теоретическая часть
- •1.1. Электроотрицательность элементов и образование химической связи
- •1.2. Основные положения теории окисления-восстановления
- •1.3. Правила определения степени окисления
- •1.4. Важнейшие восстановители и окислители
- •1.5. Изменение окислительно-восстановительных свойств простых веществ по периодам и группам
- •1.6. Типы окислительно-восстановительных реакций
- •1.7. Нахождение коэффициентов в уравнениях окислительно-восстановительных реакций
- •1.8. Направление и полнота протекания окислительно-восстановительных реакций
- •2. Экспериментальная часть
- •Контрольные вопросы
- •Лабораторная работа «гальванический элемент»
- •1. Теоретическая часть
- •1.1. Электрохимический ряд напряжений
- •1.2. Стандартные электродные потенциалы
- •1.3. Устройство и принцип работы гальванического элемента
- •1.4. Уравнение электродного потенциала (уравнение Нернста)
- •1.5. Поляризационные явления в гальванических элементах
- •2. Экспериментальная часть
- •Контрольные вопросы
- •Лабораторная работа «электролиз»
- •1. Теоретическая часть
- •1.1. Сущность электролиза
- •1.2. Электролиз расплава
- •1.3. Электролиз водных растворов
- •1.4. Законы Фарадея (законы электролиза)
- •1.5. Примеры решения задач
- •2. Экспериментальная часть
- •Контрольные вопросы
- •Лабораторная работа «коррозия металлов»
- •1. Теоретическая часть
- •1.1. Общие положения
- •1.2. Основные типы коррозии металлов
- •1.3. Классификация коррозионных процессов
- •1.3.1. Химическая коррозия
- •1.3.2. Электрохимическая коррозия
- •2. Экспериментальная часть
- •Контрольные вопросы
- •Лабораторная работа «защита от коррозии»
- •1. Теоретическая часть
- •1.1. Электрохимические методы
- •1.2. Методы, связанные с изменением свойств корродирущего металла
- •1.2.1. Методы изоляции металла от окружающей среды
- •1.2.2. Легирование металлов и сплавов
- •1.3. Методы, связанные с изменением свойств коррозионной среды
- •1.4. Комбинированные методы защиты
- •2. Экспериментальная часть
- •Контрольные вопросы
- •Лабораторная работа «коллоидные растворы»
- •1. Теоретическая часть
- •1.1. Коллоидные растворы как дисперсные системы
- •1.2. Получение коллоидных систем
- •1.2.1. Методы диспергирования
- •1.2.2. Методы конденсации
- •1.3. Строение мицелл золей
- •1.4. Явление коагуляции
- •1.5. Примеры решения задач
- •2. Экспериментальная часть
- •Контрольное задание
- •Контрольные вопросы
- •Лабораторная работа «жесткость воды. Методы умягчения и определения жесткости»
- •1. Теоретическая часть
- •1.1. Жёсткость воды
- •1.1.1. Компоненты и виды жёсткости
- •1.1.2. Действие жёсткости
- •1.1.3. Единицы измерения жёсткости
- •1.2. Умягчение воды методами осаждения
- •1.2.1. Термический метод
- •1.2.2. Реагентные методы
- •1.3. Метод ионного обмена
- •1.3.1. Иониты и процессы ионного обмена
- •1.3.2. Обессоливание воды методом ионного обмена
- •1.3.3. Умягчение воды методом ионного обмена
- •1.4. Определение жёсткости воды
- •1.4.1. Титриметрический метод анализа
- •1.4.2. Определение карбонатной жёсткости воды
- •1.4.3. Определение общей жёсткости воды
- •2. Экспериментальная часть
- •Контрольное задание
- •Контрольные вопросы
- •Список рекомендуемой литературы Основная
- •Дополнительная
- •Часть 2
- •400074, Волгоград, ул. Академическая, 1
- •В двух частях
- •Часть 2 Волгоград 2010
Контрольные вопросы
К какому типу коррозии можно отнести окисление железа хлором?
Может ли протекать электрохимическая коррозия в отсутствие электролита?
Почему химически чистое железо является более стойким против коррозии, чем техническое железо? Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии технического железа во влажном воздухе и в сильнокислой среде.
В раствор соляной кислоты поместили две цинковые пластинки, одна из которых частично покрыта никелем. В каком случае процесс коррозии цинка происходит интенсивнее? Ответ мотивируйте, составив уравнения соответствующих процессов.
Железное изделие покрыто свинцом. Составьте уравнения анодного и катодного процессов коррозии этого изделия при нарушении целостности покрытия во влажном воздухе и в растворе соляной кислоты. Какие продукты коррозии образуются в первом и во втором случаях?
Алюминий склепан с медью. Какой из металлов будет подвергаться коррозии, если эти металлы попадут в кислую среду? Составьте схему гальванического элемента, образующегося при этом. Подсчитайте ЭДС этого элемента для стандартных условий.
Лабораторная работа «защита от коррозии»
Цель работы: исследование процессов, протекающих при осуществлении различных методов защиты металлов от коррозии
1. Теоретическая часть
Необратимые коррозионные процессы наносят большой вред в различных отраслях экономики. Потери чугуна и стали вследствие коррозии исчисляются десятками миллионов тонн. Из-за коррозионного разрушения даже одной детали может выйти из строя вся машина. Коррозия снижает точность показаний приборов и стабильность их работы, выводит из строя электрические приборы. Поэтому защита металла от коррозии в технике, промышленности, сельском хозяйстве, строительстве приобретает первостепенное значение.
Различают следующие основные методы защиты металлов от коррозии: 1) электрохимические; 2) методы, связанные с изменением свойств корродирущего металла; 3) методы, связанные с изменением свойств коррозионной среды; 4) комбинированные методы.
1.1. Электрохимические методы
К электрохимическим методам защиты относятся: 1) протекторная защита и 2) электрозащита.
|
|
|
Рис. 8. Схема протекторной защиты |
Протекторная защита может также осуществляться, если металл-протектор использован в виде покрытия (см. далее анодные покрытия) или даже при непосредственном контакте металлов. Например, контакт свинца с более активным цинком способен уменьшить коррозию свинца, происходящую по уравнению:
Pb + 2CH3COOH = (CH3COO)2Pb + H2;
Pb + 2H+ = Pb2+ + H2.
Образовавшиеся ионы свинца легко обнаруживаются при помощи иона I–, образуя с ним яркий золотисто-жёлтый осадок PbI2:
Pb2+ + 2I– = PbI2↓.
Если свинец находится в контакте с цинком, золотисто-жёлтое окрашивание или появляется позже, или совсем отсутствует, что говорит об отсутствии в растворе ионов Pb2+. Сравним стандартные электродные потенциалы цинка и свинца:
Е0Zn2+/Zn0 = – 0,762 B, в то время как Е0Pb2+/Pb0 = – 0,126 B.
Таким образом, получаем коррозионную гальванопару:
(–) Zn │CH3COOH, KI│Pb (+),
в которой роль анода выполняет цинк как более электроотрицательный металл, окисляющийся при работе гальванопары. На свинцовом катоде происходит процесс восстановления ионов водорода из кислого раствора:
анод: Fe – 2ē = Fe2+ (окисление);
катод: 2H+ + 2ē = H2 (восстановление).
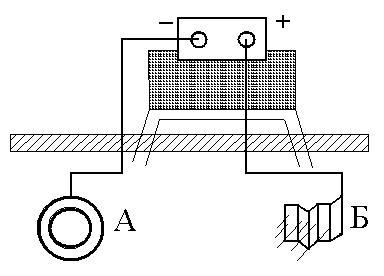
|
|
|
Рис 9. Схема катодной защиты |
Электрозащита (катодная защита) заключается в том, что защищаемая конструкция А (рис. 9) находящаяся в среде электролита (например, в почвенной воде), присоединяется к катоду (отрицательно заряженному электроду) внешнего источника электрического напряжения. Защищаемая конструкция становится катодом (принимает отрицательный заряд). В ту же агрессивную среду помещают кусок (Б) бросового металла (рельс, балка и т.п.), присоединяемый к аноду внешнего источника электричества. В процессе коррозии кусок старого металла становится анодом и разрушается. Катодный метод используют в борьбе с коррозией подземных сооружений. Он имеет существенное преимущество перед протекторной защитой. Так, для последней радиус действия равен приблизительно 50 м, поэтому при необходимости защищать большие поверхности металла требуется целая серия протекторов. Радиус же действия катодной защиты около 2000м.