
- •Часть 2
- •Правила по технике безопасности
- •Лабораторная работа «окислительно-восстановительные реакции»
- •1. Теоретическая часть
- •1.1. Электроотрицательность элементов и образование химической связи
- •1.2. Основные положения теории окисления-восстановления
- •1.3. Правила определения степени окисления
- •1.4. Важнейшие восстановители и окислители
- •1.5. Изменение окислительно-восстановительных свойств простых веществ по периодам и группам
- •1.6. Типы окислительно-восстановительных реакций
- •1.7. Нахождение коэффициентов в уравнениях окислительно-восстановительных реакций
- •1.8. Направление и полнота протекания окислительно-восстановительных реакций
- •2. Экспериментальная часть
- •Контрольные вопросы
- •Лабораторная работа «гальванический элемент»
- •1. Теоретическая часть
- •1.1. Электрохимический ряд напряжений
- •1.2. Стандартные электродные потенциалы
- •1.3. Устройство и принцип работы гальванического элемента
- •1.4. Уравнение электродного потенциала (уравнение Нернста)
- •1.5. Поляризационные явления в гальванических элементах
- •2. Экспериментальная часть
- •Контрольные вопросы
- •Лабораторная работа «электролиз»
- •1. Теоретическая часть
- •1.1. Сущность электролиза
- •1.2. Электролиз расплава
- •1.3. Электролиз водных растворов
- •1.4. Законы Фарадея (законы электролиза)
- •1.5. Примеры решения задач
- •2. Экспериментальная часть
- •Контрольные вопросы
- •Лабораторная работа «коррозия металлов»
- •1. Теоретическая часть
- •1.1. Общие положения
- •1.2. Основные типы коррозии металлов
- •1.3. Классификация коррозионных процессов
- •1.3.1. Химическая коррозия
- •1.3.2. Электрохимическая коррозия
- •2. Экспериментальная часть
- •Контрольные вопросы
- •Лабораторная работа «защита от коррозии»
- •1. Теоретическая часть
- •1.1. Электрохимические методы
- •1.2. Методы, связанные с изменением свойств корродирущего металла
- •1.2.1. Методы изоляции металла от окружающей среды
- •1.2.2. Легирование металлов и сплавов
- •1.3. Методы, связанные с изменением свойств коррозионной среды
- •1.4. Комбинированные методы защиты
- •2. Экспериментальная часть
- •Контрольные вопросы
- •Лабораторная работа «коллоидные растворы»
- •1. Теоретическая часть
- •1.1. Коллоидные растворы как дисперсные системы
- •1.2. Получение коллоидных систем
- •1.2.1. Методы диспергирования
- •1.2.2. Методы конденсации
- •1.3. Строение мицелл золей
- •1.4. Явление коагуляции
- •1.5. Примеры решения задач
- •2. Экспериментальная часть
- •Контрольное задание
- •Контрольные вопросы
- •Лабораторная работа «жесткость воды. Методы умягчения и определения жесткости»
- •1. Теоретическая часть
- •1.1. Жёсткость воды
- •1.1.1. Компоненты и виды жёсткости
- •1.1.2. Действие жёсткости
- •1.1.3. Единицы измерения жёсткости
- •1.2. Умягчение воды методами осаждения
- •1.2.1. Термический метод
- •1.2.2. Реагентные методы
- •1.3. Метод ионного обмена
- •1.3.1. Иониты и процессы ионного обмена
- •1.3.2. Обессоливание воды методом ионного обмена
- •1.3.3. Умягчение воды методом ионного обмена
- •1.4. Определение жёсткости воды
- •1.4.1. Титриметрический метод анализа
- •1.4.2. Определение карбонатной жёсткости воды
- •1.4.3. Определение общей жёсткости воды
- •2. Экспериментальная часть
- •Контрольное задание
- •Контрольные вопросы
- •Список рекомендуемой литературы Основная
- •Дополнительная
- •Часть 2
- •400074, Волгоград, ул. Академическая, 1
- •В двух частях
- •Часть 2 Волгоград 2010
1.4. Явление коагуляции
Коагуляция — процесс слипания частиц дисперсной фазы с образованием более крупных агрегатов. Внешне коагуляция проявляется в помутнении золя, в изменении его окраски, в выпадении твёрдой фазы в осадок или в образовании студнеобразной массы.
Коагуляция происходит вследствие полной или частичной потери защитного слоя, например двойного электрического слоя. Её можно вызвать нагреванием, замораживанием, интенсивным перемешиванием, прибавлением к золю электролита.
Коагуляция при нагревании происходит, потому что, во-первых, кинетическая энергия частиц возрастает и электростатическое отталкивание диффузных слоев при сближении мицелл не может препятствовать соприкосновению частиц. Во-вторых, при повышении температуры в результате десорбции (процесс, обратный адсорбции) уменьшается количество потенциалопределяющих ионов; следовательно, уменьшается число противоионов, в том числе, и в диффузном слое, который становится тоньше и перестает выполнять защитную функцию.
Наиболее изучена коагуляция электролитами. Минимальная концентрация электролита, достижение которой в коллоидном растворе вызывает коагуляцию золя, называют порогом коагуляции.
Порог коагуляции оценивается как молярная концентрация эквивалента вещества-коагулянта, измеряется в ммоль экв/л (по ранее применявшейся терминологии — «нормальная концентрация», мг-экв/л) и может быть рассчитан по формуле:
![]() (5)
(5)
где Сн — молярная концентрация эквивалента вещества в добавленном электролите-коагулянте, моль экв/л; Vэл и Vзоля — соответственно объёмы добавленного электролита и исходного золя, л; 1000 — коэффициент перехода от моль экв/л к ммоль экв/л.
Коагуляция электролитами подчиняется правилам Шульце—Гарди, которые можно сформулировать следующим образом:
1) коагуляцию вызывает ион, заряженный противоположно грануле золя;
2) чем больше заряд коагулирующего иона, тем сильнее его коагулирующее действие.
Механизм действия электролитов основан на том, что увеличение общей концентрации ионов в растворе приводит к сжатию диффузного слоя противоионов вокруг мицеллы, причем действие оказывают преимущественно ионы коагулянта, имеющие одинаковый заряд с ионами диффузного слоя. С увеличением заряда z коагулирующего иона его действие многократно возрастает. Количественно второе правило Шульце—Гарди выражается зависимостью:
Спор
~
![]() (6)
(6)
Следовательно, для одно-, двух-, и трехзарядного ионов пороги коагуляции будет относиться друг к другу как
![]() ,
,
а соотношение объёмов электролитов, которые надо добавить для достижения коагуляции, будет обратным.
1.5. Примеры решения задач
Пример 1. Определение заряда коллоидных частиц.
Золь иодида серебра AgI получен при добавлении к 0,02 л 0,01 н. раствора KI 0,028 л 0,005 н. AgNO3. Определить заряд полученного золя и написать формулу его мицеллы.
Решение. При смешивании растворов AgNO3 и KI протекает реакция:
AgNO3 + KI = AgI↓ + KNO3.
Определяем количества AgNO3 и KI, участвующих в реакции:
AgNO3 0,005·0,028 = 1,4 . 10–4 ммоль;
KI 0,02.0,01 = 2,0·10–4 ммоль.
Расчёт показывает, что в растворе имеется избыток KI, следовательно, ядром коллоидных частиц золя иодида серебра будут адсорбироваться ионы I– и частицы золя приобретут отрицательный заряд. Противоионами будут ионы К+. Формула мицеллы золя иодида серебра при условии избытка KI имеет вид:
{m[AgI]·nI–·(n–x)K+}x– xK+.
Пример 2. Определение минимального объёма электролита, необходимого для получения золя.
Какой объём 0,002 н. раствора BaCl2 надо прибавить к 0,03 л 0,0006 н. Al2(SO4)3, чтобы получить положительно заряженные частицы золя сульфата бария? Написать формулу мицеллы золя BaSO4.
Решение. Образование золя BaSO4 происходит по уравнению:
BaCl2 + Al2(SO4)3 = 3BaSO4↓ + 2AlCl3.
Если вещества участвуют в стехиометрических соотношениях, то для реакции необходим объем раствора BaCl2:
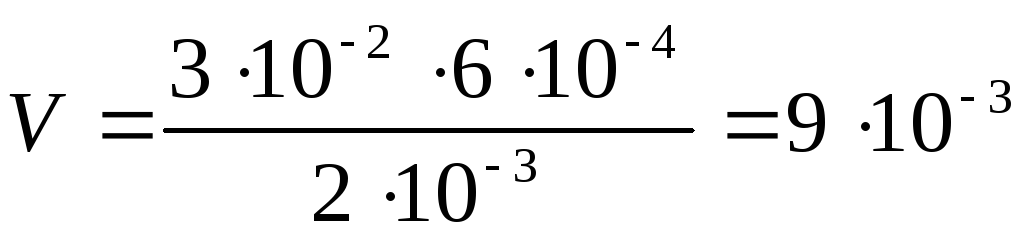 (л).
(л).
Для получения положительных частиц золя BaSO4 в растворе должен быть избыток хлорида бария по сравнению с сульфатом алюминия. Следовательно, для реакции нужно взять больше чем 0,009 л 0,002 н. раствора BaCl2.
Формула мицеллы золя сульфата бария:
{m[BaSO4]·nBa2+·2(n–x)Cl–}x– 2xCl–.
Пример 3. Вычисление порога коагуляции электролита.
В каждую из трёх колб налито по 0,01 л золя хлорида серебра. Для достижения коагуляции золя в первую колбу добавлено 0,002 л 1 н. NaNO3, во вторую 0,012 л. 0,01 н. Сa(NO3)2; в третью 0,007 л 0,001 н. Al(NO3)3. Вычислить пороги коагуляции электролитов, определить знак заряда частиц золя.
Решение. Вычисляем пороги коагуляции для каждого из добавляемых электролитов по формуле (5):
![]() ммоль/л;
ммоль/л;
![]() ммоль/л;
ммоль/л;
![]() ммоль/л.
ммоль/л.
Добавляемые электролиты NaNO3, Ca(NO3)3 и Al(NO3)3 cодержат одинаковый анион NO3– и катионы Na+, Ca2+, Al3+, различающиеся величиной заряда. Поскольку действие электролитов различно, коагулирующим действием обладает катион, причем наибольшим действием — трехвалентный ион алюминия. Это следует из наименьшего значения порога коагуляции для Al(NO3)3. Также соотношение значений порогов для ионов разных зарядов соответствует второму правилу Шульце—Гарди (формула (6)). Итак, частицы золя хлорида серебра заряжены отрицательно.
