
- •Глава III. Основы молекулярно-кинетической теории
- •§12. Основные понятия и исходные положения
- •§13. Статистический метод исследования систем. Понятие о случайной величине и функции распределения
- •§14. Идеальный газ
- •§15. Основное уравнение молекулярно - кинетической теории
- •15.1. Вывод основного уравнения молекулярно-кинетической теории
- •15.2. Другие формы записи основного уравнения молекулярно-кинетической теории. Абсолютная температура - мера энергии теплового движения молекул
- •§16. Следствия из основного уравнения молекулярно-кинетической теории
- •§17. Распределение молекул по скоростям и кинетической энергии (распределение Максвелла)
- •§18. Барометрическая формула. Распределение молекул в потенциальном силовом поле (распределение Больцмана)
- •§19. Средняя длина свободного пробега молекул. Понятие о физическом вакууме
- •§20. Закон равномерного распределения энергии по степеням свободы
- •§21. Явления переноса в газах
- •21.1. Диффузия
- •21.2. Внутреннее трение (вязкость)
- •21.3. Теплопроводность
§18. Барометрическая формула. Распределение молекул в потенциальном силовом поле (распределение Больцмана)
При выводе основного уравнения молекулярно-кинетической теории и закона распределения Максвелла предполагалось, что на молекулы не действуют никакие внешние силы. Поэтому можно было считать, что молекулы равномерно распределены по объему сосуда.
Фактически же молекулы любого газа всегда находятся в поле тяготения Земли. Если бы не было теплового движения молекул атмосферного воздуха, то все они упали бы на Землю. Если бы не было тяготения, то атмосферный воздух рассеялся бы по всей Вселенной. Таким образом, тяготение и тепловое движение приводят газ в состояние, при котором его давление и концентрация молекул зависят от высоты.
Формула зависимости атмосферного давления от высоты над уровнем Земли получила название барометрической формулы. Для вывода барометрической формулы введем некоторые допущения:
- будем считать воздух идеальным газом, так как даже у поверхности Земли давление воздуха сравнительно невелико;
- ускорение свободного падения считаем практически постоянным и не зависящим от высоты, так как атмосферное давление становится пренебрежительно малым уже на высоте 100-200 км, гораздо меньшей по сравнению с радиусом Земли;
Рис.18.1

Атмосферное давление обусловлено весом вышележащих слоев газа. Выделим мысленно вертикальный столб воздуха (рис. 18.1) с площадью основания S.
Пусть на высоте h давление газа равно p, а на высоте (h+dh) давление равно (p+dp). Так как давление с увеличением высоты падает, то его приращение будет отрицательным (dp< 0).
Разность давлений p и (p+dp) равна весу газа, заключенного в столбе высотой dh, деленной на площадь S, то есть
![]()
или
![]() ,
(18.1)
,
(18.1)
где - плотность воздуха на высота h.
Заменив в этом уравнении плотность по формуле, полученной с помощью уравнения Клапейрона-Менделеева (14.1):
![]()
запишем выражение (18.1) в виде
![]()
или
![]() .
(18.2)
.
(18.2)
Полагая T=const (в соответствии с принятыми допущениями) и интегрируя уравнение (18.2) по высоте от 0 до h, получим
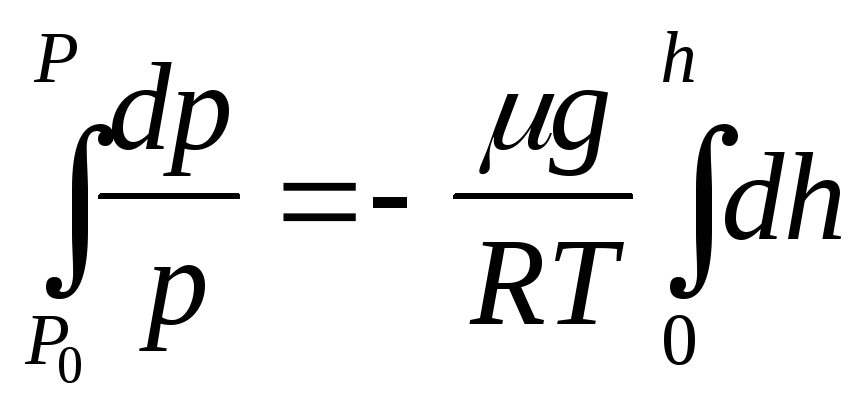
или
![]() ,
,
откуда находим
![]() ,
(18.3)
,
(18.3)
где p0 - давление на высоте h = 0.
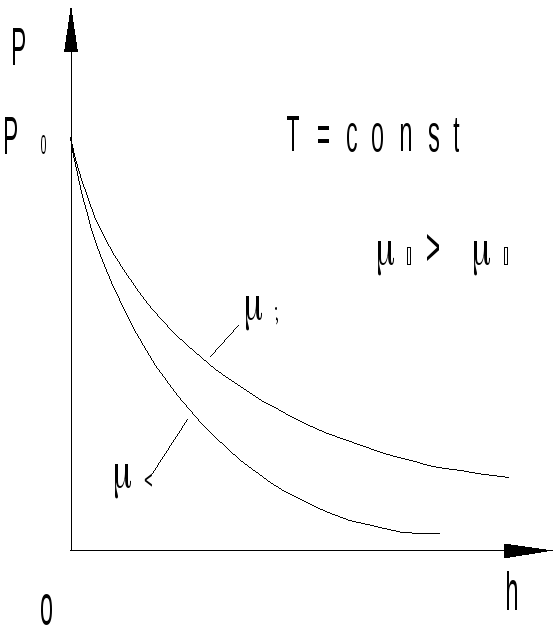
Выражение (18.3) носит название барометрической формулы. Из нее следует, что давление газа убывает с ростом высоты тем быстрее, чем тяжелее газ (чем больше ) и чем ниже температура. На рис.18.2 изображены две зависимости вида (18.3), соответствующие двум газам с разными молярными массами 1 и 2 при T=const (давление p0 для h=0 у обоих газов принято условно одинаковым).
Рис.18.2
![]() (18.4)
(18.4)
лежит в основе принципа работы авиационных высотомеров (альтиметров): измеряя с помощью барометра давление, эти приборы показывают значение высоты над уровнем моря.
Из формулы (18.3) можно получить соотношение между концентрациями газа на различной высоте, подставив в нее уравнение состояния газа в форме (15.26):
![]() .
(18.5)
.
(18.5)
Заменив отношение /R для однородного газа на отношение m/k (m - масса молекулы) и сократив обе части равенства на kТ, получим
![]() , (18.6)
, (18.6)
где n0 - концентрация молекул газа при h =0.
Из выражения (18.6) следует, что чем тяжелее газ (больше m) и чем меньше его температура Т, тем больше концентрация молекул у поверхности Земли по сравнению с концентрацией на некоторой высоте (преобладание тяготения Земли над тепловым движением молекул). И наоборот, чем легче газ и больше его температура, тем более тепловое движение молекул преобладает над тяготением и концентрация медленно убывает с ростом высоты.
Рис.18.3
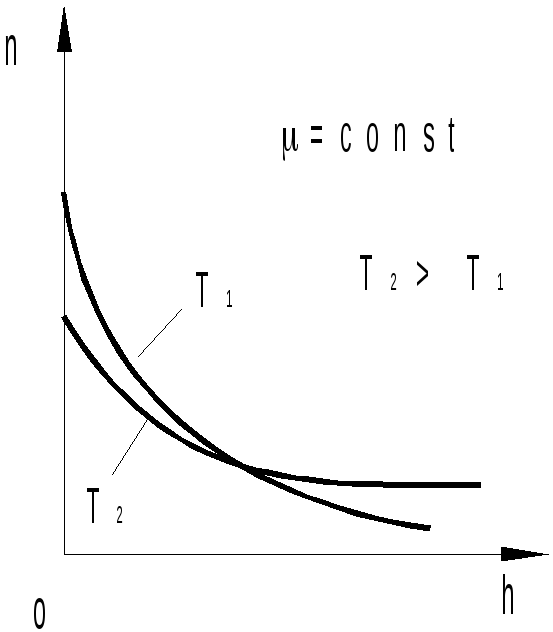
Сравнение этих зависимостей показывает, что чем меньше температура газа, тем большая неоднородность наблюдается в распределении концентрации молекул газа по высоте.
Произведение mgh в уравнении (18.6) представляет собой потенциальную энергию Wn одной молекулы в поле тяготения Земли. Следовательно, распределение молекул по высоте является вместе с тем и распределением их по значениям
потенциальной энергии:
![]() .
(18.7)
.
(18.7)
Австрийский физик Л. Больцман доказал, что формула (18.7) справедлива для любой совокупности одинаковых частиц, находящихся в состоянии хаотического теплового движения в потенциальном поле любой природы. В связи с этим функцию (18.7) называют распределением Больцмана. Таким образом, распределение (18.6) является частным случаем более общего распределения (18.7). Между распределением Максвелла (17.6) и Больцмана (18.7) имеется большое сходство: и в том и в другом распределении в показателе степени экспоненты стоит отношение энергии молекулы (в одном случае потенциальной, а в другом кинетической) к величине кТ, определяющей среднюю кинетическую энергию теплового хаотического движения.
Распределения
(17.6) и (18.7) могут быть объединены в одно
распределение
Максвелла-Больцмана,
согласно которому число молекул,
компоненты скоростей которых лежат в
пределах от
![]() до
до
![]() ,а координаты
в пределах от
,а координаты
в пределах от
![]() до
до
![]() равно
равно
![]() , (18.8)
, (18.8)
где
![]() .
.
Из
формулы (18.8) следует, что
![]() определяется полной энергий молекулы
определяется полной энергий молекулы![]() .
.
Таким образом, в состоянии с постоянной температурой скорости молекул в каждой точке пространства распределены по закону Максвелла. Влияние силового поля сказывается только на изменении концентрации молекул от точки к точке.
