
- •Глава IV. Физические основы термодинамики
- •§22. Термодинамический метод исследования систем. Исходные положения термодинамики
- •§23. Внутренняя энергия системы
- •§24. Работа и теплота
- •§25 Теплоемкость
- •§26. Первый закон термодинамики
- •§27. Применение первого закона термодинамики к основным термодинамическим процессам
- •27.1. Изохорический процесс
- •27.2. Изобарический процесс
- •27.3. Изотермический процесс
- •27.4. Адиабатический процесс
- •§28. Второй закон термодинамики
- •28.1. Обратимые и необратимые процессы
- •28.2. Второй закон термодинамики
- •28.3. Понятие энтропии
- •28.4. Тепловая машина. Коэффициент полезного действия
- •28.5. Цикл Карно
- •28.6. Границы применимости второго закона термодинамики
Глава IV. Физические основы термодинамики
§22. Термодинамический метод исследования систем. Исходные положения термодинамики
Термодинамический метод исследования в отличие от статистического не учитывает внутреннего строения систем, а изучает превращения энергии в них. При этом изучаются преимущественно системы, находящиеся в состоянии равновесия, а также равновесные термодинамические процессы (§12).
Термодинамическая система называется изолированной, если она не может обмениваться энергией с другими системами (окружающей средой).
Если нет обмена энергией в форме теплоты, то система называется теплоизолированной.
К простейшим процессам, изучаемым в термодинамике, относятся следующие:
-изотермический, происходящий при постоянной температуре;
-изохорический (изохорный), происходящий при постоянном объеме;
-изобарический (изобарный), происходящий при постоянном давлении;
-адиабатический (адиабатный), происходящий в системе без теплообмена с внешней средой.
Термодинамика в качестве основного исходного положения принимает (постулирует) следующее положение, вытекающее из опыта: изолированная термодинамическая система с течением времени всегда приходит в состояние термодинамического равновесия и никогда самопроизвольно выйти из него не может.
Следовательно, если система вначале была не изолирована и не находилась в равновесном состоянии, то после осуществления изоляции она, по истечении некоторого времени, перейдет в состояние равновесия.
Другое исходное положение термодинамики связанно с одним из основных понятий физики - температурой.
Опыт показывает, что если привести в соприкосновение два различно нагретых тела (две равновесные системы), то независимо от того, одинаковы или различны у них объемы (внешние параметры), более нагретое тело будет охлаждаться, менее нагретое - нагреваться. С течением времени новая система, образованная из двух, придет в другое равновесное состояние. Отсюда следует, что состояние каждой системы определяется не только ее внешними параметрами, но и еще одной величиной, характеризующей внутреннее состояние системы. Численные значения этой величины для различных равновесных систем при их тепловом контакте выравниваются. Эта величина, выражающая состояние внутреннего движения равновесной системы, определяемая внешними параметрами и энергией системы, называется температурой. Температура в этом смысле является мерой интенсивности теплового движения.
Существование параметра системы, называемого температурой, утверждается следующим исходным положением термодинамики:
состояние термодинамической системы определяется не только внешними условиями, но и температурой - внутренним параметром системы.
Это свойство обнаруживается как степень нагретости тела - холодное, теплое, горячее.
§23. Внутренняя энергия системы
Любая
термодинамическая система обладает
полной энергией W,
которая складывается из кинетической
энергии механического движения системы
как целого
![]() ,
потенциальной энергии
,
потенциальной энергии![]() ,
зависящей от положения системы во
внешнем силовом поле (гравитационном,
электрическом или магнитном) и внутренней
энергии
,
зависящей от положения системы во
внешнем силовом поле (гравитационном,
электрическом или магнитном) и внутренней
энергии![]() ,
зависящей только от термодинамического
состояния системы:
,
зависящей только от термодинамического
состояния системы:
![]() .
(23.1)
.
(23.1)
В термодинамике обычно рассматривают макроскопически неподвижные системы, не подверженные воздействию внешних полей. Поэтому, рассматривая процессы изменения энергетических состояний термодинамических систем, имеют в виду именно их внутреннюю энергию.
Под внутренней энергией системы понимают сумму энергий всех видов внутренних движений частиц в системе и энергию их взаимодействия. Например, внутренняя энергия газа многоатомных молекул (аммиак, углекислый газ и т.п.) состоит из
-кинетической энергии теплового поступательного и вращательного движений молекул;
-кинетической и потенциальной энергии колебаний атомов в молекулах;
-потенциальной энергии межмолекулярного взаимодействия;
-энергии электронных оболочек атомов и ионов;
-кинетической и потенциальной энергии взаимодействия нуклонов в ядрах атомов.
Р
1
b
2
Рис.23.1
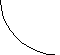

 а
а
 V
V
То есть внутренняя энергия является функцией состояния системы.
Иначе
говоря, изменение внутренней энергии
(![]() ),
равное разности внутренней энергии в
этих состояниях (
),
равное разности внутренней энергии в
этих состояниях (![]() ),
при переходе системы из состояния 1 в
состояние 2 (рис.23.1) не зависит от вида
перехода, то есть
),
при переходе системы из состояния 1 в
состояние 2 (рис.23.1) не зависит от вида
перехода, то есть
![]() .
(23.2)
.
(23.2)
В частности, если в результате какого-либо процесса система возвращается в исходное состояние (совершается круговой процесс), то полное изменение ее внутренней энергии всегда равно нулю:
![]() . (23.3)
. (23.3)
Внутренняя энергия системы, находящейся в термодинамическом равновесии, зависит только от ее температуры и внешних параметров. Например, внутренняя энергия газа постоянной массы зависит от температуры Т и объема V системы:
![]() , (23.4)
, (23.4)
так как энергия теплового движения молекул газа зависит от его температуры, а энергия взаимодействия молекул - от среднего расстояния между ними, то есть при данной массе газа - от его объема.
В дальнейшем не будем рассматривать процессы, сопровождающиеся изменением энергии электронных оболочек атомов и ионов, а также изменением внутриядерной энергии. Кроме того, в случае идеального газа нет сил межмолекулярного взаимодействия, а связи между атомами в многоатомных молекулах абсолютно жесткие.
Следовательно, внутренняя энергия идеального газа равна суммарной кинетической энергии хаотического движения молекул.
На
основании закона равномерного
распределения энергии по степеням
свободы (20.1) выражение для внутренней
энергии
![]() одного моля идеального газа запишется
как
одного моля идеального газа запишется
как
![]() , (23.5)
, (23.5)
где <Wk> - средняя кинетическая энергия молекулы; NA - постоянная Авогадро; i - число степеней свободы молекулы. Выражение для внутренней энергии U идеального газа массой М можно записать как
![]() ,
(23.6)
,
(23.6)
где = M/ - количество вещества (число молей) газа; - его молярная масса.
Как следует из (23.6), внутренняя энергия идеального газа зависит только от его температуры (все остальные величины для определенного газа считаем постоянными), то есть
![]() . (23.7)
. (23.7)
