
- •Содержание
- •Глава 1. Химия пищевых веществ и питание человека 6
- •Глава 2. Белковые вещества 14
- •Глава 3. Углеводы 111
- •Глава 4. Липиды (жиры и масла) 175
- •Глава 5. Минеральные вещества 211
- •Глава 6. Витамины 231
- •Глава 7. Пищевые кислоты 248
- •Глава 8. Ферменты 261
- •Глава 9. Пищевые и биологически активные добавки 330
- •Глава 10. Вода 444
- •Глава 11. Безопасность пищевых продуктов 475
- •Глава 12. Основы рационального питания 540
- •Предисловие ко второму изданию
- •Глава 1. Химия пищевых веществ и питание человека
- •Глава 2. Белковые вещества
- •2.1. Белки в питании человека. Проблема белкового дефицита на земле
- •2.2. Белково-калорийная недостаточность и ее последствия. Пищевые аллергии
- •2.3. Аминокислоты и их некоторые функции в организме
- •2.4. Незаменимые аминокислоты. Пищевая и биологическая ценность белков
- •2.5. Строение пептидов и белков. Физиологическая роль пептидов
- •2.6 Белки пищевого сырья
- •Белки масличных культур
- •Белки картофеля, овощей и плодов
- •Белки мяса и молока
- •2.7. Новые формы белковой пищи. Проблема обогащения белков лимитирующими аминокислотами
- •2.8. Функциональные свойства белков
- •2.9. Превращения белков технологическом потоке
- •2.10. Качественное и количественное определение белка
- •Контрольные вопросы
- •Глава 3. Углеводы
- •3.1. Общая характеристика углеводов
- •Моносахариды
- •Полисахариды
- •3.2. Физиологическое значение углеводов
- •Усваиваемые и неусваиваемые углеводы
- •Углеводы в пищевых продуктах
- •3.3. Превращения углеводов при производстве пищевых продуктов Гидролиз углеводов
- •Реакции дегидратации и термической деградации углеводов
- •Реакции образования коричневых продуктов
- •Процессы брожения
- •3.4. Функции моносахаридов и олигосахаридов в пищевых продуктах Гидрофильность
- •Связывание ароматических веществ
- •Образование продуктов неферментативного потемнения и пищевого аромата
- •Сладость
- •3.5. Функции полисахаридов в пищевых продуктах Структурно-функциональные свойства полисахаридов
- •Крахмал
- •Гликоген
- •Целлюлоза
- •Гемицеллюлозы
- •Пектиновые вещества
- •3.6. Методы определения углеводов в пищевых продуктах
- •Контрольные вопросы
- •Глава 4. Липиды (жиры и масла)
- •4.1. Строение и состав липидов. Жирнокислотный состав масел и жиров
- •4.2. Реакции ацилглицеринов с участием сложноэфирных групп Гидролиз триацилглицеринов
- •Переэтерификация
- •4.3. Реакции ацилглицеринов с участием углеводородных радикалов Присоединение водорода (гидрирование ацилглицеринов)
- •Окисление ацилглицеринов
- •4.4. Свойства и превращения глицерофосфолипидов
- •4.5. Методы выделения липидов из сырья и пищевых продуктови их анализ
- •4.6. Пищевая ценность масел и жиров
- •Контрольные вопросы
- •Глава 5. Минеральные вещества
- •5.1. Роль минеральных веществ в организме человека
- •5.2. Роль отдельных минеральных элементов Макроэлементы
- •Микроэлементы
- •5.3. Влияние технологической обработки на минеральный состав пищевых продуктов
- •5.4. Методы определения минеральных веществ
- •Электрохимические методы анализа
- •Контрольные вопросы
- •Глава 6. Витамины
- •6.1. Водорастворимые витамины
- •6.2. Жирорастворимые витамины
- •6.3. Витаминоподобные соединения
- •6.4. Витаминизация продуктов питания
- •Контрольные вопросы
- •Глава 7. Пищевые кислоты
- •7.1. Общая характеристика кислот пищевых объектов
- •7.3. Пищевые кислоты и их влияние на качество продуктов
- •7.4. Регуляторы кислотности пищевых систем
- •7.5. Пищевые кислоты в питании
- •7.6. Методы определения кислот в пищевых продуктах
- •Глава 8. Ферменты
- •8.1. Общие свойства ферментов
- •Ферментативная кинетика
- •8.2. Классификация и номенклатура ферментов
- •Оксидоредуктазы
- •Гидролитические ферменты
- •8.3. Применение ферментов в пищевых технологиях
- •Мукомольное производство и хлебопечение
- •Производство крахмала и крахмалопродуктов
- •Кондитерское производство
- •Производство плодово-ягодных соков, безалкогольных напитков и вин
- •Спиртные напитки и пивоварение
- •8.4. Иммобилизованные ферменты
- •8.5. Ферментативные методы анализа пищевых продуктов
- •Глава 9. Пищевые и биологически активные добавки
- •9.1. Общие сведения о пищевых добавках
- •Общие подходы к подбору технологических добавок
- •О безопасности пищевых добавок
- •9.2. Вещества, улучшающие внешний вид пищевых продуктов
- •Цветокорректирующие материалы
- •9.3. Вещества, изменяющие структуру и физико-химические свойства пищевых продуктов
- •Эмульгаторы
- •9.4. Вещества, влияющие на вкус и аромат пищевых продуктов
- •Подслащивающие вещества
- •Ароматизаторы
- •Пищевые добавки, усиливающие и модифицирующие вкус и аромат
- •9.5. Пищевые добавки, замедляющие микробиологическую и окислительную порчу пищевого сырья и готовых продуктов
- •Консерванты
- •Антибиотики
- •Пищевые антиокислители
- •9.6. Биологически активные добавки
- •Глава 10. Вода
- •10.1. Физические и химические свойства воды и льда Физические свойства воды и льда
- •Диаграмма состояния воды
- •Строение молекулы и свойства воды
- •Взаимодействие вода — растворенное вещество
- •Структура и свойства льда
- •10.2. Свободная и связанная влага в пищевых продуктах
- •Рассмотрим некоторые примеры.
- •10.3. Активность воды
- •Изотермы сорбции
- •Активность воды и стабильность пищевых продуктов
- •10.4. Роль льда в обеспечении стабильности пищевых продуктов
- •10.5. Методы определения влаги в пищевых продуктах Определение общего содержания влаги
- •Глава 11. Безопасность пищевых продуктов
- •11.1. Классификация чужеродных веществ и пути их поступления в продукты
- •11.2. Окружающая среда - основной источник загрязнения сырья и пищевых продуктов
- •Меры токсичности веществ
- •Токсичные элементы
- •Радиоактивное загрязнение
- •Диоксины и диоксинподобные соединения
- •Полициклические ароматические углеводороды
- •Загрязнения веществами, применяемыми в растениеводстве
- •Загрязнение веществами, применяемыми в животноводстве
- •11.3. Природные токсиканты
- •Микотоксины
- •Методы определения микотоксинов и контроль за загрязнением пищевых продуктов
- •11.4. Антиалиментарные факторы питания
- •11.5. Метаболизм чужеродных соединений
- •11.6. Фальсификация пищевых продуктов Фальсификация: аспект безопасности
- •Генетически модифицированные продукты питания
- •Контрольные вопросы
- •Глава 12. Основы рационального питания
- •12.1. Физиологические аспекты химии пищевых веществ
- •12.2. Питание и пищеварение
- •Основные пищеварительные процессы
- •Схемы процессов переваривания макронутриентов
- •Метаболизм макронутриентов
- •12.3. Теории и концепции питания
- •Первый принцип рационального питания
- •Второй принцип рационального питания
- •Третий принцип рационального питания
- •12.4. Рекомендуемые нормы потребления пищевых веществ и энергии
- •12.5. Пищевой рацион современного человека. Основные группы пищевых продуктов
- •12.6. Концепция здорового питания. Функциональные ингредиенты и продукты
- •Список использованной литературы
10.3. Активность воды
Давно известно, что существует взаимосвязь (хотя и далеко не совершенная) между влагосодержанием пищевых продуктов и их сохранностью (или порчей). Поэтому основным методом удлинения сроков хранения пищевых продуктов всегда было уменьшение содержания влаги путем концентрирования или дегидратации.
Однако часто различные пищевые продукты с одним и тем же содержанием влаги портятся по-разному. В частности, было установлено, что при этом имеет значение, насколько вода ассоциирована с неводными компонентами: вода, сильнее связанная, меньше способна поддержать процессы, разрушающие (портящие) пищевые продукты, такие как рост микроорганизмов и гидролитические химические реакции.
Чтобы учесть эти факторы, был введен термин "активность воды". Этот термин безусловно лучше характеризует влияние влаги на порчу продукта, чем просто содержание влаги. Естественно, существуют и другие факторы (такие как концентрация О2, рН, подвижность воды, тип растворенного вещества), которые в ряде случаев могут сильнее влиять на разрушение продукта. Тем не менее, водная активность хорошо коррелирует со скоростью многих разрушительных реакций, она может быть измерена и использована для оценки состояния воды в пищевых продуктах и ее причастности к химическим и биохимическим изменениям.
Активность воды (aw) — это отношение давления паров воды над данным продуктом к давлению паров над чистой водой при той же температуре. Это отношение входит в основную термодинамическую формулу определения энергии связи влаги с материалом (уравнение Ребиндера):
ΔF = L = RT∙ln
|
Р0 |
|
Рw |
= -RT∙lnaw,
где ΔF — уменьшение свободной энергии (при постоянной температуре); L — работа отрыва 1 моля воды от сухого скелета материала (без изменения состава); R — универсальная газовая постоянная.
aw=
|
Рw |
|
Р0 |
=
|
POB |
|
100 |
,
где Pw— давление водяного пара в системе пищевого продукта; Ро— давление пара чистой воды; РОВ — относительная влажность в состоянии равновесия, при которой продукт не впитывает влагу и не теряет ее в атмосферу, %.
По величине активности воды (табл. 10.5) выделяют: продукты с высокой влажностью (aw= 1,0—0,9); продукты с промежуточной влажностью (aw= 0,9—0,6); продукты с низкой влажностью (aw= 0,6—0,0).
476
Таблица 10.5. Активность воды (а ) в пищевых продуктах
|
Продукт |
Влажность, % |
aw |
|
Продукт |
Влажность, % |
aw |
|
Фрукты |
90-95 |
0,97 |
|
Мука |
16-19 |
0,80 |
|
Яйца |
70-80 |
0,97 |
|
Мед |
10-15 |
0,75 |
|
Мясо |
60-70 |
0,97 |
|
Карамель |
7-8 |
0,65 |
|
Сыр |
40 |
0,92-0,96 |
|
Печенье |
6-9 |
0,60 |
|
Джем |
30-35 |
0,82-0,94 |
|
Шоколад |
5-7 |
0,40 |
|
Хлеб |
40-50 |
0,95 |
|
Сахар |
0-0,15 |
0,10 |
|
Кекс |
20-28 |
0,83 |
|
|
|
|
477
476::477::Содержание
477::478::479::Содержание
Изотермы сорбции
Кривые, показывающие связь между содержанием влаги (масса воды, г Н2О/г С В) в пищевом продукте с активностью воды в нем при постоянной температуре, называются изотермами сорбции. Информация, которую они дают, полезна для характеристики процессов концентрирования и дегидратации (т.к. простота или трудность удаления воды связана с aw), а также для оценки стабильности пищевого продукта (что будет рассмотрено позже). На рис. 10.5 изображена изотерма сорбции влаги для продуктов с высокой влажностью (в широкой области влагосодержания).
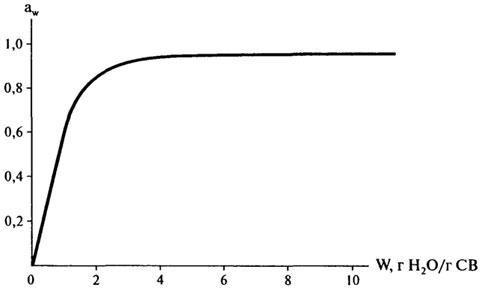 Рис.
10.5. Изотерма сорбции влаги для продуктов
с высокой влажностью
Рис.
10.5. Изотерма сорбции влаги для продуктов
с высокой влажностью
Однако, с учетом наличия связанной влаги, больший интерес представляет изотерма сорбции для области низкого содержания влаги в пищевых продуктах (рис. 10.6).
477
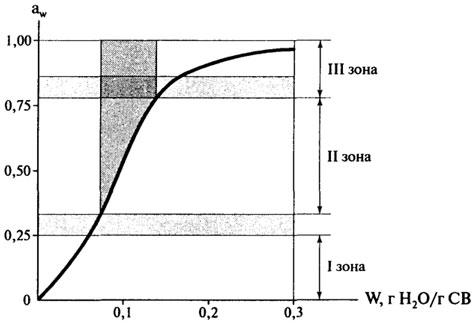 Рис.
10.6. Изотерма сорбции влаги для области
низкого содержания влаги в пищевых
продуктах
Рис.
10.6. Изотерма сорбции влаги для области
низкого содержания влаги в пищевых
продуктах
Для понимания значения изотермы сорбции полезно рассмотреть зоны I—III.
Свойства воды в продукте сильно отличаются по мере перехода от зоны I (низкие влагосодержания) к зоне III (высокая влажность). Зона I изотермы соответствует воде, наиболее сильно адсорбированной и наиболее неподвижной в пищевых продуктах. Эта вода абсорбирована, благодаря полярным вода-ион и вода-диполь взаимодействиям. Энтальпия парообразования этой воды много выше, чем чистой воды, и она не замерзает при — 40°С. Она неспособна быть растворителем, и не присутствует в значительных количествах, чтобы влиять на пластичные свойства твердого вещества; она просто является его частью.
Высоковлажный конец зоны I (граница зон I и II) соответствует монослою влаги. В целом зона I — соответствует чрезвычайно малой части всей влаги в высоковлажном пищевом продукте.
Вода в зоне II состоит из воды зоны I и добавленной воды (ресорбция) для получения воды, заключенной в зону II. Эта влага образует мультислой и взаимодействует с соседними молекулами через вода-вода—водородные связи. Энтальпия парообразования для мультислой-ной воды несколько больше, чем для чистой воды. Большая часть этой воды не замерзает при —40°С, как и вода, добавленная к пищевому продукту с содержанием влаги, соответствующим границе зон I и И. Эта вода участвует в процессе растворения, действует как пластифицирующий агент и способствует набуханию твердой матрицы. Вода в зонах II и I обычно составляет менее 5% от общей влаги в высоковлажных пищевых продуктах.
478
Вода в зоне III изотермы состоит из воды, которая была в зоне I и II, и добавленной для образования зоны III. В пищевом продукте эта вода наименее связана и наиболее мобильна. В гелях или клеточных системах она является физически связанной, так что ее макроскопическое течение затруднено. Во всех других отношениях эта вода имеет те же свойства, что и вода в разбавленном солевом растворе. ВоДа, добавленная (или удаленная) для образования зоны III, имеет энтальпию парообразования практически такую же, как чистая вода, она замерзает и является растворителем, что важно для протекания химических реакций и роста микроорганизмов. Обычная влага зоны III (не важно, свободная или удерживаемая в макромолекулярной матрице) составляет более 95% от всей влаги в высоковлажных материалах.
Состояние влаги, как будет показано ниже, имеет важное значение для стабильности пищевых продуктов.
В заключение следует отметить, что изотермы сорбции, полученные добавлением воды (ресорбция) к сухому образцу, не совпадают полностью с изотермами, полученными путем десорбции. Это явление называется гистерезисом.
Изотермы сорбции влаги для многих пищевых продуктов имеют гистерезис (рис. 10.7). Величина гистерезиса, наклон кривых, точки начала и конца петли гистерезиса могут значительно изменяться в зависимости от таких факторов, как природа пищевого продукта, температура, скорость десорбции, уровень воды, удаленной при десорбции.
Как правило, изотерма абсорбции (ресорбции) нужна при исследовании гигроскопичности продуктов, а десорбции — полезна для изучения процессов высушивания.
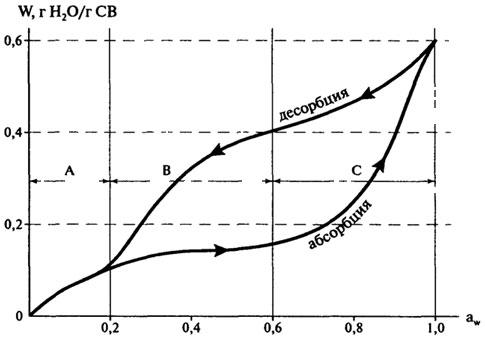 Рис.
10.7. Гистерезис изотермы сорбции влаги
Рис.
10.7. Гистерезис изотермы сорбции влаги
479
477::478::479::Содержание
480::481::482::483::484::485::486::487::Содержание
