
Лекции / Лекции (Павлова) / L18
.docЛ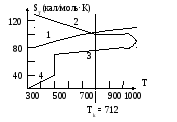 екция
№18.
екция
№18.
BiCl3 1178K
– критическая температура.
(H+)
Абсолютная энтропия иона водорода
произвольно принимается раной нулю.
1 – идеальный газ
2 – насыщенный пар
3 – жидкость
4 – кристалл
Стандартная энтропия некоторого вещества в газообразном состоянии рассчитывается термохимическим и статистическим методом.
|
|
термохимический |
статистический |
|
Ne |
35,0 |
34,96 |
|
Ar |
36,8 |
36,99 |
|
O2 |
49,1 |
49,03 |
|
Cl |
52,8 |
53,31 |
|
CO2 |
51,7 |
51,08 |
S
Однако такая картина не у всех газов (исключения: H2O, H, окись углерода, закись азота). Для них калометрические значения дают на 1,5 ккал/моль·К меньше, чем значение из спектроскопических данных.
Причина: для водорода, т.к. существует …., для окиси углерода 1,1, т.к. кристаллическая решетка CO не является упорядоченной. Ориентация молекул в CO осуществляется по типу CO OC CO OC, а не CO CO CO. При Т равному абсолютному нулю в кристалле CO имеет место энтропия смешения, допустим, что мольная доля CO одинакова с мольной долей OC.
Для газа в
уравнение температурной зависимости
последний член равен интегралу
Ткип =
700С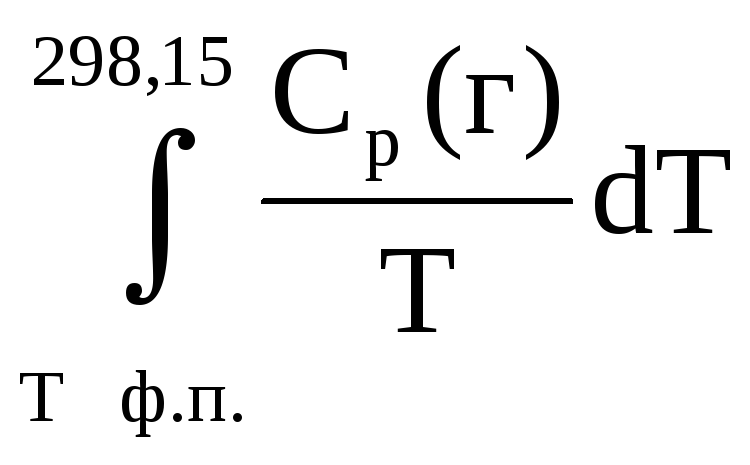
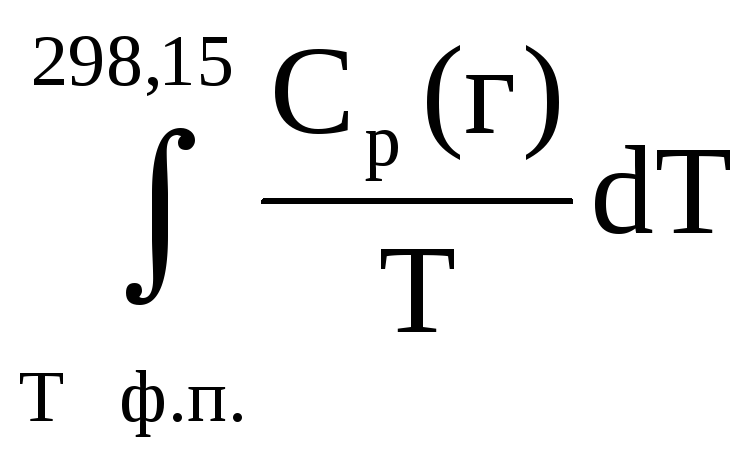 ,
где ф.п. – фазовые превращения.
,
где ф.п. – фазовые превращения.
![]()
![]()
() для температуры кипения, индексы кр относятся к критической точке. () получают на основе уравнения состояния газа (уравнение Бертело). () обеспечило ().
Поправка () составляет 0,1 и в приближенных расчетах можно не учитывать.
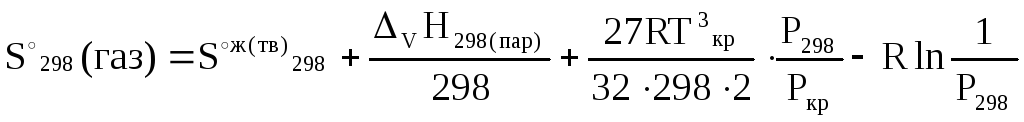
Приложение второго закона термодинамики.
Уравнение Клаузиуса – Клайперона.
Запишем первое начало термодинамики для системы, у которой неизменны масса и состав и допускается только работа расширения или сжатия (т.е. закрытая система).
Пусть внутренняя
энергия системы зависит от объема и
температуры, т.е. U = (V,T)
– это уравнение состояния, калорическое
уравнение состояния.
Q = dU + pdV
Запишем математически дифференциал функции:
(UV)![]()
Перепишем функцию для Q с учетом (UV):
![]() ,
где L =
,
где L =
![]()
Пусть
температура T=const,
тогда CVdT
= 0 найдем L
=
![]() ,
согласно этому выражению L
– мера увеличения объема системы при
T=const при
подведении к системе теплоты. Теплоемкость
при постоянном объеме – мера увеличения
температуры при подведении к системе
теплоты при V=const.
,
согласно этому выражению L
– мера увеличения объема системы при
T=const при
подведении к системе теплоты. Теплоемкость
при постоянном объеме – мера увеличения
температуры при подведении к системе
теплоты при V=const.
L, CV – калорические коэффициенты.
Свойства калорических коэффициентов.
Перепишем
Q = CVdT + LdV после подстановки этого выражения в уравнение дифференциалов внутренней энергии получим:
dU = (L-p)dV + CVdT (1)
Запишем Q с использованием второго начала термодинамики:
![]() (2)
(2)
Дифференциалы этих двух (1 и 2) функций, чтобы доказать, что это полные дифференциалы используем теорему Коши. Т.к. dU и dS представляют полные дифференциалы U и S, то можно записать:
![]() -
внутренняя энергия
-
внутренняя энергия
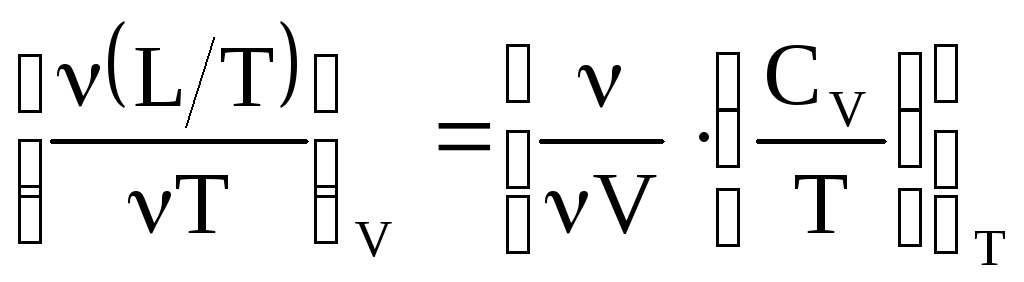
После раскрытия дифференциалов не трудно убедиться:
![]() (*)
(*)
Величина L – это количество теплоты, которая необходима системе, чтобы увеличить объем на 1 при T=const, L – скрытая теплотой превращения.
∆mH, ∆subH, ∆VH
![]()
Подставим в (*), таким образом
![]() - эта формула называется формулой
Клаузиуса – Клайперона.
- эта формула называется формулой
Клаузиуса – Клайперона.
Отличие насыщенного пара от ненасыщенного пара:
Насыщенный пар находится в равновесии с жидкостью, ненасыщенный пар зависит от Vсистемы.
pнас = (T), поэтому в уравнении Клаузиуса – Клайперона можно снять зависимость объема и переписать.
![]()
величины ∆H, T, ∆V – характеристики фазового перехода
Пример:
Различные виды записи уравнения Клаузиуса - Клайперона для процесса плавления.

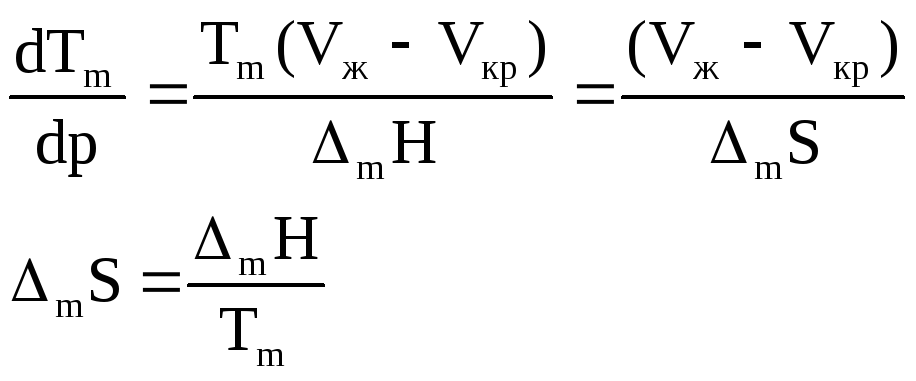
V
![]()
![]() ,
где
,
где
![]() -
плавление.
-
плавление.
