
- •Часть 2
- •Общие методические указания
- •Указания к самостоятельной работе с учебными пособиями
- •Указания к решению задач
- •Указания к оформлению и выполнению контрольныхработ
- •Раздел 4. Электродинамика
- •Раздел 5. Оптика
- •Раздел 6. Элементы квантовой механики
- •Раздел 7. Элементы физики твердого тела
- •Раздел 8. Элементы ядерной физики и физики элементарных частиц
- •Краткие теоретические сведения и основные формулы электромагнетизм
- •Волновая оптика
- •Интерференция света
- •Дифракция света
- •Поляризация света
- •Квантовая физика
- •Виды оптических излучений.
- •Тепловое излучение и его характеристики.
- •Законы смещения Вина:
- •1. Длина волны, на которую приходится максимум в спектре излучения черного тела, обратно пропорциональна температуре:
- •Закон Рэлея–Джинса. Исходя из представлений статистической физики о равномерном распределении энергии по степеням свободы, Рэлей и Джинс получили формулу:
- •Фотоэффект.
- •Масса и импульс фотона. Единство корпускулярных и волновых свойств света.
- •Давление света.
- •Эффект Комптона.
- •Линейчатые спектры. Боровская теория атома водорода
- •Волновые свойства частиц. Гипотеза де Бройля
- •Принцип неопределенности
- •Волновая функция.
- •Квадрат волновой функции имеет смысл плотности вероятности, т.Е. Определяет вероятность нахождения частицы в единичном объёме в окрестностях точки с координатами X,y,z.
- •Уравнение Шредингера
- •Частица в одномерной прямоугольной потенциальной яме с бесконечно высокими стенками.
- •Атом водорода. Квантовые числа.
- •Принцип Паули
- •Поглощение света веществом. Закон Бугера.
- •Спонтанное и вынужденное излучение
- •Зонная теория твердого тела. Энергетические зоны в кристаллах. Уровень Ферми
- •Уровень Ферми
- •Состав и характеристика атомного ядра
- •Энергия связи
- •Радиоактивность
- •Деление ядер и цепная реакция
- •Ядерный синтез
- •Контрольная работа № 2
Квадрат волновой функции имеет смысл плотности вероятности, т.Е. Определяет вероятность нахождения частицы в единичном объёме в окрестностях точки с координатами X,y,z.
Интегрируя по объёму, можно определить вероятность нахождения частицы в этом объёме в условиях стационарного поля.
![]() (101)
(101)
- условие нормировки ψ-функции.
Уравнение Шредингера
Точный вид волновой функции можно найти, решая уравнение, называемое уравнением Шредингера. Уравнение Шрёдингера в квантовой механике, так же как и второй закон Ньютона в классической механике, не выводится, а постулируется. Стационарное уравнение Шредингера имеет вид
![]() ,
(102)
,
(102)
где
![]() ,Е-полная энергия частицы,U-потенциальная энергия.
,Е-полная энергия частицы,U-потенциальная энергия.
Уравнение Шрёдингера связывает ψ-функцию с массой микрочастицы m, её полной энергиейEи потенциальной энергиейU. И зная конкретный вид потенциальной энергии уравнение можно решать. Однако количество задач, допускающих точное решение, очень ограничено.
В уравнение Шрёдингера входит в качестве параметра полная энергия частицы Е. Из теории дифференциальных уравнений следует, что уравнение Шрёдингера имеет решение не при любых значениях энергии, а лишь при некоторых, называемыхсобственными значениями.Решения, соответствующие собственным значениям энергииЕ,называютсобственными функциями задачи.
Частица в одномерной прямоугольной потенциальной яме с бесконечно высокими стенками.
Наиболее простым примером на нахождение собственных значений энергии и соответствующим им собственных значений функции является решение задачи о движении частицы в одномерной потенциальной яме.
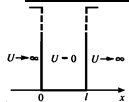 Частица
может двигаться только вдоль осиХв пределах ширины ямы0<х<l.Внутри ямы пси-функция отлична от нуля,
а на границах ямыψ(0)= ψ(l)=0.Внутри
ямы силового поля нет (U=0).
Частица
может двигаться только вдоль осиХв пределах ширины ямы0<х<l.Внутри ямы пси-функция отлична от нуля,
а на границах ямыψ(0)= ψ(l)=0.Внутри
ямы силового поля нет (U=0).
Уравнение Шрёдингера для стационарных состояний в пределах ямы имеет вид:
![]() (103)
(103)
Рис. 28.
Собственные значения энергии определяются формулой:
![]() (n=1,2,3…) (104)
(n=1,2,3…) (104)
Таким образом, энергия частицы принимает лишь определённые дискретные значения, т. е. квантуется.
Собственные волновые функции имеют вид:
![]() (n=1,2,3…) (105)
(n=1,2,3…) (105)
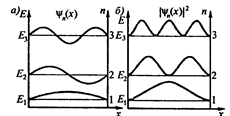
На рис. 29 изображены графики собственных функций (а) и плотность вероятности (б)обнаружения частицы на разных энергетических уровнях в зависимости от расстояния от стенок ямы.
Рис. 29
Атом водорода. Квантовые числа.
Для атома водорода потенциальная энергия имеет вид
![]()
И решение уравнения Шредингера предсказывает точно такие же уровни, что и теория Бора:
![]() (106)
(106)
n– носит название главного квантового числа, и оно характеризует энергию системы. Но кромеn, при решении появляются еще два квантовых числа. Орбитальное квантовое числоlсвязано с моментом импульса электрона. Оно может принимать значения от 0 доn-1. В основном состоянии сn=1,n=0 приn=3, 1=0,1,2. Величина момента импульсаL связана с числомlсоотношением
![]() (107)
(107)
Магнитное квантовое mчисло характеризует проекцию момента импульса
![]() (108)
(108)
и может принимать значения от –1 до +1. Например, l=2,m=-2,-1,0,1,2. Название магнитного квантового числа заимствовано из опыта: было обнаружено, что при газовом разряде спектральные линии расщепляются в магнитном поле на несколько линий, расположенных близко друг к другу (эффект Зеемана).
Есть еще спиновое
квантовое число mS,
которое принимает лишь два значения![]() и -
и -![]() .
Существование этого квантового числа
не следует из уравнения Шредингера.
Указание о необходимости введенияmSвпервые было получено из опыта. Тщательное
исследование спектральных линий атома
водорода показало, что каждая линия в
действительности состоит из двух (или
большего числа) линий. Это явление
получило название тонкой структуры.
.
Существование этого квантового числа
не следует из уравнения Шредингера.
Указание о необходимости введенияmSвпервые было получено из опыта. Тщательное
исследование спектральных линий атома
водорода показало, что каждая линия в
действительности состоит из двух (или
большего числа) линий. Это явление
получило название тонкой структуры.
