
- •2.Проводимость полупроводников
- •2. Корпускулярно-волновой дуализм
- •2. Ядерные реакции.
- •2. Термоядерная реакция.
- •1.Квантовые числа
- •2.Принцип Паули
- •Стандартные условия
- •2.Радиоактивность
- •2.Строение ядра, ядерные реакции
- •2.Момент импульса атома
- •2.Фотоны
- •1.Квантование энергии.
- •2.Лазеры
- •1.Ультрафиолетовая катастрофа
- •2.Теплоемкость кристаллов
- •1.Внешний фотоэффект
- •2.Строение атомного ядра
- •1.Пси-функция и ее физический смысл
- •Стандартные условия
- •2.Проводимость металлов и проводников
- •1.Постулаты Бора
- •2.Сверхпроводимость
- •1.Законы теплового излучения
- •2.Эффект Ферми
- •1.Сверхпроводимость
- •2.Волна де Бройля
- •1.Характеристика рентгеновского излучения.
2.Принцип Паули
Если тождественные частицы имеют одинаковые квантовые числа, то их волновая функция симметрична относительно перестановки частиц. Отсюда следует, что два одинаковых фермиона, входящих в одну систему, не могут находиться в одинаковых состояниях, т.к. для фермионов волновая функция должна быть антисимметричной. Фермионы – частицы, обладающие полуцелым сплином.
Принцип
Паули:
В определённом состоянии может находиться
не более одного фермиона. Для электрона
это значит, что в состоянии с заданными
квантовыми числами (n,l,m,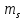 )
может находиться не более одного
электрона. Принцип Паули позволяет
объяснить, почему электроны в атоме не
переходят все сразу в основное состояние
с моментальной энергией. На основе
принципа Паули объясняется периодическая
система.
)
может находиться не более одного
электрона. Принцип Паули позволяет
объяснить, почему электроны в атоме не
переходят все сразу в основное состояние
с моментальной энергией. На основе
принципа Паули объясняется периодическая
система.
БИЛЕТ 15
Пси-функция и ее физические свойства
Волновая функция Ψ это математическая функция такая что она характеризует вероятность обнаружения действия микрочастицы в элементе объема dV в некоторый момент времени и экспериментально ее измерить.
Функцию Пси называют амплитудой вероятности.
dP=|Ψ|2dV=Ψ dV
dV
Физический
смысл
имеет только величина |Ψ|2.
Квадрат поля пси функции это
плотность вероятности Р которое
определяет вероятность нахождения
точки пространства с координатами
(x,y,z)
в момент времени t
при условии что рассматриваемая частица
находится в состоянии описываемом
функцией пси. Р=|Ψ|2=
Ψ Эту интерпритацию Пси-функции предложил
Бор.
Эту интерпритацию Пси-функции предложил
Бор.
Условие
нормировки
Ψ
функции следует из теории вероятности
и записывается

Замечание:1. Пси-функция задается с точностью до некоторого множителя т.е. Ψ и СΨ описывают одно и тоже состояние частицы.2. интеграл утверждает что фактическое пребывание частицы в заданном объеме это достоверное событие.
Стандартные условия
Ψ конечна, однозначна, непрерывна, гладкая
P не м.б. >1, не м.б. неоднозначна, не может изменяться скачком
2.Радиоактивность
Это явление самопроизвольного – спонтанного распада ядер с испусканием одной или нескольких частиц. Такие ядра и соответствующие им нуклиды называют радиоактивными. Радиоактивное ядро называют материнским, а ядра, образующиеся в результате распада – дочерними.
Необходимое условие радиоактивного распада заключается в том, что масса исходного ядра должна превышать сумму масс продуктов распада. Поэтому каждый радиоактивный распад происходит с выделением энергии.
Различают естественную и искусственную радиоактивность. При этом законы радиоактивного превращения в обоих случаях одинаковы.
Естественной радиоактивность называется радиоактивность, наблюдаемая у существующих в природе неустойчивых изотопов.
Искусственной радиоактивностью называется радиоактивность изотопов, полученных в результате ядерных реакций.
Радиоактивное
излучение бывает трех типов: α-, β-, γ-
лучей была установлена по их отклонению
в магнитном поле.
α-излучение отклоняется электрическим и магнитным полями, обладает высокой ионизирующей способностью и малой проникающей способностью. α-излучение представляет собой поток ядер гелия – заряд α-частицы равен +2е, а масса совпадает с массой ядра изотопа гелия. α-частицы испускают только тяжелые ядра.
β-излучение также отклоняется электрическим и магнитным полями; его ионизирующая способность на два порядка меньше, чем α-лучей, а проникающая способность, напротив гораздо больше. β-излучение представляет собой поток быстрых электронов е- или позитронов – античастиц электронов е+. Позитрон – античастица электрона- это частица с массой покоя равной массе покоя электрона, спином ½ и несущая положительный электрический заряд е+. β-электроны рождаются в результате процессов, происходящих внутри ядра при превращении одного вида нуклона в ядре в другой – нейтрона в протон или наоборот.
γ- излучение не отклоняется электрическим и магнитным полями, обладает относительно слабой ионизирующей способностью и очень большой проникающей способностью. При прохождении его через кристалл наблюдается дифракция. γ-излучение представляет собой коротковолновое электромагнитное излучение с длиной волны λ<2*10-10м и является потоком частиц γ-квантов(фотонов)
γ-излучение не является самостоятельным типом радиоактивности. Оно сопровождает процессы α- и β- распадов и не вызывает изменения заряда и массового числа ядер. Оно испускается дочерним ядром. γ-излучение это основная форма уменьшения энергии возбужденных продуктов радиоактивных превращений.
БИЛЕТ 16
Энергетические уровни атомов, их обозначения и правила отбора
Каждому уровню энергии стационарного состояния водородоподобного атома – собственному значению энергии Еn электрона при n>1 соответствует несколько собственных функций Ψnl ml , отличающихся значениями квантовых чисел l и ml. Это означает, что электрон может иметь одно и то же значение энергии, находясь в нескольких различных состояниях. Например , энергией Е2 (n=2) обладают четыре состояния Ψ200 Ψ210 Ψ211 Ψ 21-1 . В атомах с двумя и более электронами энергия электрона в атоме зависит и от орбитального квантового числа.
Состояния водородоподобного атома с одинаковым значением энергией называют вырожденными, а число различных состояний с определенным значением энергии – кратностью вырождения данного энергетического уровня.
Кратность вырождения n-го энергетического уровня водородоподобной системы можно определить, учитывая число возможных значений l и ml. При заданном главном квантовом числе n каждому значению l соответствует 2l+1 значений ml. Поэтому полное число N различных квантовых состояний, с помощью которых может реализоваться состояние с данным n, равно
 с
учетом наличия спина
у электрона это число необходимо удвоить.
Следовательно,
кратность
вырождения
N
энергетического уровня в водородоподобном
атоме равна 2n2.
с
учетом наличия спина
у электрона это число необходимо удвоить.
Следовательно,
кратность
вырождения
N
энергетического уровня в водородоподобном
атоме равна 2n2.
Различные состояния электрона в атоме принято обозначать малыми буквами латинского алфавита в зависимости от значения орбитального квантового числа l. Электрон в этих состояния называется соответственно s-, p-электроном.
Правило отбора. Правила отбора устанавливают допустимые переходы между уровнями энергии квантовой системы при наложении на нее внешних возбуждений. В оптических спектрах выполняются следующие правила отбора, согласно которым излучательные переходы между уровнями энергии атома возможны только в том случае если:
1. Изменение ∆l орбитального квантового числа l удовлетворяет условию ∆l=+(-)1
2. Изменение ∆ml магнитного квантового числа ml удовлетворяет условию ∆ml=0,(-)+1 это условие следует учитывать при наличии внешнего магнитного поля.
3. Изменение ∆j квантового числа полного момента j (j=l+s, где s – спиновое число) удовлетворяет условию ∆j=0,(-)+1
Главное квантовое число n может изменяться на любое целое число. Вероятность квантовых переходов, запрещенных правилами отбора, практически равна нулю.
Вынужденное излучение
Рассмотрим два квантовых состояния атома(иона, молекулы) с энергиями Е1(основное состояние) и Е2(возбужденное состояние), а также четыре возможных вида переходов между энергетическими уровнями атома:
Переход под действием внешнего излучения, когда атом из основного состояния Е1 переходит в возбужденное состояние 2, что приводит к поглощению излучения веществом.
Спонтанный (самопроизвольный) переход – это переход атома с более высокого на более низкий уровень, например, в основное состояние 1, без внешних воздействий. Приводит к испусканию фотона с энергией Е2-Е1 возбужденным атомом, т.е. к спонтанному излучению.
Индуцированный переход – это переход , связанный с испусканием фотона под действием излучения. Вероятность такого перехода возрастает с увеличением интенсивности излучения. Когда на атом, находящийся в возбужденном состоянии 2, действует внешнее излучение с частотой, удовлетворяющей условию Е2-Е1, то может произойти вынужденный переход атома в основное состояние 1 с излучением фотона той же энергии дополнительно к тому фотону, под действием которого произошел переход. Следовательно в процесс вынужденного излучения вовлечены 2 фотона: первичный фотон, вызывающий испускание излучения возбужденным атомом, и вторичный фотон, испущенный атомом.
Безызлучательный переход – это переход, не связанный с испусканием или поглощением фотонов. Изменение энергии системы осуществляется благодаря непосредственному взаимодействию данной системы с другими системами.

БИЛЕТ 17
Корпускулярно-волновой дуализм
Из опытных фактов следует, что свет обладает одновременно волновыми свойствами(интерференция, дифракция, поляризация) и корпускулярными, которые проявляются в процессах взаимодействия света с веществом(испускания, поглощения, рассеяния). Свет имеет двойственную природу и обнаруживает корпускулярно-волновой дуализм.
Фотон – это квантовый объект который в принципе нельзя представить с помощью классических понятий, однако он проявляет свои корпускулярно-волновые свойства в различных соотношениях
Чем меньше энергия и импульс фотона тем сложнее обнаружить квантовые свойства света. Фотоны в этом случае в основном проявляют волновые свойства(красная граница).
Чем больше энергия и импульс фотона тем сложнее обнаружить волновые свойства фотона. В этом случае фотон обладает в основном корпускулярными свойствами(рентгеновское излучение).
Свет или рентгеновское излучение 1015<ω<1019 проявляется в равной степени и корпускулярные и волновые свойства, корпускулярные(фотоэффект), волновые(интерференция и дифракция).
Правило: при описании фотонов мы иногда используем формулы волновой теории и иногда корпускулярной, но никогда не используем и те и те одновременно.
Давление
света также
объясняется и квантовой и волновой
теорией. При соударении с поверхностью
тела фотон передает ей свой импульс.
Отражение света «переизлучение» фотонов.
Давление света на поверхность равно
импульсу, который передают поверхности
N
фотонов за 1с:

Квантово-механическая модель атома водорода
Квантовая
механика без привлечения постулатов
Бора позволяет получать решение задачи
об энергетических уровнях как для атома
водорода и водородоподобной системы,
так и для более сложных атомов. Будем
рассматривать водородоподобный атом,
содержащий единственный внешний
электрон. Электрическое поле, создаваемое
ядром, является примером центрального
поля. Поскольку масса ядра водородоподобного
атома во много раз больше массы электрона,
то приближенно можно считать, что она
бесконечно велика и что ядро все время
находится в начале координат. Тогда
задачу о водородоподобном атоме можно
представить как задачу о движении
электрона в фиксированном поле сил с
потенциалом
 где
r
радиальная переенная – расстояние
между электроном и ядром; Z
атомное число; е абсолютное значение
заряда электрона. Потенциал U(r)
описывает кулоновское поле ядра. Движение
электрона в таком поле можно рассматривать
как движение в некоторой сферической
потенциальной яме.
где
r
радиальная переенная – расстояние
между электроном и ядром; Z
атомное число; е абсолютное значение
заряда электрона. Потенциал U(r)
описывает кулоновское поле ядра. Движение
электрона в таком поле можно рассматривать
как движение в некоторой сферической
потенциальной яме.
В
этом случае уравнение Шредингера имеет
вид

Уравнение
Шредингера в сферических координатах
имеет вид:
Где
Ψ волновая функция теперь является
функцией сферических координат. 
Согласно квантовой механике, круговые орбиты электроно теории Бора теряют физический смысл. В рамках квантовой механики |Ψ|2 задает плотность вероятности обнаружения электрона в некоторой точке пространства. Электрон при своем движении как бы «размазан» в пространстве подобно облаку отрицательного заряда, плотность которого характеризует вероятность нахождения электрона в различных точках объема атома.
БИЛЕТ 18
Уравнение Шредингера
Уравнение Шредингера описывает изменение во времени состояния квантового объекта, характеризуемого волновой функцией. Если известна волновая функция Ψ в начальный момент времени, то решая уравнение Шредингера, можно найти Ψ в любой последующий момент времени t. Уравнение Шредингера для частицы массой m, движущейся со скоростью, много меньшей скорости света в вакууме, под действием силы, порождаемой потенциалом U(x,y,z,t):
 где
i
мнимая единица, дельта – оператор
Лапласа. Ψ(x,y,z,t)
– временная волновая функция частицы,
которая зависит от координат и времени.
Уравнение содержит производную от
функции Ψ по времени и называется
временным(нестационарным)
уравнением Шредингера.
где
i
мнимая единица, дельта – оператор
Лапласа. Ψ(x,y,z,t)
– временная волновая функция частицы,
которая зависит от координат и времени.
Уравнение содержит производную от
функции Ψ по времени и называется
временным(нестационарным)
уравнением Шредингера.
Стационарными состояниями называют состояния, в которых все наблюдаемые величины не изменяются с течением времени. В частности не изменяется со временем плотность вероятности |Ψ(r,t)|2. Стационарные решения уравнения Шредингера имеют смысл для тех задач, в которых силовое поле потенциально и следовательно, потенциальная энергия U не зависит от времени U=U(x,y,z).
В
стационарных состояниях состояние
частицы в данный момент времени
описывается периодической функцией
времени Ψ с циклической частотой ω. При
этом Ψ-функция определяется полной
энергией частицы:
 При
таком виде пси-функции плотность
вероятности Р остается постоянной Р=ΨΨ*
При
таком виде пси-функции плотность
вероятности Р остается постоянной Р=ΨΨ*
Стационарное
уравнение Шредингера
записывают в виде:
 Потенциальная
энергия здесь задается классически,
как если бы никакими волновыми свойствами
частица не обладала.
Потенциальная
энергия здесь задается классически,
как если бы никакими волновыми свойствами
частица не обладала.
Энергетические зоны в кристаллах
Существуют разрешенные и запрещенные зоны. В пределах разрешенных зон энергия изменяется квазинепрерывно. Ширина зон не зависит от размеров кристалла. Состояния со значениями энергии, соответствующими диапазону запрещенных зон, не могут реализоваться.
Возникновение энергетических зон можно объяснить модификацией энергетических уровней атомов при их сближении. При сближении N одинаковых атомов каждый уровень атома распадается на N очень близких подуровней из-за перекрытия электронных оболочек атомов. Расстояние между подуровнями ~ 10-22 эВ. Образуются разрешенные энергетические зоны (3- 5 эВ). Уровни внутренних электронов расщепляются мало. В силу принципа Паули в каждую зону кристалла, состоящую из N подуровней, может «поместиться» не более 2N электронов.
Различия в электрических свойствах металлов, полупроводников и диэлектриков объясняются: 1) шириной ∆E запрещенных энергетических зон; 2) различным заполнением разрешенных энергетических зон. Необходимое условие электрической проводимости твердого тела – это наличие в разрешенной зоне свободных энергетических уровней, на которые можно перевести электроны, прикладывая внешнее электрическое поле или повышая температуру.
Энергетическая область разрешенных электронных состояний в твердом теле, заполненная валентными электронами, называется валентной зоной. В основном состоянии (при T = 0 K) в полупроводниках и диэлектриках верхняя из заполненных энергетических зон – валентная зона – занята электронами полностью. Выше валентной зоны имеется полностью свободная от электронов зона – зона проводимости. Между данными зонами расположена запрещенная зона. Ее ширина DE определяет электрические и оптические свойства тел.
БИЛЕТ 19
Боровская теория строения атома водорода, ее недостатки
Бор предположил, что из всех возможных орбит электрона осуществляются только те, для которых момент импульса равен целому кратному постоянной Планка h, деленной на 2π: meυr=nħ(n=1,2,3..) Число n называется главным квантовым числом
Полуклассическая модель, в которой электроны рассматриваются как классические точечные частицы, движущиеся вокруг атомного ядра по отдельным разрешённым боровским орбитам, называется боровской моделью атома.
Радиус
n-й
стационарной орбиты по которой движется
электрон: Z-
количество протонов в ядре , r
радиус первой боровской орбиты.
Z-
количество протонов в ядре , r
радиус первой боровской орбиты.
Энергия
стационарных состояний электрона в
атоме водорода и водородоподобной
системе на n-й
стационарной орбите определяется ккак
полная энергия электрона в кулоновском
поле ядра:
 Знак
минус в формуле означает что электрон
находится в связанном состоянии .
Знак
минус в формуле означает что электрон
находится в связанном состоянии .
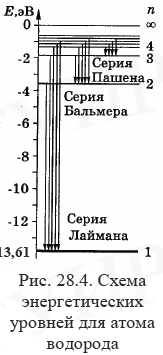
Энергетический
уровень с n=1
называется основным уровнем. Уровни с
n
>1 и соответствующие им состояния
называются возбужденными. При n
→∞ уровни энергии сгущаются к предельному
значению Е∞=0.
После первых успехов теории все яснее давали себя знать ее недочеты. Особенно тягостной была неудача всех попыток построения атома гелия. Самой слабой стороной теории Бора была ее внушительная логическая противоречивость: она не была ни последовательно классической, ни последовательно квантовой теорией. Теория Бора опирающаяся на классическую механику, могла быть только переходным этапом на пути к созданию последовательной теории атомных явлений.
