
Solid Support Oligosaccharide Synthesis
.pdf
148 STEREOSELECTIVE β-MANNOSYLATION ON POLYMER SUPPORT
|
|
|
|
|
OBn |
|
|
|
|
|
|
|
|
|
|
HO |
O |
|
OAc |
|
OBn |
O |
|
|
|
OAc |
|
|
|
|||
|
|
|
BnO |
SEt |
AcO |
O |
|
|
||
|
|
|
|
O |
O |
|||||
O |
|
AcO |
|
O |
PhthN |
O |
|
|||
|
|
|
BnO |
SEt |
||||||
O |
|
|
|
O |
|
AcO |
||||
OH |
|
O |
|
|
|
|
|
PhthN |
||
|
|
|
|
|
|
|
|
|||
|
|
|
AcO Br |
AgOTf |
|
NHPh |
|
|||
O |
|
O |
|
|
|
|
||||
|
|
toluene, -40 °C |
|
|
||||||
O |
|
NHPh |
|
|
|
|
|
94% |
|
|
|
|
|
|
|
1. Tf2O |
|
O |
|
|
|
|
O |
|
|
|
2. DMF-pyridine, |
|
|
|
||
Ph |
|
|
OBn |
|
|
|
|
|||
O |
|
70 |
°C |
|
O |
|
|
|||
|
O |
|
|
|
|
|
||||
|
O |
O |
|
Ph |
O |
|
OBn |
|||
|
O |
|
|
O |
|
|||||
|
|
BnO |
|
SEt |
|
O |
O |
O |
||
O |
|
OH |
|
|
|
|||||
|
|
PhthN |
|
|
O |
|
||||
|
NHPh |
|
|
|
|
|
|
BnO |
SEt |
|
|
|
13 |
|
|
|
|
|
|
PhthN |
|
|
|
|
|
|
|
|
96% |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
PhthN |
OBn |
|
|
|
|
|
|
|
|
||
|
|
OAc |
|
BnO |
|
O |
O |
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
O |
N3 |
|
|
|
|
|
|
|
|
||
|
|
|
|
BnO |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
OH |
|
|
|
OBn |
|||
|
AcO |
O |
|
|
|
OBn |
PhthN |
|
Ph |
O |
|
PhthN |
||||
|
|
|
|
|
O |
|
||||||||||
|
O |
|
F |
|
|
|
|
|
|
|
O |
BnO |
|
O |
O |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
O |
|
AcO |
|
|
|
|
|
|
|
|
O |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O BnO |
N3 |
||||
|
|
|
|
|
|
|
|
O |
|
|
|
|||||
|
NHPh |
|
|
|
|
|
|
|
|
|
|
|
OBn |
PhthN |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
NHPh |
|
|
|
|
|
Ph |
O |
OH |
|
PhthN |
|
OBn |
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
Chemical Transformations |
|
|
|||||||||
|
O |
BnO |
|
O |
O |
|
|
|
|
|||||||
|
HO |
|
O |
O |
|
N3 |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
BnO |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
OBn |
|
PhthN |
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
NHAc |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
HO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
HO |
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
O |
OH |
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|||
|
|
|
|
|
|
|
O HO |
NHAc |
O |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
OH O |
O |
|
|
OHO |
|
N Asn |
|
|
|
|
|
|
|
|
|
|
|
|
O |
NHAc |
|
|
|
|||
|
|
|
|
|
|
HO |
|
|
|
OH |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
HO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
NHAc |
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
HO |
OH |
|
|
|
|
Enzymatic Reactions |
|
|
|
|||
|
|
OH |
|
O |
OHO |
NHAc |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
AcHN |
O |
O |
OH |
O |
O |
|
|
|
|
|
|
|
|
||
|
HO |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
CO2- |
|
|
OH HO |
O |
|
|
|
|
|
|
|
|
|
HO |
OH |
|
|
|
HO |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
HO |
O |
OH |
|
|
|
OH |
H |
|
|
|
|
|
|
|
|
|
|
|
O |
HO |
NHAc |
O |
Asn |
|
|||
|
|
|
|
|
|
|
|
|
N |
|
||||||
|
|
|
|
|
|
|
|
OH O |
|
O |
|
OHO |
|
|
||
|
HO |
|
|
|
|
|
|
|
O |
|
|
|
|
|||
|
OH |
|
CO2- |
|
|
|
|
|
NHAc |
|
|
|||||
|
|
|
|
|
HO |
|
|
|
OH |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
HO |
|
|
|
|
|
|
|
|
|
|
HO |
O |
O |
OH |
OH |
O |
|
|
|
|
|
|
|
|
||
|
AcHN |
OH |
|
O |
O |
|
14 |
|
|
|
|
|
|
|||
|
|
|
|
OHO |
|
|
|
|
|
|
|
|
||||
|
|
|
HO |
O |
NHAc |
OH |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
Scheme 7.12 Intramolecular SN2 reaction by Kunz.

7.1 p-METHOXYBENZYL-ASSISTED INTRAMOLECULAR AGLYCON DELIVERY |
149 |
|||||||||
|
|
|
|
|
|
|
TfO |
OBz |
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
Bu |
BzO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
OH |
|
Bu SnO |
|
O |
Sn Bu |
BzOOMe |
|
|
|
HO |
O |
|
2 |
HO |
|
|
|
|
|
|
|
|
|
O O |
|
|
|
|
|||
RO |
|
|
|
HO |
|
CsF |
|
|
||
|
|
OH |
|
RO |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15 |
|
|
|
|
|
|
HO |
|
OH |
OBz |
|
|
15 R |
solvent |
yield (%) |
|
|
|
O |
|
|
||||||
|
HO |
|
O |
|
|
|
|
|
|
|
|
RO |
|
O |
|
|
a |
H |
DMSO |
59 |
|
|
|
|
|
|
||||||
|
|
|
BzO |
|
|
|
|
|
|
|
|
|
|
|
BzO |
|
|
b |
Bn |
DMF |
67 |
|
|
|
|
OMe |
|
|
|
|
|
|
Scheme 7.13 β-Mannosylation using mannose-derived 1,2-O-stannylene acetal in combination with an aglycon-derived triflate.
delivery (IAD), which was first reported by Baressi and Hindsgaul (Scheme 7.16).62–64 This approach is highly attractive because exclusive formation of the correct stereoisomer can be expected. The aglycon is linked to the axially oriented oxygen at the 2 position, and can approach the oxocarbenium ion only from the β face. Formation of α-isomer is essentially prohibited by the stereochemical constraint. Starting with 2-O-acetylated thiomannoside, isopropenyl ether 17 was prepared and converted to the mixed isopropylidene acetal 18. The latter compound serves as the tethered intermediate for IAD. Subsequent treatment with NIS activates the thioglycosidic linkage to give β-mannoside. Shortly after this disclosure, Stork and coworkers reported the use of silylketal-like intermediate 19 for a similar purpose (Scheme 7.17).65,66 Although these important achievements convincingly demonstrated the potential of IAD for β-mannosylation, the absolute
BnO |
BnO |
|
HO |
|
|
TMSOTf |
BnO |
BnO |
OMe |
||
O |
+ |
HO |
O |
TMSOMe |
O |
BnO |
|||||
BnO |
BnO |
||||||||||
BnO |
|
|
|
|
BnO |
||||||
BnO |
|
|
|
|
toluene |
BnO |
|
O |
|||
|
|
|
|
|
|
||||||
|
O |
|
|
BnOOMe |
|
|
|
O |
|||
|
|
|
|
|
|
|
|
O |
|||
|
|
|
|
|
|
|
|
|
16 |
77% |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
LiAlH4 |
|
|
|
BnO |
|
OMe |
|
|
|
|
|
AlCl3 |
|
BnO |
|
|
||||
|
|
|
|
O |
BnO |
|
|||||
|
|
|
CH2Cl2-Et2O |
BnO |
|
BnO |
|
|
|||
|
|
|
BnO |
|
O |
|
|
||||
O
98% OH
Scheme 7.14 β-Mannoside via anomeric orthoester.

150 STEREOSELECTIVE β-MANNOSYLATION ON POLYMER SUPPORT
|
OH |
|
|
|
|
|
|
HO |
O |
|
|
|
|
|
|
OpNP |
|
|
|
|
|
|
|
HO |
NHAc |
N-Acetylhexosaminidase |
|
OH |
|
OH |
|
|
|
O |
|
O |
|||
|
|
|
|
HO |
O |
||
|
OH |
|
|
|
|||
|
|
|
HO |
|
HO |
OH |
|
HO |
O |
|
|
|
NHAc |
NHAc |
|
OH |
|
|
|
|
|
|
|
HO |
|
|
|
|
|
|
|
|
NHAc |
|
|
|
|
|
|
β-Mannosidase |
HO |
OH |
OH |
|
OH |
|
|
|
|
HO |
O |
O |
|
O |
(Ref. 62) |
|
|
O |
O |
|
|||
|
|
HO |
HO |
HO |
|
OH |
|
|
|
|
|
NHAc |
|
NHAc |
|
HO |
OH |
|
|
26% |
|
|
|
O |
|
|
|
|
|
|
|
HO |
|
|
|
|
|
|
|
OpNP |
|
|
|
|
|
|
|
HO |
|
|
|
|
|
|
|
|
OH |
|
OH |
|
|
|
|
β-1,4-Mannosyl |
||
|
|
|
|
|
|
|
transferase |
|||
HO |
O |
O |
O O O |
|
|
|
|
|
||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|||
HO |
AcNH |
HO |
AcNHO P O P |
|
|
H |
|
|
|
|
|
|
O |
|
|
|
|
|
|||
|
|
|
O- |
O- |
|
4 |
|
HO |
OH |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
O |
||
|
|
|
|
|
|
|
HO |
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
HO |
|
|
|
|
|
|
|
|
|
|
|
|
O-GDP |
|
hydrolysis |
|
OH |
|
OH |
|
|
|
(Ref. 63) |
|
|
HO |
|
|
|
|
OH |
||||
|
|
|
O |
|
O |
|
|
|
||
|
|
|
HO |
O |
O |
|
|
O |
||
|
|
|
|
|
|
|
||||
|
|
|
HO |
|
HO |
AcNH |
HO |
AcNH OH |
||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
80% |
|
|
|
|
Scheme 7.15 Enzymatic synthesis of βMan1→4βGlcNAc1→4GlcNAc.
yield of β-mannoside was comparable only with that obtained by conventional approaches.
In order to enhance the efficiency and practical utility of IAD, we started our investigation using mannosyl donor 20 equipped with 2-O-p-methoxybenzyl (PMB or MPM) group (Scheme 7.18).14 PMB has been widely used as a versatile protecting group that can be removed quickly under specific and mild conditions, by the action of DDQ67 or CAN.68 Since the deprotection with DDQ presumably proceeds via hydrolytic quenching of quinonemethide like intermediate 21, it was expected that, when the reaction is performed in the presence of aglycon with exclusion of moisture, mixed acetal 22 could be formed. Subsequent activation of the anomeric position should trigger IAD to selectively afford β-mannoside. This scenario is highly attractive, because (1) various methods for the introduction of the PMB group have been established and (2) the conditions required for the formation of the mixed acetal

7.1 p-METHOXYBENZYL-ASSISTED INTRAMOLECULAR AGLYCON DELIVERY |
151 |
|||
OH |
|
|
|
|
O |
|
|
|
|
|
O |
O |
O |
|
|
OH |
|
||
+ |
X |
O |
O |
O |
|
||||
O |
|
O |
|
|
|
IAD |
|
||
HO |
|
X |
|
|
|
|
|
||
O
|
|
|
HO |
|
|
|
|
|
O |
|
|
BnO |
O |
O |
|
BnO |
|
p-TsOH |
O |
|
|||
O |
|
BnO |
O |
|
|
||
BnO |
|
|
|
|
|||
|
|
BnO |
|
|
|
||
BnO |
|
|
|
|
|
|
|
|
|
CH2Cl2 |
|
|
|
|
|
|
SEt |
|
|
SEt |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
17 |
|
|
|
18 |
|
|
|
|
NIS |
|
|
OH |
|
|
|
|
4-Me-DTBP |
BnO |
O |
|
|
||
|
|
|
BnO |
O |
|
|
|
|
|
|
BnO |
O |
|
|
|
|
|
|
|
|
|
|
|
|
CH2Cl2 |
|
|
|
|
|
|
|
|
|
OH |
|
OBn |
|
OBn |
O |
: |
BnO |
O |
HO |
O |
HO |
O |
HO |
BnO |
|
BnO |
|
BnO |
OC8H17 |
|
|
|
|
|
||||
|
|
|
BnO OMe |
|
BnO OMe |
|
PhthN |
(yield of β-glycoside) |
|
(45%) |
(44%) |
|
(28%) |
||
Scheme 7.16 Intramolecular aglycon delivery for β-mannosylation.
are mild and near neutral, and may well be comparable to the presence of various types of protecting groups. More importantly, compared to other IAD systems developed previously, more efficient charge delocalization and therefore clean IAD via a mesomerically stabilized transition state was expected, due to the assistance of an electron donating p-methoxy group.
In practice, DDQ-mediated mixed acetal formation proved to be quite efficient and was complete within a few hours at room temperature. As expected, subsequent IAD proceeded stereoselectively to give β-glycoside. Methyl trifluoromethanesulfonate (MeOTf) proved to be the most suitable for this purpose. For instance, thiomannoside 23 afforded 60% yield of β-glycoside 27 and 28, via mixed acetal 26 (Scheme 7.19).69 One of the most distinct features of this type of transformation is its applicability to oligosaccharide fragment condensation. For instance, disaccharide donor 29 was reacted with 24 and 25 to give corresponding products with reasonable efficiency (Scheme 7.19). Even a 3+2 coupling using trimannoside donor 30 and disaccharide-derived acceptor 25 was successful. Resultant 31 was transformed to 32, thereby completing the

152 STEREOSELECTIVE β-MANNOSYLATION ON POLYMER SUPPORT
Me2SiCl2 imidazole
|
|
|
|
OH |
|
|
|
DMAP |
|
|
|
Si |
O |
|
||
|
BnO |
|
|
|
|
|
THF |
|
BnO |
O |
|
O |
|
|||
|
|
|
|
O |
|
|
|
|
|
O |
|
|
|
|||
|
BnO |
|
|
|
|
|
|
|
|
BnO |
|
|
|
|
||
|
BnO |
|
|
|
|
|
|
|
|
|
BnO |
|
|
|
|
|
|
|
|
|
O |
S |
Ph |
|
HO |
O |
|
|
S |
Ph |
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
19 |
|
|
|
|
|
|
|
|
Tf2O |
|
|
|
BnO |
OH |
|
|
|
|
|
|
|
2,6-di-tert-butylpyridine |
|
BnO |
O |
|
O |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
BnO |
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ether-CH2Cl2 |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
OH |
|
|
|
OBn |
|
|
OBn |
|
OBn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
O |
: |
BnO |
|
|
O |
|
|
BnO |
O |
OMe BnO |
|
|
O |
HO |
O |
|
HO |
|
BnO |
|
|
|
|
BnO |
|
|
|
BnO |
OC8H17 |
||||
|
|
|
|
|
|
|
HO |
|
|
|
||||||
|
|
|
|
|
|
BnO |
|
|
|
HO |
|
|
|
|
|
|
|
|
|
|
|
|
OMe |
|
|
|
|
BnO OMe |
PhthN |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
(yield of β-glycoside) |
|
|
(82%) |
|
|
(55%) |
|
|
(72%) |
|
(42%) |
|||||
Scheme 7.17 β-Mannoside synthesis using a silylketal-like intermediate.
|
OMe |
|
|
|
O+Me |
|
|
|
|
|
|
|
|
|
|
O |
|
DDQ |
O |
HO |
|
O |
|
|
|
|
|||||
|
|
O |
|
|
|
||
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SMe |
|
O |
|
SMe |
|
|
20 |
HO |
21 |
|
|
|
||
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
OMe |
|
|
|
|
|
|
|
|
|
|
IAD |
OH |
|
|
|
|
|
O |
|
|
|
|
O |
O |
|
|
O |
O |
O |
|
|
|
|
|
||||
|
|
|
|
|
|||

 O
O
MeS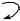
22
Scheme 7.18 p-Methoxybenzyl-assisted intramolecular aglycon delivery.

7.1 p-METHOXYBENZYL-ASSISTED INTRAMOLECULAR AGLYCON DELIVERY 153
|
|
|
|
|
OBn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
O |
|
OMP |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
OMe |
BnO |
|
|
|
|
|
|
|
|
|
|
OMe |
|
|
|
|
|
24 NPhth |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Ph |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OBn |
O |
OO |
|
DDQ/CH2Cl2 |
|
|
|
|
Ph |
|
O |
O |
O |
O |
|||
|
|
|
|
|
|
|
||||||||||
|
O |
|
|
|
|
|
|
|
|
|
|
O |
|
O |
BnO |
O |
TBDPSO |
SMe |
|
|
|
|
|
|
|
|
TBDPSO |
|
SMe |
NPhth |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
23 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OBn |
|
|
|
NPhth |
|
|
|
|
|
26 |
|
|||
|
|
|
|
O BnO |
|
|
|
|
|
|
|
|
||||
|
|
HO |
|
|
|
|
OMP |
|
|
|
|
|||||
|
|
|
O |
|
|
|
|
|
|
|
|
|||||
|
|
BnO |
|
|
|
O |
|
|
|
|
|
|
|
|
||
|
|
|
NPhth |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
OBn |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
25 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ph |
|
O |
|
OH |
|
|
|
NPhth |
|
|
||
|
|
|
|
|
|
O |
|
O |
BnO |
|
OMP |
|
||||
|
|
|
|
|
|
|
|
|
O |
|
|
|||||
|
|
|
|
TBDPSO |
|
|
|
|
|
|
O |
|
|
|||
|
|
MeOTf-DBMP |
|
|
|
|
|
|
27 |
|
|
|
OBn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(CH2Cl)2 |
|
|
|
|
|
|
|
|
|
60% |
|
|
|
|
|
|
|
|
Ph |
|
O |
OH |
|
|
|
NPhth |
OBn |
|
|||
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
O |
|
|
|
O |
|
BnO |
|
|
O |
O |
OMP |
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|||
|
|
|
|
TBDPSO |
|
|
|
|
|
O |
BnO |
|||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
OBn |
NPhth |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
28 |
|
60% |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OBn |
|
|
|
|
|
|
|
|
|
|
|
OMe |
|
HO |
|
O |
OMP |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
BnO |
|
NPhth |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
Ph |
O |
OO |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
OO |
|
|
SMe |
|
|
DDQ/CH2Cl2 |
|
|
|
|||
|
|
BnO |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
BnO |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
BnO |
|
OAc |
|
|
|
|
|
|
OBn |
|
|
NPhth |
|
|
|
|
|
|
|
|
|
HO |
|
|
O BnO |
|
|
||||
|
|
|
|
29 |
|
|
|
|
|
OMP |
|
|||||
|
|
|
|
|
|
|
|
|
O |
|
|
|||||
|
|
|
|
|
|
BnO |
|
|
|
O |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
NPhth |
OBn |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
Ph |
|
O |
|
OH |
BnO |
NPhth |
|
|||
|
|
|
|
|
|
|
|
O |
|
|
O |
|
OMP |
|
||
|
|
|
|
|
|
|
|
O |
|
|
O |
|
O |
|
||
|
|
|
|
|
BnO |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
OBn |
|
|
|
|
|
|
|
BnO |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
MeOTf-DBMP |
BnO |
|
|
OAc |
|
|
53% |
|
|
|
||||
|
|
(CH2Cl)2 |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
Ph |
|
O |
|
OH |
|
BnO |
|
NPhth |
OBn |
|
||
|
|
|
|
|
|
O |
|
|
O |
|
|
|
O |
O |
|
|
|
|
|
|
|
|
O |
|
|
|
O |
|
|
OMP |
|||
|
|
|
|
|
|
|
|
|
|
|
O BnO |
|||||
|
|
|
|
BnO |
|
|
|
|
|
|
|
OBn |
|
NPhth |
|
|
|
|
|
BnO |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
BnO |
OAc |
|
|
|
|
49% |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Scheme 7.19 Synthesis of core structures of Asn-linked oligosaccharides.

154 STEREOSELECTIVE β-MANNOSYLATION ON POLYMER SUPPORT
OBn OMe
BnO
O
BnO
BnO
|
|
O |
OO |
|
|
|
|
|
|
|
|
BnO |
|
|
|
OBn |
|
|
|
|
|
|
|
O |
|
|
BnO |
|
|
|
|
|
BnO |
|
|
|
SMe |
O |
|
|
|
|
|
|
|
|
BnO |
|
|
|
|
|||
BnO |
|
|
|
1) DDQ |
|
|
|
|
|
|
|
O |
30 |
2) MeOTf |
BnO |
|
|
|
|
|
|
BnO |
|
|
|
|
|
|
||||
|
OBn |
|
O |
OH |
NPhth |
OBn |
||||
|
|
|
|
|||||||
|
|
|
|
|
|
|
||||
|
|
+ |
|
|
|
BnO |
O BnO |
|
O |
O |
|
|
|
41% |
|
O |
|
OMP |
|||
|
|
|
|
|
O |
O |
BnO |
|||
|
|
|
|
|
|
NPhth |
||||
|
OBn |
|
|
BnO |
|
|
OBn |
|
||
|
|
NPhth |
BnO |
O |
31 |
|
|
|
||
|
O |
BnO |
|
|
|
|
||||
HO |
|
OMP |
BnO |
OBn |
|
|
|
|||
|
O |
|
|
|
|
|
|
|
||
BnO |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
NPhth OBn
αMan1→6
βMan1→4βGlcNAc1→4GlcNAc
αMan1→3
32
(Core Pentasaccharide)
HO |
OH |
|
|
|
HO |
|
|
|
|
HO |
O |
|
|
|
|
OH |
|
OH |
|
HO |
|
|
|
|
|
O |
|
|
|
|
|
|
|
Me |
|
|
|
||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
O |
OH |
HO |
NHAc |
|
O |
|
||
|
HO |
O |
|
O |
|
O H |
|
||
|
|
O |
O |
|
N |
COOH |
|||
|
O |
|
|
HO |
|
||||
HO |
|
|
|
OH |
|
|
|
NHAc |
|
|
|
|
|
|
|
O |
NH2 |
||
HO |
O |
|
|
|
|
|
|
||
HO |
OH |
|
|
|
33 |
|
|
|
|
|
HO |
OH |
|
|
|
|
|
|
|
|
HO |
O |
|
|
|
|
|
|
|
|
HO |
|
|
|
|
|
|
|
|
HO |
NHAc O |
OH |
HO |
|
NHAc |
|
OH |
|
|
HO |
O |
O |
O |
|
O |
|
O |
|
|
|
O |
|
|
OR |
|
||||
|
O |
|
|
|
|
||||
HO |
|
|
|
O HO |
NHAc |
|
|||
|
|
|
OH |
|
|
||||
|
HO |
|
|
|
|
|
|
||
HO |
O |
|
|
|
|
|
|
|
|
HO OH
34
Scheme 7.20 Convergent synthesis of core pentasaccharide.
convergent and fully stereocontrolled synthesis of the core pentasaccharide structure of Asn-linked glycans (Scheme 7.20).70
Since all hydroxyl groups of the β-linked mannose residue can be distinguished, stereoand regiocontrolled synthetic routes to essentially all types of Asn-linked glycans can be conceived. This aspect was demonstrated by the synthesis of

7.1 p-METHOXYBENZYL-ASSISTED INTRAMOLECULAR AGLYCON DELIVERY 155
fucose-containing hexasaccharide 3371 and bisecting GlcNAc carrying structure 34,72 and subsequently by completion of the chemical synthesis of the full structure of complex type undecasaccharide.
The stereochemical issue of the acetalic carbon was subsequently addressed. Specifically, two diastereomers are possible at the stage of mixed acetal formation. Quite remarkably, the formation of mixed acetal proved to be highly selective to give almost exclusively the S-diastereomer. Mixed acetals with various substitution patterns were synthesized and uniformly stereoseletive formation of S-isomers was observed in each case (Scheme 7.21).73
The efficiency of PMB was further enhanced by modifying the protecting group pattern. As summarized in Table 7.1, highly efficient β-mannosylation was achieved with 4,6-O-disiloxane-protected 38 or 4,6-O-cyclohexylidene-protected 35. The latter afforded diand trisaccharide products 36 and 37a in ~80% yield (Scheme 7.22).74 Since 4,6-O-isopropylidene carrying 39 was less efficient compared to 35, the rigidity of the pyranose ring seems to be important. Trisaccharide product 37b obtainable from 35 was successfully used as the key intermediate in the first purely chemical synthesis of prototypical complex-type glycan chain 40.75 In this case, trisaccharide product 37b was transformed to 41 and glycosylated with sialic acid containing trisaccharide donor 42 to give 43. Subsequent deprotection and regioselective glycosylation at the 6 position afforded undecasaccharide that was transformed into target 40. The same oligosaccharide structure was synthesized previously by Unverzagt using a chemoenzymatic approach.57
|
|
OMe |
|
O+Me |
|
|
|
|
|
|
|
|
|
RO |
O |
|
|
|
|
|
O |
RO O |
|
|
|
||
RO |
|
|
O |
|||
|
|
O |
|
|
||
RO |
|
X |
RO |
|
O |
|
|
|
RO |
H |
|
|
|
|
|
|
|
X |
|
|
|
|
OMe |
|
re-face attack |
||
RO O |
H |
O |
RO |
OH |
O |
|
O |
|
|||||
RO |
O |
|
RO |
O |
O |
|
|
|
|
|
|
||
RO |
|
|
|
RO |
|
|
|
|
X |
|
|
|
|
S-Diastereomer |
|
|
β−Glycoside |
|||
Scheme 7.21 Stereochemical assignment of mixed acetal.

156 STEREOSELECTIVE β-MANNOSYLATION ON POLYMER SUPPORT
TABLE 7.1 Summary of β-Mannosylation Reactions
Acceptor |
Donor |
Yield |
Promotera |
Ref. |
OH
O
BnO  OBn
OBn
BnO BnO
OBn
O
HO  OBn
OBn
BnO BnO
|
OBn |
|
HO |
O |
OMP |
|
||
BnO |
NPhth |
|
|
||
|
OBn |
BnO |
NPhth |
|
|
O |
|||
HO |
OMP |
|||
|
O |
|||
BnO |
NPhth |
O |
||
|
OBn |
|||
|
|
|
||
OMe
BnO OO
BnO
BnO
F
A |
|
74 |
1 |
72 |
|||
A |
|
52 |
2 |
14 |
|||
A |
|
40 |
2 |
14 |
|||
B |
|
60 |
3 |
73 |
|||
C |
|
53 |
3 |
73 |
|||
E |
|
83 |
|
3 |
73 |
||
F |
|
60 |
|
3 |
73 |
||
G |
|
75 |
|
3 |
73 |
||
B |
|
53 |
3 |
73 |
|||
C |
|
49 |
3 |
73 |
|||
D |
|
41 |
3 |
73 |
|||
E |
|
85 |
|
3 |
73 |
||
|
BnO |
OBn |
OMe |
|
|||
|
O |
|
|
|
|
|
|
|
BnO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
BnO |
|
|
|
|
|
|
O OO
BnOO 
BnO |
SMe |
BnO 
 O
O
BnO OBn
|
A |
OMe |
|
|
|
|
|
|
|
|
|
|
D (30) |
|
|
|
|
|
|
|
|
|
|
|
OMe |
|
|
||
Ph |
O |
OO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
O |
|
|
|
O |
|
|
|
|
TBDPSO |
SMe |
|
O |
|
|
|
|
||
|
|
|
O |
|
|
|
|||
|
|
|
O |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
TBDPSO |
|
|
|
|
|
|
B (23) |
|
|
|
SMe |
|
|
||
|
|
|
|
|
|
|
|
||
|
|
OMe |
|
OMe |
E (35) |
|
|
||
|
|
|
|
|
|
||||
Ph |
O |
O |
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
O |
O |
O |
|
|
|
|
OMe |
|
|
|
|
|
|
|
||||
BnO |
O |
SMe |
O |
|
|
iPr i |
|
|
|
|
O |
|
|
Pr |
|
||||
BnO |
O |
|
TBDPSO |
|
|
|
Si |
|
|
BnO OAc |
|
|
SMe |
|
O |
|
|
||
|
|
iPr |
O |
O |
|||||
|
|
|
|
||||||
|
|
C (29) |
|
|
iPr |
Si |
O |
|
O |
|
|
|
F (39) |
|
Me3SiO |
|
|||
SMe
G (38)
a(1) AgClO4–SnCl2/Et2O; (2) AgClO4–SnCl2/CH2Cl2; (3) MeOTf/ClCH2CH2Cl.

7.1 p-METHOXYBENZYL-ASSISTED INTRAMOLECULAR AGLYCON DELIVERY 157
|
|
|
|
OBn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
O |
OMP |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
BnO |
NPhth |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
OH |
|
NPhth |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O BnO |
||||||
|
OMe |
|
|
|
|
|
|
|
OMe |
|
|
|
|
|
|
O |
|
|
O |
|
O |
OMP |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
TBDPSO |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OBn |
|
|
|
|
|
|
|
|
|
|
|
H |
OBn |
|
|
MeOTf |
|
|
|
36 |
|
|
|
||
|
|
|
DDQ |
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|||||
|
O |
|
|
|
|
|
O |
O |
|
O |
|
DBMP |
|
|
|
|
|
|
|||||
O |
(1.5 equiv.) |
|
|
O |
|
|
|
|
|
|
|
83% |
|
|
|||||||||
O |
|
|
|
O BnO |
|
NPhth |
|
ClCH2CH2Cl |
|
|
|
|
|||||||||||
O |
|
CH2Cl2, r.t., 2.5 h |
O |
|
|
H |
|
|
|
|
|
|
|
|
|||||||||
TBDPSO |
|
TBDPSO |
|
|
|
|
|
|
|
45 |
C, 18 h |
|
|
|
|
|
|
|
|||||
|
SMe |
|
|
|
|
|
|
SMe |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
35 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
OR1 |
(1.3 equiv.) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
NPhth |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
O BnO |
|
O |
O OR2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
O |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
TBDPSO |
|
|
|
BnO |
NPhth |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OBn |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
OBn |
|
NPhth |
|
|
|
|
|
|
|
|
|
|
37 |
R1 |
R2 |
Yield (%) |
|
|||
|
|
|
O |
BnO |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
|
OR |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
a |
Bn |
MP |
|
85 |
|
|||
|
BnO |
NPhth |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
OR1 |
|
|
|
|
|
|
|
|
|
|
b |
MP |
Bn |
|
78 |
|
||||
|
|
|
|
O |
|
OAc |
|
|
N3 |
|
OMP |
|
|
|
|
|
|
|
|
H+ |
|
|
|
|
|
|
|
|
O BnO |
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|||
37b |
|
|
|
O |
|
|
|
O |
|
OBn |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
HO |
|
|
|
|
O BnO |
|
N3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OBn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
41 |
|
|
|
|
|
|
OAc |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OAc CO2H |
OAc |
|
OBn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
AcO |
|
|
O |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
O |
|
OC(NH)CCl3 |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
AcNH |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
OAc |
|
O BnO |
PhthN |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
AcO |
OBn |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
42 |
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
OBn |
|
|
N3 |
|
|
OMP |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
O |
BnO |
|
|
O |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
O |
|
O BnO |
|
OBn |
|
|
|
|
|
|
|
||
|
|
|
|
|
HO |
|
|
|
|
OBn |
|
|
N3 |
|
|
|
|
|
|
|
|
||
OAc |
|
|
HO |
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
OAc CO2H |
|
|
HO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
AcO |
|
|
OAc |
OBn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
O |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
O |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
AcNH |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
OAc |
|
|
O BnO |
|
|
|
43 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
OBn |
|
N3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
AcO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
CO2H |
OH O |
|
OH |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
HO |
|
O O |
|
|
O |
O |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
AcNH |
OH |
|
|
O HO |
AcNH |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
HO |
OBn |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
HO |
O |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
OH |
|
NHAc |
OH |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O HO |
|
|
O |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
O |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
O |
|
HO |
|
OH |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
|
|
OH |
|
|
NHAc |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
OH |
|
|
|
|
HO |
O |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
OH |
CO2H |
|
|
|
HO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
O |
OH O |
|
OH |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
O |
|
|
O |
O |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
AcNH |
OH |
|
|
O HO |
AcNH |
40 |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
HO |
OH |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Scheme 7.22 Cyclohexylidene-protected mannosyl donor.
