
Карцев В.Г. - Избранные методы синтеза и модификации гетероциклов. Том 2 (2003)(ru)
.pdf
Схема 11
|
|
|
|
|
|
|
|
Ph N |
|
H |
|
|
|
Ph Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
N Ph |
|
|
|
N |
|
|
|
Cl |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
R = H, R1 = Cl |
|
|
|
N |
Cl |
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ph |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R3 |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R2 |
|
|
|
|
R4 |
|
|
|
R4 |
|
|
|
R |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
O |
Cl |
|
ArNH2 |
|
O HN |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
Cl |
|
R1 = H |
R |
NH |
3 |
|
|
|
|
N |
NH |
||||||||||||||||||||
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|||||
R1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R2 |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R2 |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ar |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R3 |
|
|
|
|
|
|
|
15 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R4 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
PhNH2 |
|
|
|
|
O |
|
HN |
|
H2SO4 |
|
|
|
|
|
|
Cl |
|||||||||||
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
NH |
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
R = H, R1 = Cl |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
OH |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16 |
|
|
||
|
|
|
|
|
|
R = Me, i-Pr, CH Cl, Ph; R2 |
= H, Me; R3 = H, Cl; R4 = H, Br, Me; |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ar = Ph, 3-MeC6H4, 3-BrC6H4, 2-MeC6H4, 4-ClC6H4 |
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Схема 12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R' |
N |
R" |
|
|
||||
O |
|
S |
R' + |
|
|
O |
|
|
i-PrONa |
|
|
|
|
|
|
|
|
|
N |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
R |
|
|
N |
HN |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
i-PrOH |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
R"' |
|
|
|
|
|
|
|
R |
N |
|
O |
|
|
||||||||||||||||
|
|
|
|
|
R" |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
R"' |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17 |
|
|
|
|
|
|
|
|
|
R = Me, Ph, 4-MeC6H4, 4-MeOC6H4, 4-ClC6H4; |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
R' = Et, Pr, (EtO)2CHCH2, Ph, Bn; R" = H; |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
R'+R" = (CH2)2O(CH2)2; R'" = H, Me |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Избранные методы синтеза и модификации гетероциклов, том 2 |
|
|
|
291 |
|||||||||||||||||||||||||||||||

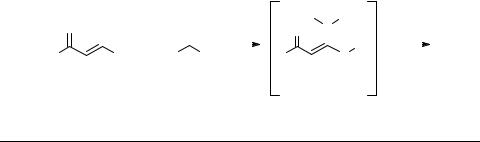
При реакции дихлорвинилкетонов с сульфидом натрия выделены преимущественно дитиолы, с солями диалкилдитиокарбаминовой кислоты – дитиетаны [19]. Получение дитиола или дитиетана можно объяснить промежуточным образованием ацетиленового тиола или ацетилтиокетена соответственно [21]. Отсутствие продуктов присоединения спирта или воды из реакционной среды к чрезвычайно реакционноспособным тиокетенам либо ацетиленовым тиолам не исключает образования гетероциклических соединений 18, 19 в соответствии со схемой 13 [19].
Кроме характерных реакций по карбонильной группе, для ацилсодержащих дитиолов 19 и дитиетанов 18 изучено взаимодействие с рядом О-, S-, N-нуклео- филов. Показано, что при взаимодействии дитиетанов 18 с этими нуклеофилами наблюдается деструкция цикла и образуются соответствующие тиоэфиры и амиды бензоил- и пропионилтионоуксусной кислоты [20].
В реакции с этилен- и 1,3-пропилендиаминами образуются 2-бензоилметил- 4,5-дигидроимидазолины и 3,4,5,6-тетрагидропиримидины [20].
Дитиолы 19 в химическом отношении инертны: в обычных условиях не присоединяют спиртов, аминов, тиомочевины, не гидролизуются в присутствии кислот и оснований, под действием HgO, AgNO3, Cu не десульфуризуются, не образуют комплексов с HgCl2, тетрацианэтиленом и др. [19].
Следует отметить характерную особенность дитиолов 19 – наличие в твердом состоянии парамагнетизма. Общая концентрация парамагнитных центров для дитиолов с R = Me, Pr составляет ≈1019 спин/моль [19].
5. 1,3-Тиазинтионы и тиазолы
Установлено, что 2,2-дихлорвиниларил(алкил)кетоны вступают во взаимодействие с тиомочевиной и ее производными, тиоамидами различных кислот с одновременным замещением атомов галогена и кислорода карбонильной группы и образованием широкого ряда тиазинов 20 [11, 22–25] (схема 14).
Оптимальным является соотношение дихлорвинилкетон : тиоамид, равное 1 : 2. При эквимольном соотношении реагентов гетероциклизация также происходит, но остается непрореагировавшим кетон, а выход целевых тиазинтионов 20 низок.
Схема 14
|
|
|
|
|
|
|
|
R" |
+ NH |
2 |
|
||||
O |
|
Cl |
|
S |
|
O |
S |
|
|
|
|||||
|
+ H2N |
|
|
|
|
|
|||||||||
|
|
|
|
S R" |
|||||||||||
|
|
Cl |
|
R" |
|||||||||||
R |
|
|
|
|
R |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R' |
|
|
|
|
R' |
|
|
NH2 2HCl |
||||||
Избранные методы синтеза и модификации гетероциклов, том 2 |
293 |

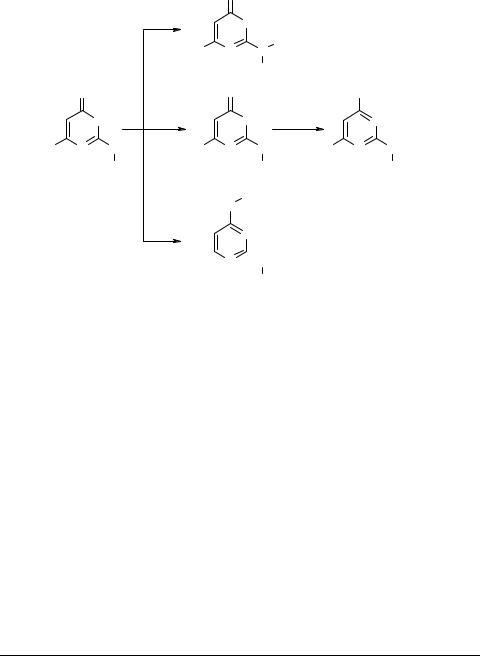
Тиазин-6-тионы 20 в свою очередь вступают в реакции с участием амино- и тионо-групп [22] (схема 17).
Схема 17
S
|
YR" |
N |
S |
N R" |
|
|
|
R |
|
|
|
||
|
R' = H |
|
|
|
|
|
|
|
|
|
R' |
|
|
S |
|
O |
|
|
|
Cl |
S |
Ac2Hg |
|
S |
(COCl)2 |
|
S+ Cl− |
R N NH |
R |
N |
|
NH |
R |
N NH |
R' |
|
|
|
R' |
|
R' |
|
|
S |
Alk |
|
|
|
|
AlkX |
|
S+ |
X− |
|
|
R N
N  NH
NH
R'
R = Me, Ph; AlkX = MeI, Me2SO4, Et3OBF4; YR" = Ac2O, Me2NCHO−MeC(OMe)3, PhNCO;
NR'R" = NHAc, N=CHNMe2, NHC(O)NHPh
Нами недавно установлено (неопубликованные результаты), что дибромвинил(трифторметил)кетон [27] в реакции с тиомочевиной и тиоацетамидом также образует 2-амино- и 2-метил-3-(трифторметил)тиазин-6-тионы.
Таким образом, реакции дихлор(бром)винилкетонов и продуктов замещения атомов галогена на органилтио- и органиламино-группы с тиоамидами кислот, тиомочевиной и ее N-производными − очень перспективный путь синтеза замещенных тиазинтионов. В то же время практически не изучено влияние атома галогена в положении 1 винильной группы или двух атомов галогена в α-поло- жении алкильного фрагмента кетонов на направление процесса и течение реакций.
S-Алкилированная тиомочевина и мочевина в реакцию с дихлорвинилкетонами не вступают, что вызвано в первом случае дезактивацией атома серы и во втором − меньшей нуклеофильностью атома азота в мочевинах, по сравнению с таковой в аминах, гидразинах, семи- и тиосемикарбазидах [23].
6. Пиразолы из хлор(бром)винилкетонов
Наиболее значимые результаты получены по применению хлор(бром)винилкетонов для синтеза пиразолов. Это хорошо согласуется со структурой галогенвинил-
Избранные методы синтеза и модификации гетероциклов, том 2 |
295 |
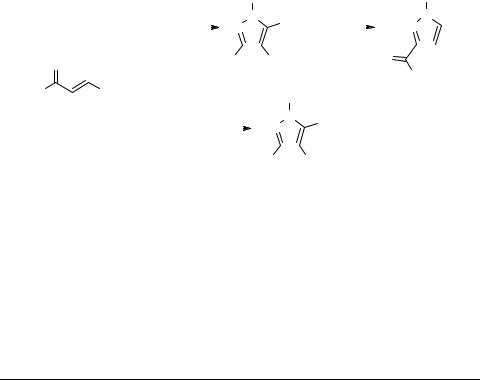
Показано также [29–31], что 2,4-динитрофенилгидразоны алифатических 2,2-дихлорвинилкетонов не циклизуются в 5-хлор-1-(динитрофенил)пиразолы в отличие от соответствующего гидразона 2,2-дихлорвинилфенилкетона. При этом была установлена определяющая роль конформации кетона и син-анти-изомерии гидразона в процессе гетероциклизации [29, 30]. Отмечена зависимость биологической активности динитрофенилгидразонов от их строения [31].
Взаимодействие дихлорвинилкетонов с гидразином и алкилгидразинами не было изучено до наших работ.
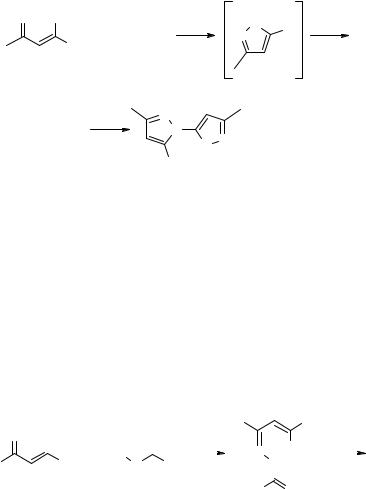
Ранее мы сообщили [32], что взаимодействие метил(2,2-дихлорвинил)кетона с гидразином не останавливается на стадии получения 1-метил-5-хлорпиразола, а сопровождается конденсацией последнего по схеме 19.
Схема 19
O Cl |
|
|
H |
|
+ NH2NH2 |
|
N |
Cl |
|
|
|
|||
Cl |
|
N |
||
|
|
|||
|
|
|
|
|
|
N |
|
2HCl |
|
|
N |
|
|
|
|
|
N |
N |
|
|
Cl |
H |
|
|
|
|
|
|
Однако в свете новых данных по изучению реакций алкил(дихлорвинил)- кетонов с гидразинами эти результаты требуют уточнения.
Следует подчеркнуть, что образующееся соединение не является продуктом конденсации пиразольных колец, протекающей при получении 5-хлорпиразолов действием PОСl3 на пиразол-5-оны [33, 34] и осложняющей процесс получения целевых 5-хлорпиразолов из пиразолонов.
Алкил(2,2-дихлорвинил)кетоны гладко дают с семи- и тиосемикарбазидом лишь соответствующие семи- и тиосемикарбазоны, которые не циклизуются в пиразолы.
Однако, при взаимодействии арил(2,2-дихлорвинил)кетонов с семикарбазидом образуются пиразолы, причем атом хлора в них замещается при действии избытка семикарбазида в условиях реакции, что приводит к соединениям 26 [32] (схема 20).
|
|
|
|
|
|
|
|
|
|
|
|
Схема 20 |
O |
Cl |
|
|
|
|
|
Ar |
|
Cl |
|
|
|
+ H2N |
O |
|
Cl |
|
|
|||||||
|
|
|
|
|
|
|
N |
|
|
|
||
Ar |
|
Cl |
|
|
|
|
|
NH |
|
|
||
|
|
N NH2 |
|
|
|
|||||||
|
|
|
|
H |
|
|
|
|
||||
|
|
|
|
|
|
|
|
H2N |
|
O |
|
|
|
|
|
|
|
|
|
|
|
||||
Избранные методы синтеза и модификации гетероциклов, том 2 |
297 |
|||||||||||

Недавно нами разработана гетероциклизация 2-хлор- и 2,2-дихлор(бром)ви- нилкетонов с несимметричным диметилгидразином, приводящая к 3-замещенным 1-метил-, 1-метил-5-хлор- и 1-метил-5-бромпиразолам 29 соответственно [35–38] (схема 23). В качестве второго продукта с выходом до 90% выделен 1,1,1-триме- тилгидразинийгалогенид.
Схема 23
O |
Hal |
N N |
Hal |
N |
N + X |
R |
+ NH2NMe2 |
R |
X |
|
|
X |
R |
Hal− |
|||
|
|
|
|
||
|
NH2NMe2 |
N N X + |
NH2NMe3Hal |
|
|
|
−MeHal |
|
|
|
|
R
29
R = Me, Et, Pr, i-Pr, CH2Cl, CF3, Ph, 4-MeC6H4, 4-MeOC6H4, 4-BrC6H4, 4-ClC6H4, 4-NO2C6H4, 3-NO2C6H4; Hal = Cl, Br; X = H, Cl, Br
1-Метилпиразолы 29 образуются с хорошими выходами.
Реакция осуществляется, по-видимому, через образование диметилгидразонов хлорвинилкетонов с последующей внутримолекулярной нуклеофильной атакой атомом N диметиламино-группы по β-углеродному атому винильной группы и циклизацией в нестабильные N,N-диметилпиразолинийхлориды или -бромиды, которые под воздействием избытка 1,1-диметилгидразина декватернизуются с выделением пиразолов 29.
Альтернативный механизм реакции, включающий первоначальное образование четвертичной соли 1-[1-хлор(бром)(H)-2-ацилвинил]-1,1-диметилгидразиний- галогенидов с последующей гетероциклизацией маловероятен. Подтверждением этому служит факт образования четвертичных солей диметилгидразина аналогичного строения – 1-[1-бром-2-бензоил(2-теноил)винил]-1,1-диметилгидразиний- бромидов из соответствующих бромацетиленовых кетонов и 1,1-диметилгид- разина, которые не циклизовались в пиразолы. Строение этих солей было установлено методом РСА [39].
Такимобразом, представленные методы синтеза 1-метил-3-алкил-, хлоралкил-, перфторалкил-, арил-5-хлорпиразолов основаны на доступном промышленном сырье, не требуют применения специального оборудования и катализаторов, могут быть легко осуществлены в промышленности, а использование в реакциях 1,1-ди- метилгидразина позволяет предложить этот процесс в качестве основы для созда-
Избранные методы синтеза и модификации гетероциклов, том 2 |
299 |


 N
N  R"
R"