
Карцев В.Г. - Избранные методы синтеза и модификации гетероциклов. Том 1 (2003)(ru)
.pdf
СЕРИЯ МОНОГРАФИЙ I N T E R B I O S C R E E N
ИЗБРАННЫЕ МЕТОДЫ СИНТЕЗА И МОДИФИКАЦИИ ГЕТЕРОЦИКЛОВ
Под редакцией В.Г. Карцева
Том 1
УДК 547.7/.8:615.011 ББК 24.23
Авторский знак X=46
Избранные методы синтеза и модификации гетероциклов / Под редакцией В.Г. Карцева. – М.: IBS PRESS
press@ibscreen.chg.ru
ISBN 5-93584-011-1 |
IBS PRESS, 2003 |
Главный редактор |
Карцев В.Г. |
Редакционная коллегия
Андронати С.А. |
(Украина) |
Ахрем А.А. |
(Беларусь) |
Белецкая И.П. |
(Россия) |
Влад П.Ф. |
(Молдова) |
Зефиров Н.С. |
(Россия) |
Еляков Г.Б. |
(Россия) |
Катрицкий А.Р. |
(США) |
Кухарь В.П. |
(Украина) |
Лозинский М.О. |
(Украина) |
Лукевиц Е.Я. |
(Латвия) |
Минкин В.И. |
(Россия) |
Тартаковский В.А. |
(Россия) |
Толстиков Г.А. |
(Россия) |
Трофимов Б.А. |
(Россия) |
Чупахин О.Н. |
(Россия) |
Региональные члены редколлегии
Адекенов С.М. |
(Казахстан) |
Аветисян А.А. |
(Армения) |
Граник В.Г. |
(Россия) |
Григорьев И.А. |
(Россия) |
Довлатян В.В. |
(Армения) |
Кемертелидзе Э.П. |
(Грузия) |
Костяновский Р.Г. |
(Россия) |
Лахвич Ф.А. Поройков В.В. Пралиев К.Д. Хиля В.П.
Чарушин В.Н. Шахидоятов Х.М. Юнусов М.С.
(Беларусь) (Россия) (Казахстан) (Украина) (Россия) (Узбекистан) (Башкирия)
Ответственный секретарь |
Семенова Л.Ф. |
Редакторы |
Краснов К.А. |
|
Шекк Ю.Б. |
|
Серков И.В. |
|
Лаврентьев И.П. |
Компьютерная верстка |
Закиева И.С. |
Компьютерный отдел |
Кулакова М.А. |
|
Поляков С.В. |
|
Фокина С.В. |
Введение
Настоящий том открывает серию монографий, посвященную современным аспектам химии гетероциклических соединений по результатам научных исследований, полученным за последнее время в университетах и академических институтах России, Украины, Белоруссии и других республиках Содружества Независимых Государств и стран Балтии, которые, несмотря на разделение государственными границами, объединены многими годами тесного сотрудничества и общностью химических школ.
Первый том серии представляет собой сборник тематических обзоров, посвященных синтезу и изучению свойств азотсодержащих гетероциклов, а также некоторым аспектам их биологической активности.
В последний раздел издания включены также описания 80 наиболее интересных методов синтеза и модификации азотистых гетероциклов, разработанных учеными СНГ за последние годы.
Редакционная редколлегия благодарна всем авторам за участие в монографии и сотрудничество.
Планируется, что следующее издание (2-й том) будет посвящено избранным методам синтеза и модификации кислород- и серусодержащих гетероциклов.
Предполагается также посвятить отдельные издания этой серии химии и биологи-
ческой активности различных классов природных соединений и их синтетических аналогов.
Я хотел бы выразить надежду на то, что эта новая серия монографий привлечет к себе внимание зарубежных ученых и их участие в последующих изданиях.
Идея публикации этой серии предложена компанией InterBioScreen и Фондом "Научное партнерство", являющихся лидерами исследовательских программ по направленному синтезу новых органических соединений, а также модификации природных соединений в рамках международного сотрудничества с университетами и фармацевтическими, агрохимическими и биотехнологическими компаниями. InterBioScreen является и главным спонсором настоящего издания.
Надеюсь, что материалы этой книги будут интересны и полезны самому широкому кругу читателей – ученым, работающим в области органического синтеза, медицинской химии, химии природных соединений, а также студентам и аспирантам соответствующих профилей.
Виктор Карцев Вице-президент InterBioScreen
Председатель Правления Фонда "Научное партнерство"

Оглавление
Анисимова Н.А., Дейко Л.И., Берестовицкая В.М. |
|
Производные пиразолинкарбоновых кислот: |
|
Получение и химические превращения.................................................................... |
7 |
Ахрем А.А., Гулякевич О.В., Михальчук А.Л. |
|
Синтез конденсированных производных хинолизина аннелированием |
|
циклических оснований Шиффа: Реакции [3+3]-циклоконденсации .................... |
22 |
Глушков В.А. |
|
3-Бензазепины............................................................................................................. |
44 |
Голиков А.Г., Кривенько А.П., Решетов П.В. |
|
Методы стереонаправленного синтеза моноциклических |
|
и аннелированных N-гидроксиалкилпиперидинов.................................................. |
65 |
Грандберг И.И. |
|
Индолилалкиламины и родственные структуры из γ- и |
|
δ-галогенкарбонилов и арилгидразинов ................................................................... |
79 |
Граник В.Г., Рябова С.Ю., Головко Т.В. |
|
Гетероциклизация производных индоксила и оксиндола....................................... |
91 |
Демченко А.М., Лозинский М.О. |
|
Синтез и свойства гетероциклических N-ариламидинов........................................ |
118 |
Десенко С.М., Чебанов В.А., Колос Н.Н., Орлов В.Д. |
|
Циклокондесация ароматических и гетероароматических |
|
1,2-диаминов с α,β-непредельными карбонильными соединениями..................... |
140 |
Дяченко В.Д., Роман С.В. |
|
Нафтиридины: Химия и биологическая активность................................................ |
167 |
Егорова А.Ю., Тимофеева З.Ю. |
|
Синтез пиррол-2-онов................................................................................................. |
181 |
Иванов Э.И. |
|
Химия циклогомологов ксантинов............................................................................ |
200 |
Клочкова И.Н., Семенова Н.Н. |
|
Пергидроазолы и пергидроазины: Синтез и области применения......................... |
213 |
Ковтуненко В.А., Кисель В.М. |
|
Успехи химии конденсированных хиназолинов...................................................... |
232 |
Избранные методы синтеза и модификации гетероциклов, том 1 |
5 |

Козьминых В.О., Козьминых Е.Н. |
|
Ацилпировиноградные кислоты в синтезе азотсодержащих |
|
гетероциклических соединений................................................................................. |
255 |
Коротких Н.И., Раенко Г.Ф., Киселев А.В., Книшевицкий А.В., |
|
Швайка О.П., Каули А.Г., Джонс Дж.Н., Макдональд Ч.Л.Б. |
|
Синтез стабильных гетероароматических карбенов ряда |
|
бензимидазола и 1,2,4-триазола и их прекурсоров.................................................. |
279 |
Кочергин П.М., Дружинина А.А. |
|
Синтез производных пирролсодержащих гетероароматических |
|
систем с мостиковым атомом азота........................................................................... |
300 |
Краснов К.А. |
|
Барбитуровые кислоты в синтезе новых гетероциклических систем: |
|
1. Синтез азагетероциклов ......................................................................................... |
314 |
Михалева А.И., Шмидт Е.Ю. |
|
Двухстадийный синтез пирролов из кетонов и ацетиленов |
|
по реакции Трофимова............................................................................................... |
349 |
Михалёнок С.Г., Кузьменок Н.М., Звонок А.М. |
|
Алкалоиды ряда пирроло[1,2-b]пиразола: Синтез витасомнина |
|
и его структурных аналогов....................................................................................... |
369 |
Серов А.Б., Карцев В.Г., Александров Ю.А. |
|
Илиды азотистых оснований в реакциях 1,3-диполярного |
|
циклоприсоединения .................................................................................................. |
393 |
Толстиков Г.А., Дембицкий В.М., Толстикова Т.Г., Шульц Э.Э. |
|
Эпибатидин и проблема неопиоидных анальгетиков.............................................. |
418 |
Шихалиев Х.С., Фалалеев А.В., Крыльский Д.В. |
|
Гуанидины в синтезе азагетероциклов ..................................................................... |
450 |
Шкляев Ю.В. |
|
Синтез 3,3-диалкилпроизводных 3,4-дигидроизохинолина.................................... |
478 |
Шкляев Ю.В., Глушков В.А. |
|
1-Замещенные 3,3-диалкил-3,4-дигидроизохинолины |
|
как нуклеофильные и электрофильные реагенты.................................................... |
493 |
Избранные методики........................................................................................ |
513–617 |
Авторский указатель........................................................................................ |
618–620 |
6 |
Серия монографий InterBioScreen |
Производные пиразолинкарбоновых кислот: Получение и химические превращения
Анисимова Н.А.1, Дейко Л.И.2, Берестовицкая В.М.2
1Горно-Алтайский государственный университет 649700, Республика Алтай, Горно-Алтайск, ул. Ленина, 1
2Российский государственный педагогический университет им. А.И. Герцена 191186, Санкт-Петербург, наб. р. Мойки, 48
Повышенный интерес к производным пиразолина связан с широким спектром практически полезных свойств этих соединений, многие из которых используются в медицине, промышленности и сельском хозяйстве [1, 2]. Многочисленные литературные данные по химии этих гетероциклов имеют разрозненный характер и посвящены, как правило, узким группам различных функционально-замещенных производных. При этом по химии одной из важнейших групп производных пиразола, пиразолинкарбоновым кислотам, анализ имеющихся публикаций в литературе отсутствует. Предлагаемый обзор обобщает материалы, касающиеся способов получения и реакционной способности пиразолинкарбоновых кислот.
Синтез эфиров пиразолинкарбоновых кислот
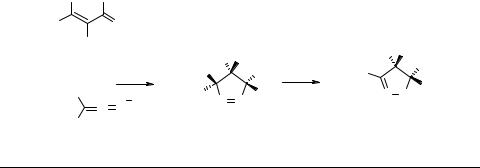
Основным методом синтеза эфиров пиразолинкарбоновых кислот является реакция 1,3-диполярного циклоприсоединения алифатических диазосоединений 2 (ДС) к активированным олефинам, например, к эфирам непредельных карбоновых кислот 1. Эти процессы протекают при температуре 0±5°С, приводя, как правило, к ∆-1 или ∆-2 пиразолинам с количественным выходом [3–5].
Значительное число производных этого ряда (3–13) было получено в работах [6–8] (схемы 1, 2). Циклоприсоединение диазосоединений к активированным олефинам протекают согласно правилу Ауверса, которое было установлено на основе изучения взаимодействия ДС с эфирами малеиновой, фумаровой кислот и их алкилпроизводными [9, 10]. Изучение строения образующихся производных пиразолина 3–7 показало, что реакции присоединения протекают стереоспецифично, c сохранением относительной исходной конфигурации заместителей
[11–15] (табл. 1).
Схема 1
R3 |
OMe |
|
|
|
|
|
|
R2 |
O |
|
|
|
|
|
|
|
R1 |
|
R2 |
R3 |
|
R2 |
R3 |
|
1 |
|
|
||||
|
MeO C |
R4 |
R1 = H MeO C |
R4 |
|||
|
0±10°C |
|
|
||||
|
|
|
|
||||
R5 |
+ |
2 |
|
|
|
2 |
N R5 |
R1 |
N N |
R5 |
N |
||||
|
+ |
|
|
|
H |
||
R4 |
N N |
|
|
|
|
|
|
2 |
|
3, 6 |
|
4, 5, 7, 8 |
|||
Избранные методы синтеза и модификации гетероциклов, том 1 |
7 |

Таблица 1. Производные пиразолинкарбоновых кислот 3–13, полученные взаимодействием диазосоединений с эфирами акриловой, малеиновой, фумаровой кислот и их производных*
|
R1 |
R2 |
R3 |
R4 |
|
R1 |
R2 |
R3 |
R4 |
R5 |
|
|
|
|
|
|
|
|
|
|
|
3а |
Me |
СО2Н |
Н |
Н |
8f |
– |
Me |
СО2Ме |
Ph |
Ph |
3b |
Me |
Me |
СО2Ме |
Н |
8g |
– |
b |
Me |
Ph |
Ph |
3c |
Me |
СО2Ме |
Ме |
Н |
9a |
Me |
H |
H |
H |
H |
3d |
Me |
Me |
СО2Me |
Me |
9b |
Me |
Me |
H |
H |
Me |
3e |
Me |
СО2Ме |
Me |
Me |
9c |
Me |
Me |
H |
H |
Me |
4a |
– |
СО2Ме |
Me |
Н |
9d |
Me |
H |
H |
Me |
H |
4b |
– |
Me |
СО2Ме |
H |
9e |
Me |
H |
Me |
H |
H |
4c |
– |
Me |
СО2Ме |
Me |
10а |
СО2Ме |
H |
H |
H |
H |
4d |
– |
СО2Ме |
Me |
Me |
10b |
СО2Et |
H |
Me |
H |
H |
5a |
– |
H |
СО2Ме |
H |
10c |
CN |
H |
H |
H |
H |
5b |
– |
H |
СО2Et |
H |
11a |
N3 |
H |
H |
H |
H |
5c |
– |
CO2H |
H |
H |
11b |
N3 |
Me |
H |
H |
H |
5d |
– |
СО2Ме |
H |
H |
11c |
N3 |
Et |
H |
H |
H |
5е |
Et |
H |
СО2Ме |
H |
12a |
– |
H |
H |
H |
H |
6 |
Me |
H |
СО2Ме |
a |
12b |
– |
Me |
H |
H |
H |
7 |
– |
H |
СО2Ме |
СО2Ме |
12c |
– |
H |
H |
H |
Me |
8a |
– |
СО2Ме |
H |
Ph |
12d |
– |
H |
Me |
H |
Me |
8b |
– |
H |
СО2Ме |
Ph |
12e |
– |
H |
Me |
H |
CO2Et |
8c |
– |
Me |
СО2Ме |
Ph |
12f |
– |
Me |
H |
H |
СО2Ме |
8d |
– |
СО2Ме |
Me |
Ph |
12g |
– |
H |
H |
H |
СО2Ме |
8e |
– |
Me |
СО2Ме |
NC1Ph |
13 |
Me |
H |
СО2Ме |
c |
– |
*Для соединений 3–8e R5 = H; а: 6 R4 = CH2СО2Ме, b: 8g R2 = СО2Ме, c: 13 R4 = СО2Ме
Образование пиразолина 4а (77%) было зафиксировано и в условиях проведения реакции в присутствии катализатора (Pd) [16].
На примере взаимодействия алкильных [13] и арильных [17, 18] производных фумаровой кислоты с фенил- и дифенилдиазометаном, показано образование син- и анти-изомеров пиразолинов 8а–g. В работах [14, 19] была выявлена зависимость скорости реакции присоединения ДС от степени замещения кратной связи в ряду производных акриловой кислоты. На основе изучения кинетики было установлено, что эфиры акриловой кислоты 1, как диполярофилы, в реакциях циклоприсоединения значительно более активны (на 3–4 порядка), чем соответствующие алкил- и фенилзамещенные алкены. Также было показано, что транс-изомеры акриловой кислоты проявляют повышенную реакционную способность по сравнению с цис- изомерами [14].
8 |
Серия монографий InterBioScreen |

Особенности влияния заместителей (алкильных, арильных, карбонильных и др.) на реакционную способность ДС (в качестве диполей) и С=С двойной связи в реакциях 1,3-диполярного циклоприсоединения были исследованы в работе [20].
Данные по изучению механизма этих реакций [21–25] позволяют предполагать, что циклизация осуществляется через промежуточный цвиттер-ион и приводит, в зависимости от природы заместителей в молекулах алкена 1 и ДС 2, к образованию изомерных ∆-1 или ∆-2 пиразолинов 9–11 и 12, 13, соответственно.
Cхема 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R2 |
|
|
|
R3 |
|
R3 OMe |
|
|
|
N |
|
|
|
|
|
|
|
|
|
MeO2C |
|
|
|
|
R4 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N R5 |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
N+ |
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
R2 |
|
|
|
|
|
O |
R4 |
|
|
|
|
R5 |
|
|
|
R2 |
|
R3 |
R1 = H |
|
|
|
H |
∆-2 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
1 |
|
|
R1 |
|
|
|
|
|
|
|
|
|
|
|
12 |
||||||||||||
|
|
|
|
|
R2 |
|
|
|
|
R3 |
|
|
|
|
|
|
|||||||||||
|
+ |
|
|
|
|
|
|
|
|
|
R1 |
|
|
|
R4 |
|
|
|
|
|
|||||||
|
|
|
|
|
|
− |
|
|
|
|
|
|
|
|
|
|
|||||||||||
R5 |
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
||||||||
|
− |
R1 |
|
|
|
MeO2C |
|
|
|
R5 |
|
|
|
|
|
||||||||||||
|
+ |
|
|
|
|
|
|
|
N |
|
N |
|
|
|
|
|
|||||||||||
|
|
|
|
N |
|
N |
|
|
|
|
OMe |
|
|
|
|
R5 = H |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
R4 |
2 |
|
|
|
|
|
|
|
|
|
|
∆-1 |
R2 |
|
|
|
R3 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9−11 |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R1 |
|
|
|
|
R4 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
MeO2C N |
|
N |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
13 |
∆-2 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Присоединение диазометана к производным акриловой кислоты, таким как N-ацетиламиноакрилаты (СН2С12, 0°С) протекает также эффективно, позволяя получать соответствующие аминокислоты пиразолинового ряда 14а [26].
С использованием различных диазосоединений и ненасыщенных аминокислот (дегидроаланина, дегидрофенилаланина, дегидроглутаминовой кислоты) был получен ряд аналогичных N-замещенных пиразолинов 14, 16, 17, 19–21 (табл. 2) [27–43], которые впоследствии, как и пиразолины 11а–c, были с успехом использованы для синтеза соответствующих аминокислот циклопропанового ряда.
Интересно отметить, что замена растворителя СН2С12 на более полярный СНС13 позволяет в этой реакции наряду с ∆-1 пиразолином 14а получить эфир циклопропанкарбоновой аминокислоты 15 [32] (cхема 3), а использование алкилдиазоацетатов [33] вместо диазоалканов приводит к увеличению выхода циклопропановых производных 18a, b до 70%.
Избранные методы синтеза и модификации гетероциклов, том 1 |
9 |
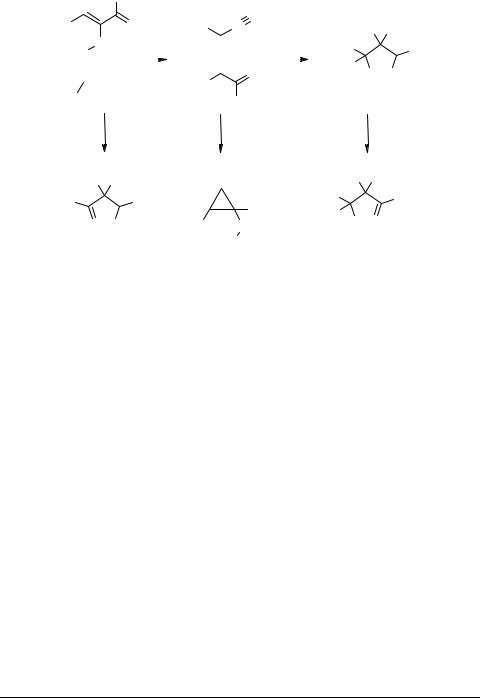
Схема 3
R3 |
|
|
|
OMe |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
+N N |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
R2 |
|
|
|
|
|
|
O |
|
R4 |
|
|
|
|
|
|
R2 R3 |
||||||||||||||
R1 |
NH |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
a |
|
MeO2C |
|
|
|
R4 |
|||||||||
+ |
|
|
|
|
R2 |
|
|
R3 |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
HN |
|
|
|
|
|
||||||||||||||
|
|
+ |
|
|
− |
|
|
|
|
|
|
|
|
− O |
|
|
|
|
|
|
N |
|
N |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
N |
|
N |
|
HN |
|
|
|
|
|
|
|
|
|
|
|
R1 |
|
∆−1 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
R4 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
R1 |
|
OMe |
|
|
|
|
|
|
|
14, 16 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
b |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
−N2 |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
H |
|
|
|
|
|
|
|
R4 |
|
|
|
|
|
R2 |
|
R3 |
|||||||||
MeO2C N |
|
R1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
R2 |
|
|
|
|
|
|
R4 |
R3 |
|
|
|
|
|
|
|
CO2Me |
MeO2C |
|
|
|
|
R4 |
||||||||
|
N |
|
N |
|
|
|
|
|
HN |
N |
|
N |
||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
R2 |
|
|
NH |
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
R1 |
|
|||||||||||||||||||||
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
R1 |
|
|
|
H |
|
|
|
|
||||||||
|
∆−2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
21 |
|
|
|
|
15, 18a, 18b |
|
|
|
17a, 17b, 19, 20 |
|||||||||||||||||||
15 R1 = Ac, R2 = R3 = R4 = H
18a R2 = R4 = H, R3 = CO2Me
18b R3 = R4 = H, R2 = CO2Me
Таблица 2. Синтез аминопроизводных пиразолинкарбоновых кислот 14, 16, 17,
19–22 [26–43]
|
R1 |
R2 |
R3 |
R4 |
В |
|
R1 |
R2 |
R3 |
R4 |
В |
|
|
|
|
|
|
|
|
|
|
|
|
14а |
Ас |
Н |
Н |
Н |
90 |
19d |
Ac |
n-MePh |
H |
H |
98 |
14b |
Вос |
Н |
Н |
Н |
89 |
19e |
Ac |
n-C1Ph |
H |
H |
96 |
14c |
Вос |
Н |
Н |
Ме |
96 |
19f |
Ac |
n-NO2Ph |
H |
H |
99 |
14d |
Вос |
Н |
Н |
Et |
59 |
20a |
OCPh |
Ph |
H |
H |
98 |
14e |
Вос |
Н |
Н |
iPr |
98 |
20b |
OCPh |
H |
Ph |
H |
98 |
14f |
Вос |
Н |
Н |
Ph |
92 |
20c |
OCPh |
n-MeOPh |
H |
H |
86 |
16 |
Bz |
Н |
* |
Н |
90 |
20d |
OCPh |
n-MePh |
H |
H |
80 |
17a |
Ac |
H |
H |
CO2Me |
90 |
20e |
OCPh |
n-C1Ph |
H |
H |
85 |
17b |
Ac |
H |
H |
CO2Et |
90 |
20f |
OCPh |
n-NO2Ph |
H |
H |
85 |
19a |
Ac |
Ph |
H |
H |
98 |
20g |
OCPh |
H |
Ph |
H |
90 |
19b |
Ac |
H |
Ph |
H |
98 |
21a |
Ac |
Ph |
H |
CO2Me |
50 |
19с |
Ас |
* |
H |
H |
99 |
21b |
Ac |
Ph |
H |
CO2Et |
50 |
В – выход, %
*Для соединений 16 R3 = CH2CO2Me, 19с R2 = n-MeOPh
10 |
Серия монографий InterBioScreen |
