
Карцев В.Г. - Избранные методы синтеза и модификации гетероциклов. Том 2 (2003)(ru)
.pdf
Сравнительное изучение способности различных каталитических систем циклокарбонилировать ациклические и циклические спирты показало, что лучшей из них является раствор PdCl2, безводного SnCl2 и 2 экв. третичного фосфина в ацетонитриле. При этом можно получить с достаточно высоким выходом не только α-метиленовые γ-лактоны, но и δ-лактоны разнообразного строения как с цис-, так и транс-сочленением колец, если поддерживать низкую концентрацию субстрата (0.1–1 М), чтобы направить реакцию в сторону внутримолекулярной циклизации. Изучение механизма циклокарбонилирования показывает, что сначала из Pd(II), CO и ацетиленового спирта образуется алкинилоксикарбонилпалладиевая частица, а затем происходит внутримолекулярное цис-присоединение с участием связей Pd−C и C≡C. Может происходить и конкурентное межмолекулярное присоединение по тройной связи другого субстрата, что приводит к образованию димерных и далее полимерных продуктов [25, 26] (схема 15).
|
|
|
|
|
|
Схема 15 |
Pd(II) |
+ |
CO + |
|
OH |
O |
+ H+ |
|
|
|
|
OPd |
||
|
|
|
|
|
||
|
|
|
|
Pd(II) |
|
|
|
|
|
|
O |
H+ |
|
O |
|
|
|
O + Pd(II) |
||
|
|
O |
O |
|
||
Pd |
O |
|
|
|||
|
|
|
|
|
||
|
|
|
|
|
O |
|
|
|
|
OH |
Pd |
O |
полимерные |
|
|
|
|
|
||
продукты
OH
Расщепление винил-палладиевой связи протоном, генерированным вместе с активной карбоксилирующей частицей, приводит к образованию целевого продукта и одновременно регенерирует исходный комплекс Pd(II). В процессе изучения механизма была открыта [26] более эффективная каталитическая система с участием в качестве сокатализатора SnCl2, который делает более лабильной координационную сферу палладия. Если при использовании каталитической системы PdI2/Bu3P/MeCN стадией, определяющей скорость реакции, был захват СО палладием, то в случае второй каталитической системы (PdCl2/2Ph3P/SnCl2/MeCN) скорость реакции определяет стадия (константа скорости k) координации субстрата, за которой следует быстрый захват СО и завершение реакции циклокарбонилирования (схема 16).
Избранные методы синтеза и модификации гетероциклов, том 2 |
71 |

Схема 16
|
|
[PdL2(SnCl3)]+Cl− + |
RC≡CCH2CH2OH |
|
|
k |
||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||
CO |
||||||||||||||||||
|
|
|
|
|
|
|
+ − |
|
|
|||||||||
|
|
[L2Pd(SnCl3)(RC≡CCH2CH2OH)] Cl |
|
|
|
|
|
|
|
|
|
|||||||
|
|
быстро |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
+ |
|
|
− |
||||||||||
|
|
[L2Pd(SnCl3)(RC≡CCH2CH2OH)(CO)] |
Cl |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|||||||||||||
|
|
[L2Pd(SnCl3)(RC≡CCH2CH2OC(O)] + |
HCl |
|
|
|||||||||||||
|
|
|
||||||||||||||||
L2(Cl3Sn)Pd |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
O |
HCl |
O |
|
+ [PdL2(SnCl3)]+Cl− |
||||||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
O |
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
L = PPh3
При катализе комплексами переходных металлов, например, PdCl2(PPh3)2 из диметил(этинил)карбинола, СО и арилгалогенидов в атмосфере СО2 образуются 3(2Н)-фураноны 34. Механизм реакции включает промежуточное образование ацетиленового кетона, который дает с CO2 циклический карбонат, а последний количественно декарбоксилируется в фуранон 34 [27] (схема 17).
|
|
Схема 17 |
|
OH + CO + PhHal |
кат. |
O |
|
OH |
|||
|
CO2, |
R |
|
|
Et3N |
||
|
|
||
O |
|
|
|
R |
|
O |
|
O |
−CO2 |
|
|
O |
O |
||
|
|||
O |
|
R 34 |
R = Ph, 4-MeC6H4, 4-ClC6H4, (E)-PhCH=CH, 1-нафтил
Катализируемое родием карбонилирование ацетиленов в спиртах приводит к 5-алкоксифуран-2(5Н)-онам [28, 29]. Позднее предложен общий метод синтеза фуран-2(5Н)-онов 35 и 36 из ацетиленов, состоящий в обработке последних при 100°С в присутствии родиевого кластерного катализатора водяным паром и окисью углерода под давлением 100 атм в ТГФ, содержащем триэтиламин [30]
72 |
Серия научных монографий InterBioScreen |

(схема 18). Соотношение изомерных фуранонов 35 и 36 определяется электронной и стерической природой заместителей.
Схема 18
|
|
|
|
|
|
|
O |
|
|
O |
||||
|
|
|
|
|
H2O, CO |
|
|
|
|
|
|
|
|
|
R |
|
|
|
R' |
R' |
O + |
O |
|
|
R |
||||
|
|
|
|
|
|
|||||||||
|
|
|
Rh кат., |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ТГФ, Et3N |
R |
|
|
|
|
R' |
|||
|
|
|
|
|
|
35 |
|
|
36 |
|||||
Родиевые карбонильные кластеры, такие как Rh4(CO)12 и Rh6(CO)16, оказались лучшими катализаторами из исследованных комплексов переходных металлов. Рутениевые карбонилы показывают низкую активность, а кобальтовые и железные совершенно неактивны в этой реакции. Для селективного синтеза фуранонов существенным оказалось присутствие аминов, таких как триэтиламин и диэтиламин. В отсутствие аминов наблюдалось значительное снижение как каталитической активности кластеров, так и селективности образования фуранонов.
Автор выражает искреннюю благодарность профессору Ержанову К.Б. за руководство при подготовке этого обзора.
Литература
1.Нефёдов Б.К., Синтезы органических соединений на основе окиси углерода,
М.: Наука, 1978.
2.Ян Ю.Б., Нефёдов Б.К., Синтезы на основе оксидов углерода, М.: Химия, 1987.
3.Falbe J., New Synthesis with Carbon Monoxide, Berlin: Springer, 1980.
4.Гулевич Ю.В., Бумагин Н.А., Белецкая И.П., Успехи химии 1988 57 (9) 529.
5.Лапидус А.Л., Пирожков С.Д., Успехи химии 1989 58 (2) 197.
6.Ojima I., Chem. Rev. 1988 88 1011.
7.Chiusoli G.P., Costa M., Masarati E., Salerno G., J. Org. Chem. 1983 55 35.
8.Chiusoli G.P., Costa M., Pergreffi P., et al., Gazz. Chim. Ital. 1985 115 691.
9.Chiusoli G.P., Costa M., Reverberi S., Synthesis 1989 (4) 262.
10.Chiusoli G.P., Costa M., Gerbella M., Salerno G.J., Gazz. Chim. Ital. 1985 115 697.
11.Chiusoli G.P., Costa M., Reverberi S., Salerno G.J., Gazz. Chim. Ital. 1987 117 695.
12.Chiusoli G.P., Pallini L., Terenghi M.G., Transition Met. Chem. 1983 8 189.
13.Абдулганиева С.А., Манчук З.Н., Жапарова З.М., Ержанов К.Б., ЖОрХ 1992
28 (1) 175.
14.Vizer S.A., Yerzhanov K.B., Manchuk Z.N., Wieser A.G., Eurasian Chem. Tech. J. 1999 1 (1) 1.
15.Oppolzer W., Bedoya-Zurita M., Switzer C.Y., Tetrahedron Lett. 1988 29 6433.
Избранные методы синтеза и модификации гетероциклов, том 2 |
73 |

16.Oppolzer W., Keller T.H., Bedoya-Zurita M., Stone C., Tetrahedron Lett. 1989 30 (43) 5883.
17.Kondo Y., Sakamoto T., Yamanaka M., Heterocycles 1989 29 (6) 1013.
18.Kondo Y., Shiga F., Murata N., et al., Tetrahedron 1994 50 (41) 11803.
19.Bonardi A., Costa M., Gabriele B., et al., Tetrahedron Lett. 1995 36 (41) 7495.
20.Bacchi A., Chiusoli G.P., Costa M., et al., J. Chem. Soc. Chem. Commun. 1997
(13)1209.
21.Kupehan S.M., Eakin M.A., Thomas A.M., J. Med. Chem. 1971 14 1147.
22.Mc Phail A.T., Onan K.D., Lee K.-H., et al., Tetrahedron Lett. 1974 2739.
23.Jones E.R.H., Shen T.Y., Whiting M.C., J. Chem. Soc. 1950 230.
24.Norton J.R., Shenton K.E., Schwartz J., Tetrahedron Lett. 1975 51.
25.Murray T.F., Samsel E.G., Varma V., Norton J.R., J. Am. Chem. Soc. 1981 103
(25)7520.
26.Murray T.F., Norton J.R., J. Am. Chem. Soc. 1979 101 4107.
27.Inoue Y., Ohuchi K., Yen I.F., Imaizumi S., Bull. Chem. Soc. Jpn. 1989 62
(11)3518.
28.Hong P., Mice T., Yamazaki H., Chem. Lett. 1981 989.
29.Mice T., Hong P., Yamazaki H., Chem. Lett. 1981 993.
30.Doyama K., Joh T., Onitzuka K., et al., J. Chem. Soc. Chem. Commun. 1987 649.
74 |
Серия научных монографий InterBioScreen |

Синтез гетероциклов каталитической внутримолекулярной циклизацией ацетиленовых соединений
Визер С.А., Ержанов К.Б.
Институт химических наук им. А.Б. Бектурова Министерства образования и науки Республики Казахстан 480100, Казахстан, Алматы, ул. Ш. Валиханова, 106
Введение
Реакциям внутримолекулярной циклизации ацетиленовых соединений, приводящим к гетероциклам разнообразного строения, посвящены обзоры [1–4], а также некоторые разделы книг [5, 6]. Здесь мы делаем попытку показать роль каталитических методов внутримолекулярной циклизации ацетиленовых соединений в создании моно- и полигетероциклических соединений по данным, опубликованным за последние 30 лет, а также по работам, которые не нашли отражения в упомянутых выше обзорах.
Стерически напряженные пирролины 1 и пирролидины 2 получены восстановительной циклизацией диацетиленовых или ацетиленовых аминов над металлами и солями металлов VIII группы при давлении водорода 4 атм. Из тетраацетиленовых диаминов аналогично получены дипирролы 3 [7] (схема 1).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Схема 1 |
||
R7 |
|
|
R1 |
|
|
R2 |
Pd/C, H2 |
|
R7 |
|
R1 |
R2 |
Pt или Ni, H2 |
|
R7 |
R1 |
|
|
R2 |
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
N |
|
|
N |
N |
||||||||||||||||||||||||||||||||||||||||||
R6 |
|
|
|
|
|
|
R3 |
|
|
|
R6 |
|
|
|
|
|
|
|
|
|
|
R3 |
|
|
|
|
|
|
|
R6 |
|
|
|
|
|
|
|
|
|
R3 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HClO4 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
A |
|
|
|
R5 |
|
|
|
|
|
|
|
|
|
|
|
R4 |
|
|
|
R5 |
|
|
|
|
|
|
|
|
|
|
|
R4 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
R5 |
R4 |
|
|
|
|
|
|
|
|
|
|
|
R4 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R4 |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
R3 |
|
2 |
2 |
R3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
R3 |
2 |
|
|
2 R3 |
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
4 |
|
|
|
|
|
R |
|
R |
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
R |
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
R |
|
|
|
|
|
|
N |
|
|
( )n N |
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
( )n |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
R5 |
|
|
|
|
|
|
|
|
|
|
|
|
R5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
R6 R7 |
|
R7 |
R6 |
|
|
|
|
|
|
|
|
|
|
|
|
R6 R7 |
R7 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R5 |
R6 |
|
|
R5 |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A = двойная или тройная связь |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
R1 = H, Alk, AlkO, AlkNR, галогеналкил; R2, R3, R6, R7 = H, Alk; |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
R2 +R3 = (CH ) |
; R6+R7 = (CH ) |
; R4, R5 |
= H, Alk |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
2 n |
|
|
|
2 n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Избранные методы синтеза и модификации гетероциклов, том 2 |
|
|
|
|
|
|
75 |
|||||||||||||||||||||||||||||||||||||||||

При катализе комплексами никеля тетразамещенные дипропаргиламины циклизуются до дипирролидиноциклооктатетраена 4 [8] (схема 2).
Схема 2
R |
R |
|
R |
R |
R |
|
NiL4 |
R |
|
||
R |
NH |
HN |
|
NH |
|
|
|
||||
|
|
|
|||
R |
|
|
R |
R R |
|
|
|
|
R |
||
|
|
|
|
4 (68%) |
|
В присутствии второго ацетиленового соединения и комплексов никеля дипропаргиламины образуют с высокими выходами замещенные изоиндолы 5 [9] (схема 3).
Схема 3
|
R' |
|
|
R |
R' |
R |
|
|
|
||
|
|
NiL4 |
R'' |
|
|
R |
|
+ R'' |
|
NH |
|
NH |
R''' |
|
|||
R' |
|
|
ТГФ или |
R''' |
R' |
|
|
MeCN |
|||
|
|
|
|
5 R |
R = R' = Me; R+R' = (CH2)5; R'' = CMe2NH2, CMe2OH, Ph; R''' = H, Ph;
L= PhP(OPr-i)2, P(OPr-i)3, P(OPh)3
Врезультате тандемного каталитического процесса (циклизации и захвата аниона) N-алкинил-о-иоданилины 6a–d превращаются в производные индола 7a–c,
8, а N-алкиниламиды о-иодбензойной кислоты 9a–c − в изохинолиноны 10a, b; 11. Реакция регио- и стереоспецифична. Индол 8 и изохинолинон 11 образуются в результате отщепления пиперидина от соединений 6d и 9c [10] (схема 4).
Схема 4
R"
|
|
i |
R |
|
|
|
|
|
|
|
|
R |
|
I |
|
N |
|
|
|
N R' |
|
|
R' |
|
|
|
7a−c (40−60%) |
||
|
|
ii |
|
|
|
|
6a−d |
R" |
|
|
|
|
при R = H, R' = Ac, |
N |
|||
|
|
||||
|
|
R" = CH2N |
|
8 (30%) |
Ac |
|
|
|
|
|
|
a R = R" = H, R' = Ac; b R = CO2Et, R' = Ac, R" = H;
c R = H, R' = Ac, R" = Me; d R = H, R' = Ac, R" = CH2N
76 |
Серия научных монографий InterBioScreen |
|
|
|
|
|
|
|
|
R' |
|
|
|
|
i |
|
|||
I |
|
|
|
|
|
|
N R |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
O |
|
|
|
10a, b O |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R N |
|
|
|
|
|
|
|
|
9a−c |
R' |
ii |
|
|||||
|
|
|
||||||
|
|
|
|
при R = Me, R' = CH2N |
|
|
N R |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
11 (33%)O |
|
||
a R = Me, R' = H; b R = Bn, R' = Me; c R = Me, R' = CH2N |
|
|||||||
i - 10 мол.% Pd(OAc)2, 20 мол.% PPh3, MeCN, 4 моля HN |
, |
|||||||
3 моля HCO2H, 60°, 12 ч; |
|
|||||||
ii - 10 мол.% Pd(OAc)2, 20 мол.% PPh3, 1 моль HCO2H, 60°, 12 ч
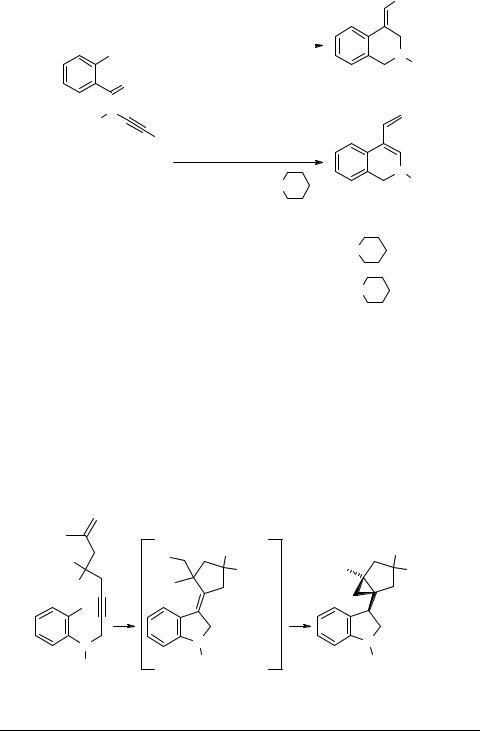
Катализируемая Pd(OAc)2 циклизация о-иодалкиниланилинов 12 и 15 приводит к образованию три- и тетрациклических производных индола 14, 16, 17. В первом случае циклизация промежуточного комплекса 13, по-видимому, энергетически выгоднее, чем анионный обмен и восстановительное отщепление. При выделении соединения 16 с помощью ТСХ происходит самопроизвольная изомеризация двойных связей, в результате чего образуется индол 17 [11] (схема 5).
|
|
|
|
Схема 5 |
MeO2C |
XPd |
CO2Me |
|
CO2Me |
CO2Me |
|
CO2Me |
||
MeO2C |
|
|
||
|
|
|
|
|
I |
i |
|
|
|
|
|
|
|
|
N |
|
N |
N |
|
Ac |
|
Ac |
Ac |
|
12 |
|
13 |
14 (40−65%) |
|
Избранные методы синтеза и модификации гетероциклов, том 2 |
77 |
|||

MeO2C |
|
CO2Me |
CO2Me |
|
CO2Me |
CO2Me |
|
MeO2C |
|
||
|
|
|
|
I |
ii |
|
|
|
|
|
|
N |
N |
ТСХ |
N |
|
|||
Ac |
Ac |
|
Ac |
15 |
16 (26%) |
|
17 (6%) |
i- 10 мол.% Pd(OAc)2, 20 мол.% PPh3, 1 моль Et4NCl, 1.2 моль Bu3SnCH=CH2, MeCN, 25°C, 2 ч, (или HCO2Na, ДМФА, 70°C, 1ч);
ii- 10 мол.% Pd(OAc)2, 20 мол.% PPh3, 1 моль Et4NCl, MeCN, 70°C, 1ч
Производные α-алкилиден-γ-бутиролактама 18a–c синтезированы циклизацией N-аллилалкиниламидов при катализе солями палладия и расщеплении связей C−Pd тремя путями для регенерации Pd(II) катализатора: элиминированием β-гете- роатома, окислительным расщеплением и протолизом [12] (схема 6).
Схема 6
|
R' |
|
X |
R' |
X |
R' |
|
|
|
|
|
|
|||
O |
PdX2 |
O |
|
PdX |
|
PdX |
|
|
O |
|
|
||||
|
|
|
|
|
|||
|
R" |
|
N |
|
R" |
||
R N |
R |
R" |
N |
|
|||
|
|
|
|||||
|
|
|
|
|
R |
|
|
|
β, γ - элиминирование |
окислительное |
протолиз |
|
|||
|
R" = CH2Y |
|
|
расщепление |
R" = CHO |
|
|
|
|
|
|
R" = H, Alk, Ar |
|
|
|
X |
R' |
|
|
X R' |
X |
R' |
|
O |
|
|
O |
X |
O |
|
H |
N |
|
|
N |
||||
|
|
|
|||||
|
|
N |
O |
||||
R |
|
|
|
R |
R |
|
|
|
|
|
|
|
|||
|
18a |
|
|
18b |
|
18c |
|
С использованием этой методологии осуществлен полный синтез природных соединений (±)-изоцианометрина и (±)-изоанантина [12].
78 |
Серия научных монографий InterBioScreen |

HO |
Ph |
|
Ph |
|
O |
O |
|||
N |
N |
|||
|
|
|||
N |
N |
N |
N |
|
|
|
|
H |
|
(±)-изоцианометрин |
(±)-изоанантин |
|||
Аллилпропаргиловые эфиры циклизуются до 3-винил-2,5-дигидрофуранов 19 при катализе рутениевым комплексом А. При этом первоначальное фотооблучение реакционной смеси эффективно повышает каталитическую способность А [13] (схема 7).
Схема 7
R |
|
R |
|
2.5 мол.% кат. A |
|
||
|
O |
||
O |
толуол, 80°C |
||
|
|||
|
|
19 |
|
|
|
R = Ph (77%); |
|
|
+ |
R = CH2CHMe2 (65%) |
|
Cl |
Ph PF6− |
|
Ru
CyR Ph
Ph
A (Cy = циклогексил)
Позднее метатезис при участии катализаторов типа А был использован для синтеза не только кислород-, но и азотсодержащих гетероциклов 20, 21 [14].
|
O |
F3C CO2Me |
|
PG N |
|
|
|
|
20 |
|
21 |
Широкий круг бициклических β-лактамов 22a–c получен циклизацией моноциклических β-лактамов с ацетиленовыми и алкеновыми заместителями в условиях метатезиса, катализируемого комплексом транс-(Cy3P)2Cl2Ru=CHPh [15] (схема 8).
Избранные методы синтеза и модификации гетероциклов, том 2 |
79 |

O |
X |
N |
( )n |
X = CH2, n = 0, 1; X = O, n = 1;
X = NTs, n = 1
Схема 8
10 мол.% кат. |
|
|
|
X ( ) |
n |
|
|
|
|
||
|
|
|
|
|
|
CH2Cl2 |
|
|
N |
|
|
|
|
|
|||
|
O |
|
|||
|
22a (70−100%) |
||||
|
OSiMe2Bu- t |
OSiMe2Bu-t |
|
O |
10 мол.% кат. |
|
|
CH2Cl2 |
N |
|
|
N |
|
||
|
|
O |
|
|
|
R |
|
|
R |
22b (72−100%) |
|
|
|
|
|
R = Me, CH2OSiMe2Bu-t |
|
|
|
|
R |
O |
R |
|
10 мол.% кат. |
||
O |
|
||
O |
N |
|
|
N |
CH2Cl2 |
|
|
|
|
O |
|
|
|
22c (74−82%) |
|
R= H, OSiMe2Bu-t
Спомощью метатезиса эфиров ацетиленовых аминокислот при катализе комплексными Pd-катализаторами получены производные пиперидинкарбоновых кис-
лот 23a, b [16] (схема 9).
Схема 9
|
Pd(OAc)2/PPh3 |
R |
R |
N CO2Me толуол, 70°C |
N CO2Me |
|
Ts |
|
|
Ts |
|
|
|
|
|
R = H, Ph |
23a (60%) |
80 |
Серия научных монографий InterBioScreen |
