
Карцев В.Г. - Избранные методы синтеза и модификации гетероциклов. Том 2 (2003)(ru)
.pdf
|
Pd2(dba)3/PPh3 |
|
N CO2Me |
AcOH, EtSiH |
N CO2Me |
Ts |
толуол, 100°C |
|
|
|
Ts |
|
|
23b (50%) |
Соли палладия эффективно катализируют внутримолекулярное присоединение гидроксильной и аминной групп по тройной углерод-углеродной связи ацетиленовых спиртов и аминов. Например, 3-децин-1-ол 24 в безводных условиях (A) циклизуется, давая преимущественно дигидрофуран 25, тогда как в присутствии воды (B) образуется исключительно гидроксикетон 26, являющийся продуктом гидролиза дигидрофурана 25 [17] (схема 10).
Схема 10
HO |
|
|
A или B |
( )5 |
O |
||||
|
( )5 |
|
O |
+ HO ( )3 |
|
( )5 |
|||
|
|
|
|
|
|||||
|
|
|
|||||||
|
24 |
|
|
25 |
|
26 |
|||
|
|
|
|
A: 60% |
30% |
||||
|
|
|
|
B: |
− |
>95% |
|||
A- PdCl2(PhCN)2 (0.01−0.03 экв.), безв. Et2O, комн. т-ра, 5−10 ч;
B- PdCl2 (0.01−0.05 экв), водн. MeCN, кипячение 30 мин
Эта реакция применима для синтеза дигидрофурана 27, являющегося промежуточным продуктом в синтезе антибиотика фурахиноцина D [18] (схема 11).
Схема 11
HO |
OTBS |
|
|
|
O |
O |
O |
||
|
||||
|
PdCl2(PhCN)2 |
|
|
|
O |
MeCN, 60°C |
O |
|
|
|
|
|||
O O O |
|
O O |
O |
|
|
|
27 (91%) |
||
5-Ундецин-1-ол 28 циклизуется в дигидропиран 29 и дает продукт его гидролиза − гидроксикетон 30 − в условиях А и B (как выше) [17] (схема 12).
Избранные методы синтеза и модификации гетероциклов, том 2 |
81 |

Схема 12
HO |
|
|
|
A или B |
|
O |
|||
|
|
|
|
+ HO ( )4 |
|
|
|||
( |
)4 |
|
|
( |
)4 |
|
|
( )5 |
|
|
|
|
|||||||
|
|
( )5 |
O |
|
|
|
|||
|
|
28 |
|
|
29 |
30 |
|||
|
|
|
|
|
A: 50% |
45% |
|||
|
|
|
|
|
B: |
− |
>95% |
||
В противоположность спиртам 24 и 28, 4-ундецин-1-ол 31 преимущественно претерпевает 6-эндо-циклизацию в условиях реакции А, тогда как в условиях В 5-экзо-циклизация с последующим гидролизом приводит к образованию 1-гидро- кси-4-ундеканона 32 (схема 13).
Схема 13
HO |
|
|
A или B |
|
|
O |
|||
|
|
29 |
+ 30 + |
HO ( )3 |
|
|
|||
( |
)3 |
|
( |
)5 |
|
( )6 |
|||
|
|||||||||
|
|
31 |
|
|
|
|
32 |
||
|
|
|
A: 50% |
45% |
− |
||||
|
|
|
|
||||||
|
|
|
|
B: |
− |
− |
>95% |
||
Внутримолекулярным присоединением гидроксильных групп к тройной связи из ацетиленовых гликолей можно получить бициклические ацетали 33, 34 и спироацетали 35, 36, многие из которых являются феромонами жуков-короедов
[17] (схема 14).
Схема 14
|
|
|
|
|
HO |
|
R" |
|
R |
|
R |
||
|
|
|
HO |
|
OO ( )n+1 |
или |
OO ( )n |
||||||
|
|
|
R' |
||||||||||
|
|
|
|
||||||||||
R |
|
|
( |
)n |
|
R" |
R' |
|
R" |
||||
|
|
|
|
||||||||||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
R' |
||
|
|
|
|
|
|
|
|
|
|
33 |
|
|
34 |
HO |
|
|
|
|
OH |
A или B O ( )n+1 |
+ |
O ( )n |
|||||
( |
)n |
|
|
|
( |
)m |
|
O |
( ) |
m |
O ( ) +1 |
||
|
|
|
|
||||||||||
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
m |
|
|
|
|
|
|
|
|
|
|
|
35 |
|
|
36 |
|
|
|
|
|
|
|
|
|
A: |
− |
|
|
90% (m = 2, n = 3) |
|
|
|
|
|
|
|
|
|
B: |
− |
|
|
95% (m = 2, n = 3) |
|
|
|
|
|
|
|
|
|
B: |
60% (m = 3, n = 4) |
|
||
A- PdCl2(PhCN)2 (0.01 экв.) в эфире, ~20°С, 5ч;
B- PdCl2 (0.01 экв.) в водн. MeCN, кипячение 1ч
82 |
Серия научных монографий InterBioScreen |

Направление присоединения гидроксильной группы к тройной углерод-угле- родной связи циклических спиртов 37 и 39 зависит от геометрии спирта: в случае цис-спирта образуется продукт с пятичленным циклом 38, а из транс-изомера − с шестичленным циклом 40 [17] (схема 15).
Схема 15
R |
|
|
OH |
A |
R |
|
||
|
|
O |
37 |
|
38 (90%) |
R
OH |
A |
|
O R |
39 |
40 (47%) |
R = n-Bu
При катализе солями ртути − HgCl2, Hg(OAc)2, Hg(OCOCF3)2 − цис-спирт 37 образует экзоеновый тетрагидрофуран 41, а транс-спирт 39 дает дигидропиран 40, но с меньшим выходом. Если ртутьорганический интермедиат захватывается N-галогенсукцинимидом (NXS), то образуются β-галогензамещенные производные тетрагидрофурана 42 и дигидропирана 43 [19] (схема 16).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Схема 16 |
O |
R |
Hg(II) |
|
37 |
|
Hg(II) |
|
|
O |
|||||
|
|
|
|
|
|
|
||||||||
|
|
Et3N |
|
|
|
|
NXS, DMAP |
X |
||||||
|
|
|
|
|
|
|
|
|||||||
|
|
CH |
Cl |
|
|
|
|
|
|
CH2Cl2 |
|
|
||
|
|
2 |
|
|
|
|
|
|
|
|||||
|
|
2 |
|
|
|
|
|
|
|
|
|
|
||
41 |
|
|
|
|
|
|
|
|
|
|
|
|
42 (87−93%) |
|
R = H, n-Bu |
|
|
|
|
|
|
|
|
|
|
|
|
X = Br, I, Cl |
|
|
|
Hg(II) |
|
|
|
|
|
(CF3CO2)2Hg |
|
O |
R |
|||
40 |
|
|
|
|
37 |
|
LiI, NXS |
|
||||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Et N |
|
|
|
|
Et3N |
|
|
|
|
X |
|||
|
|
|
|
|
|
|
|
|
|
|
||||
(86%) |
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
43 (79−82%) |
||
|
|
|
|
|
|
|
|
|
|
|
|
X = Br, I, Cl |
|
|
|
|
|
|
|
|
|
|
|||||||
Избранные методы синтеза и модификации гетероциклов, том 2 |
83 |
|||||||||||||

При катализе Pd(OAc)2 или PdCl2 может быть осуществлена одновременная циклизация и кросс-сочетание ацетиленовых спиртов 2-HOC6H4CH2C=CH, HO(CH2)3C=CH с органическими галогенидами, такими как PhI, 2-иодтиофен, до α-алкилидентетрагидрофуранов. Например, из пентин-4-ола стереоселективно образуется 2-бензилидентетрагидрофуран 44 [20] (схема 17).
Схема 17
|
BuLi, ТГФ |
Ph |
|
Pd(OAc)2PPh3 |
|
HO |
PhI |
O |
|
||
|
|
44 |
Аминогруппа также может внутримолекулярно присоединяться к ацетиленовой связи при каталитическом действии PdCl2 в кипящем ацетонитриле эндо- и экзо-способом [17] (схема 18).
Схема 18
( )5 |
|
H2N |
|
( )6 |
||||
|
|
N |
|
|
|
|
N |
|
|
|
|
( )n |
( )5 |
n = 3 |
|
||
|
|
|
||||||
|
|
n = 2 |
|
|
|
|
||
|
|
|
|
|
||||
(43%) |
|
|
|
(63%) |
||||
При катализе Pd(0) в зависимости от числа метиленовых групп n также образуются продукты эндо- и экзо-циклизации [21] (схема 19).
Схема 19
|
Pd(0) |
( |
)n |
Pd(0) |
|
N R |
|
HN |
|
|
N R |
K2CO3, ТГФ |
R |
K2CO3, ТГФ |
|||
Ts |
<60°C |
Ts |
|
60°C |
Ts |
(64%) |
n = 1 |
|
|
n = 2 |
(58−87%) |
|
|
|
|
||
R = CO2Me |
|
|
|
|
R = CO2Me, CH2OH, |
|
|
|
|
|
CH2OTBS |
При катализе фосфиновыми комплексами Pd(0) можно осуществить одновременную циклизацию и кросс-сочетание ацетиленовых аминов с арилгалогенидами или трифлатами [22, 23] (схема 20).
84 |
Серия научных монографий InterBioScreen |

Схема 20
|
|
|
|
|
|
|
Pd(PPh3)4 |
|
Ts |
|
|
|||||
|
R' |
O |
|
O N |
|
|
||||||||||
R |
|
K CO , R"X |
|
|
||||||||||||
O |
NHTs |
2 |
3 |
|
|
|
|
R" |
||||||||
|
TBAC, ТГФ |
|
|
|
|
|||||||||||
|
|
O |
|
|
R |
|||||||||||
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
кипячение |
|
|
|
R' |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
(55−81%) |
|||
|
R = R' = H, Me; R = Me, R' = Et; R+R' = (CH2)n, n = 4, 5; |
|||||||||||||||
|
R"X = PhI, p-MeOC6H4I, p-NO2C6H4I, |
|
|
|
|
|
||||||||||
|
|
t-Bu |
|
|
|
|
OTf , |
I |
|
|
|
Cl |
|
|
||
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
Аналогично при последовательном действии на ацетиленовые амины n-BuLi в качестве основания, Pd(OAc)2, PPh3 и 3 экв. органического галогенида в ТГФ получают (2-алкилиден)пирролидины и -пиперидины [24].
При каталитическом действии солей золота происходит внутримолекулярное присоединение амина к тройной углерод-углеродной связи с образованием 2,3,4,5-тетрагидропиранов 45 с количественным выходом. В присутствии 5 мол. % PdCl2(MeCN)2 как катализатора (12 ч кипячения в пропионитриле) выход соединения 45a составляет только 70% [25] (схема 21).
R |
|
|
|
|
|
|
|
|
|
|
|
Схема 21 |
||
Au(III) |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
R' i |
R |
|
|
|
|
|
|
|
|
|
||
( |
)3 |
NH2 |
H2N |
|
|
|
|
|
|
|
|
N R' |
||
|
|
|
N R' |
|
|
|
||||||||
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
R' |
|
R |
H |
|
R |
45a, b |
|||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a R = n-Hex; R' = H; |
|||
i - 5 мол.% AuCl3 2H2O в MeCN при ~ 20°C |
|
|
b R = n-Pent, R' = Me |
|||||||||||
Полизамещенные пирролы 46а–e можно получить из ацетиленовых аминоспиртов и аминов в кипящем ацетонитриле при катализе хлористым палладием
[17, 26] (схема 22).
R |
|
|
R |
|
|
|
|
|
|
Схема 22 |
|
|
|
|
|
|
|
|
|
|
|||
|
|
O |
|
|
|
OH |
PdCl2 |
R |
N |
R" |
|
|
|
+ MeNH2 |
|
|
|
N |
|||||
|
|
|
|
|
MeCN |
|
|
|
|
||
R' |
|
R" |
|
R' |
R" H |
|
|
|
|
||
|
|
|
46a, b R' |
|
|||||||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
a R = n-Hex, R' = H, R" = Me (50%); |
|
||||||
|
|
|
|
b R = Et, R'+R" = (CH2)4 (30%) |
|
|
|
||||
|
|
|
|
|
|
|
|||||
Избранные методы синтеза и модификации гетероциклов, том 2 |
|
|
85 |
||||||||

|
R |
R |
|
|
|
LiAlH4 |
|
NH2 PdCl2 |
H |
R' |
R' |
R N |
||
N |
MeCN |
|
||
|
OR" |
OR" |
|
|
|
|
|
46c−e R'
c R = n-Hex, R' = Et (84%);
d R = n-Hex, R' = t-Bu (84%);
e R = Ph, R' = Et (>90%)
Исследование разных катализаторов в этой реакции показывает, что хлорид палладия дает наилучшие результаты, использование ацетата палладия приводит к снижению выхода пирролов 46с–е. Еще менее эффективны в порядке убывания соли других металлов: H2PtCl3.6H2O, AgOCOCH3, CuCl, RhCl3.H2O, WiCl2, SnCl4 и AlCl3 [26].
Предложенный метод был применен для синтеза пирролофанов 47 [17] (схема 23).
Схема 23
|
O |
N |
|
H2N |
|
OSiMe3 |
|
OH |
|
|
MeSiCN |
LiAlH |
||
|
|
4 |
|
|
(CH2)10 |
|
(CH2)10 |
|
(CH2)10 |
|
|
|
H |
|
PdCl2 N
MeCN
(CH2)10
47 (82%)
Нами найдено [27, 28], что при взаимодействии 2-пропаргил-1,3-дикетонов с хлоридом аммония в водно-спиртовом растворе при катализе свежеприготовленной однохлористой медью, непрерывном барботировании воздуха и нагревании до 50–60°С образуются 2-R-3-ацил-5-метилпирролы 48. Реакция, несомненно, идет через промежуточное образование енаминокетона, который под воздействием однохлористой меди циклизуется до пиррола 48 (схема 24).
Схема 24
R |
|
R |
|
R |
|
O |
|
||
O |
NH4Cl |
O |
|
|
|
|
|||
O |
CuCl, O2 |
R |
R |
N |
|
R'OH/H2O |
|
|
|
R |
NH2 |
|
H |
|
50−60°C |
|
|||
R = Me |
|
|
|
48 (49%) |
|
|
|
|
86 |
Серия научных монографий InterBioScreen |

Аналогично описанному выше синтезу пирролов [17, 26] из β-, γ-ацетилено- вых кетонов или 2-метокси-3-алкин-1-олов можно синтезировать фураны 49a
(схема 25).
Схема 25
R |
|
|
|
|
R' |
|
|
|
|
|
||
|
|
|
|
|
|
R" |
|
|
|
|
R' |
|
|
|
|
O |
|
|
|
i |
|
|
|
||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
R |
|
O |
R" |
||
|
|
|
O |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
49a (60−75% при (1); |
||||
R |
|
|
|
|
|
R' |
|
|
||||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
80−94% при (2), (3)) |
||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
||
HO R"
R"
R = Et, n-Hex; R', R'' = (CH2)4, H, Me;
i- (1) PdCl2 (0.05 экв.) в водн. MeCN, кипячение, 3 ч;
(2)PdCl2 (PhCN)2 (0.05 экв.) в водн. ТГФ, т.комн., 5 ч;
(3)PdCl2 (0.05 экв.) в водн. MeCN, т.комн., 5 ч
2,3,5-Тризамещенные фураны 49b можно получить с хорошими выходами катализируемой палладием реакцией 2-пропаргилзамещенных 1,3-дикарбониль- ных соединений с винилили арилтрифлатами и галогенидами в присутствии поташа [29] (схема 26).
Схема 26
|
R |
O |
|
O |
|
O |
|
|
|
||
O |
|
O |
OMe |
|
|
49b (56% при R = Me) |
|
При катализируемой комплексами Pd(II) циклизации 2-алкинилкарбонатов лития, получаемых взаимодействием соответствующих алкоголятов с диоксидом углерода, происходит регио- и стереоселективное образование циклических этиленкарбонатов 50 [30] (схема 27).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Схема 27 |
|
R |
|
|
|
R |
R |
Pd(II) |
|
R |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
R" |
|
|
|
|
R' |
CO2 |
R" |
|
|
R' |
Pd(II) |
O |
R' |
O |
R' |
|||
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
R" |
|
R" |
|||||||
|
|
|
|
ТГФ |
|
|
|
|
|
|||||||||
|
|
|
OLi |
O |
O |
O |
O |
|
O |
O |
||||||||
|
|
|
|
|
|
|
|
OLi |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
50 (50−74%) |
|||||||
|
|
|
R = H, Me, Et, Bu, n-Hex, Ph, SiMe3; R', R" = H, Me; |
|
|
|
||||||||||||
|
|
|
Pd(II) = PdCl2(MeCN)2, 5 мол. % |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Избранные методы синтеза и модификации гетероциклов, том 2 |
|
87 |
||||||||||||||||

Найден общий метод синтеза 2,3-дигидро-4Н-1,4-оксазин-2-онов 51 и 6-мети- ленморфолин-2-онов 52 путем катализируемой желтой окисью ртути циклизации N-ацил-N-пропиниламинокислот (схема 28). Циклизация протекает при 100°С в толуоле и в других высококипящих растворителях (ДМФА, ГМФА), но не идет в низкокипящих, таких как CHCl3, ацетон, ТГФ. В этих случаях, как и при отсутствии катализатора, возвращается исходная аминокислота. Неацилированные аминокислоты также не дают продуктов циклизации [31].
Схема 28
O |
OH |
O |
R' |
O |
R' |
|
R |
R |
N |
R |
N |
||
HgO |
||||||
N |
толуол, 100°С |
|
|
+ |
|
|
R' |
O |
O |
O |
O |
||
O |
|
51 (27−40%) |
52 (12−36%) |
|||
|
|
|||||
R = i-Bu, Bn, H; R' = Me, Ph
2-Замещенные индолы 53 и бензоиндолы 54 получены с высокими выходами в результате внутримолекулярной циклизации N-бензил-2-алкиниланилинов и нафталинов соответственно под действием CuI при нагревании в ДМФА. Циклизация 2-(триметилсилилэтинил)анилина сопровождается отщеплением триметилсилильной группы [32] (схема 29).
Схема 29
|
R' |
|
|
|
|
|
|
|
R |
|
i |
|
|
R |
|||
|
|
|
|
|
|
|
|
R' |
|
|
|
|
|
|
|
|
|
NH |
|
|
|
|
|
N |
||
R" |
|
|
|
|
|
R" |
||
R' = SiMe3, n-Bu |
|
|
53 |
|
|
|||
|
|
R = R' = H, R" = Bn (73%); |
||||||
|
|
|
||||||
|
|
|
R = F, R' = H, R" = CHMePh (96%); |
|||||
|
|
|
R = H, R' = n-Bu, R" = Bn (95%) |
|||||
|
|
|
|
|
i |
|||
|
|
|
|
|
|
|
|
|
NH |
Bu-n |
Ph |
N |
|
|
Bu-n |
|
Ph |
|
|
|
|
|
54 (84%) |
|
|
|
|
i - CuI (0.5 экв.), CaCO3 (1 экв.), ДМФА, 120°C
Позднее найдено, что катализ хлористым палладием [33] или тетрахлорауратом натрия [34] позволяет снизить температуру до 80°С и даже комнатной и получать в результате аналогичной циклизации 2-замещенные алкилиндолы 55 с высокими выходами [33–36]. Выход индолов 55 при катализе NaAuCl4.2H2O выше
88 |
Серия научных монографий InterBioScreen |

на 5–10%. Механизм реакции несомненно включает нуклеофильную атаку азота на алкиновый комплекс. Расщепление связи Pd−C или Au−C в результате протолиза приводит к образованию индола 55 и регенерации катализатора [34, 35]. Если реакцию проводить в присутствии аллилхлоридов и метилоксирана (в случае R'' = COOMe) при катализе PdCl2(MeCN)2 с хорошими выходами образуются N-карбометокси-2-алкил-3-аллилиндолы 56. Отсутствие оксирана, используемого для улавливания протонов, приводит к снижению выхода аллилированных индо-
лов 56 до 30% [34] (схема 30).
R |
|
|
|
|
Схема 30 |
|
|
|
|
R4 |
|
R1 |
|
R |
4 |
|
R2 |
|
|
|
3 |
||
PdCl2(MeCN)2 |
2 |
|
|
|
|
NH |
R |
R3 |
Cl |
|
R |
R |
|
|
|
R |
|
|
−Pd(II) |
|
|
||
|
|
|
|
N |
|
NH |
(R' = CO2Me) |
56 |
R1 |
||
R1 |
|
ii |
|
|
|
|
|
|
|
||
i |
|
|
|
|
|
PdCl(MeCN)2 |
|
|
|
|
|
R + HCl |
−PdCl2(MeCN)2 |
|
R |
||
N |
|
N |
|||
R1 |
|
|
|
55 |
R1 |
R = n-Bu, t-Bu, CH(Me)С6H13, Ph; R1 = H, Ac, CO2Me;
R2 = H, Me, CH=CH2; R3 = H, Me, Cl; R4 = H, Me, Et;
i- PdCl2 (5 мол.%), кипячение в MeCN или NaAuCl4·2H2O, ТГФ, ~20°С, атмосфера Ar;
ii- PdCl2 (MeCN) (5 мол. %), метилоксиран (10 экв.), хлористый аллил (10 экв.),
ТГФ при кипячении или при ~20°С в атмосфере Ar
Циклизацией 5(6)-замещенных 2-алкиниланилинов при кипячении в ацетонитриле и катализе PdCl2(MeCN)2 с высокими выходами получены индолы 57 [35, 36] (схема 31).
Схема 31
R
|
|
|
PdCl2 |
|
|
|
R |
|
|
R' |
|
|
|
R' |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
NH |
MeCN |
|
N |
|
|||
|
|
|
|
|
|
||||
|
|
R" |
|
|
|
R" |
|
||
|
|
|
|
|
57 (35−87%) |
|
|||
|
|
|
|
|
|
|
|||
R = i-Pr, n-Bu, Ph, (CH2)2OSiMe3, (CH2)4C≡CSiMe3; |
|
||||||||
R' = 6-CO2Me, 6-OMe, 5-Me, 5-Cl, 5-OTf; R'' = H, Ac |
|
||||||||
|
|
|
|
|
|
|
|
||
Избранные методы синтеза и модификации гетероциклов, том 2 |
89 |
||||||||
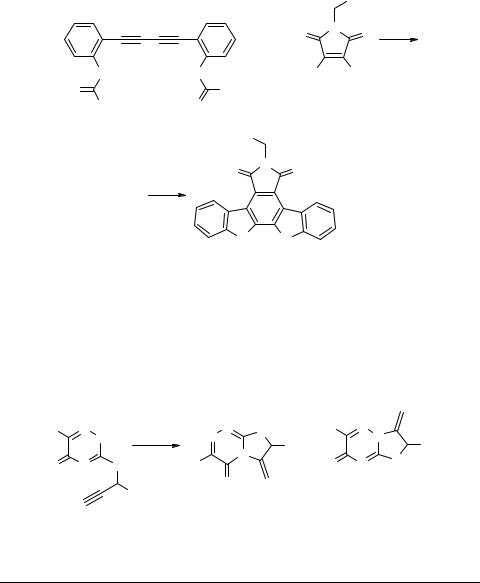
Циклизацию 2-алкиниланилинов до 2-замещенных индолов можно осуществить с хорошими и высокими выходами также в кислотной двухфазной системе CH2Cl2–HCl при комнатной температуре в присутствии Bu4NCl и PdCl2 [37].
Спомощьюаналогичнойреакции производных ди(о-аминофенил)диацетилена можно получить в одну стадию производное индоло[2,3-a]карбазола 58 − полициклической системы, лежащей в основе структуры алкалоидов ребеккамицина и арциафлавина [38] (схема 32).
Схема 32
|
|
|
|
|
Ph |
|
|
+ |
O |
N |
O |
|
|
|
|||
|
|
|
|
|
|
NH |
HN |
|
Br |
|
Br |
O |
CF3 |
|
|
|
|
CF3 |
O |
|
|
|
|
|
Ph |
|
|
|
|
|
O |
N |
O |
|
|
|
|
|
|
N |
N |
H |
H |
|
58 |
При катализируемой комплексами Pd(II) циклизации 3-пропаргилтио-1,2,4- триазин-5(2Н)-онов в кипящем ацетонитриле или диметоксиэтане преимущественно или селективно образуются региоизомеры 59 тиазоло-1,2,4-триазинонов, а при катализе гидроксидом натрия в кипящем метаноле селективно получены региоизомеры 60 [39] (схема 33).
Схема 33
R |
N NH i или ii |
N |
N S |
R' |
+ |
R |
N N |
R' |
|
O |
N S |
R |
N |
O |
N S |
||||
|
|
|
|||||||
|
|
|
|
||||||
|
R' |
|
O |
|
|
|
|
|
|
|
59 (43−70%) |
|
|
|
60 (73−87%) |
|
|||
|
|
|
|
|
|
||||
R = H, Me, Ph; R' = H, Me;
i- PdCl2(PhCN)2 2−5 мол.%, MeCN или диметоксиэтан, кипячение;
ii- NaOH 10−50 мол.%, MeOH, кипячение
90 |
Серия научных монографий InterBioScreen |
