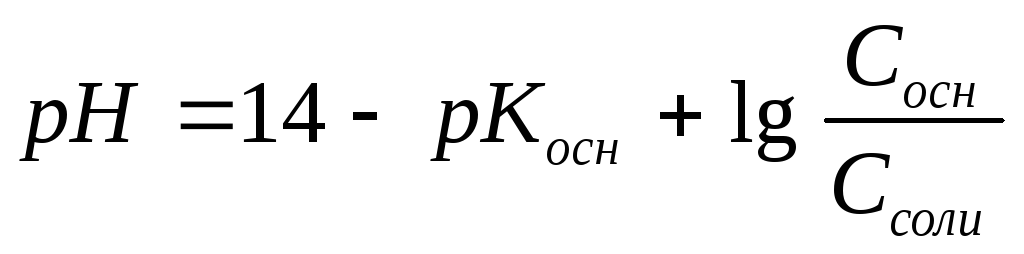- •Министерство образования и науки рф
- •Филиал федерального государственного автономного образовательного учреждения высшего профессионального образования
- •«Российский государственный профессионально-педагогический университет» в г. Кемерово
- •1. Цели освоения учебной дисциплины
- •2. Место учебной дисциплины в структуре ооп впо
- •3. Компетенции студента, формируемые в результате освоения учебной дисциплины
- •4. Содержание разделов и тем дисциплины
- •1. Строение и реакционная способность веществ.
- •2. Введение в теорию химических процессов
- •3. Растворы и их свойства
- •4. Электрохимические системы
- •5. Органические полимерные материалы
- •6. Поверхностно-активные вещества.
- •5 Оценочные средства для текущего контроля успеваемости и промежуточной аттестации по итогам освоения дисциплины
- •5.1 Вопросы для подготовки к зачету
- •5.2 Практическая часть.
- •6. Учебно-методическое и информационное обеспечение дисциплины
- •7 Краткие теоретические положения
- •Тема 1. Основные понятия в химии
- •Тема 2 Классы неорганических соединений
- •Тема 3. Строение атома и периодический закон
- •Тема 4 Химическая связь
- •2S22p2 1s2 (типа He)
- •Тема 5. Способы выражения количественного состава растворов
- •Тема 6. Равновесие в водных растворах электролитов
- •Тема 7. Свойства водных растворов неэлектролитов
- •Тема 8. Окислительно-восстановительные реакции
- •Тема 9. Равновесие в электрохимических системах
- •Тема 10. Термодинамика
- •Тема 11. Химическая кинетика и равновесие
- •Тема 12 Дисперсные системы (коллоидные растворы)
- •Контрольные задания по химии
- •Тема 1. Основные понятия в химии
- •Тема 2. Строение атома и периодическая система
- •Тема 3. Способы выражения количественного состава растворов
- •Тема 4. Равновесие в водных растворах электролитов
- •Тема 5. Свойства водных растворов неэлектролитов
- •Тема 6. Окислительно-восстановительные реакции
- •Тема 7. Равновесие в электрохимических системах
- •Тема 8. Термодинамика
- •Тема 9. Химическая кинетика и равновесие
- •Тема 10. Способы приготовления растворов
- •Тема 13. Дисперсные системы
- •Варианты контрольных работ
- •Словарь основных терминов
2S22p2 1s2 (типа He)
Пример 3. Определите, какая связь C−N или C−B является более полярной. Укажите, к ядру какого атома происходит смещение общей электронной пары.
Р е ш е н и е. Для определения полярности связи необходимо найти разность электроотрицательностей атомов (∆ЭО), образующих эти связи. Из табл.1 выписываем значения ЭО этих атомов и находим ∆ЭО: ЭОС =2,6; ЭОN = 3,0; ЭОB = 2,0; ∆ЭОC−N =3,0 – 2,6 = 0,4; ∆ЭОC−B = 2,6 – 2,0 = 0,6.
Известно, что чем больше ∆ЭО атомов, образующих связь, тем выше полярность связи. Поэтому более полярной является связь C–B. При образовании ковалентной связи общая электронная пара смещается к ядру атома с большей ЭО. В химической связи C−N общая электронная пара смещена к атому N, а в химической связи C−B – к атому С.
Тема 5. Способы выражения количественного состава растворов
Пример 1. Для реакций осаждения используют раствор, в 50 см3 которого содержится 2,8400 г серной кислоты. Рассчитайте титр, титр по хлориду бария, массовую долю, молярную концентрацию эквивалента и моляльность раствора, если плотность его равна 1,035 г/см3.
Решение.
1. Записываем уравнение реакции:
![]()
Данное уравнение необходимо для определения фактора эквивалентности и нахождения молярной массы эквивалента.
2. Титр раствора рассчитываем по формуле:
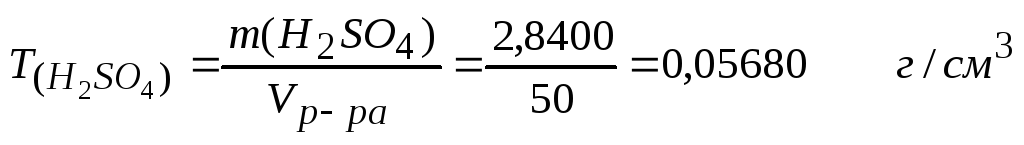
3. Расчет массовой доли проводим, используя формулу
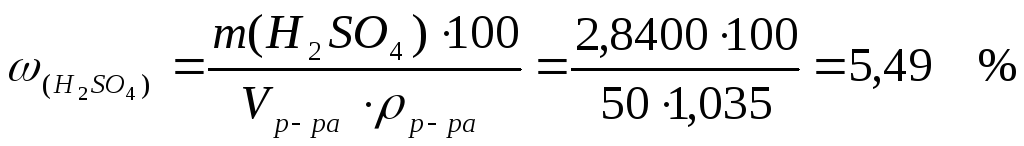
4. Титр раствора по хлориду бария, это масса его, реагирующая той массой серной кислоты, которая содержится в 1 см3 раствора. Титр рабочего вещества по определяемому можно выразить через уже рассчитанное значение титра согласно зависимости

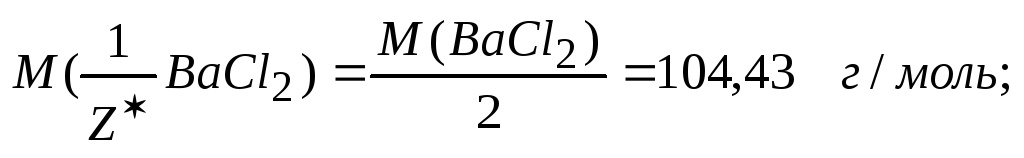
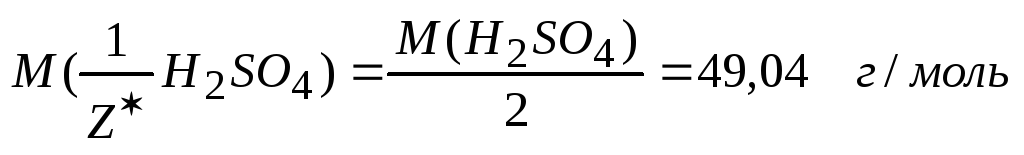
![]() для
BaCl2
и H2SO4,
так как соль содержит двухзарядный ион
Ва2+,
и в результате реакции происходит
замещение двух ионов водорода.
для
BaCl2
и H2SO4,
так как соль содержит двухзарядный ион
Ва2+,
и в результате реакции происходит
замещение двух ионов водорода.
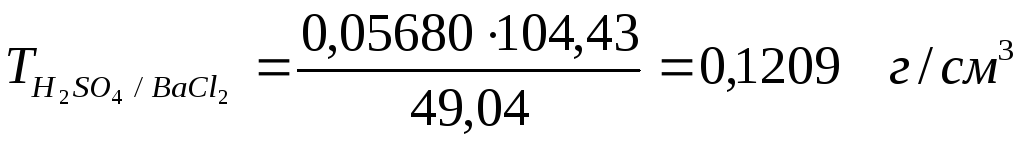
5. Молярную концентрацию рассчитываем по формуле:
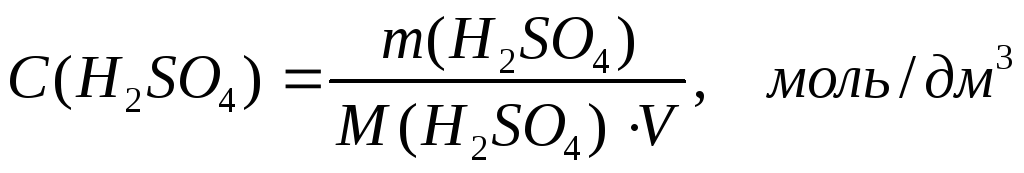
М(H2SO4) = 98,08 г/моль
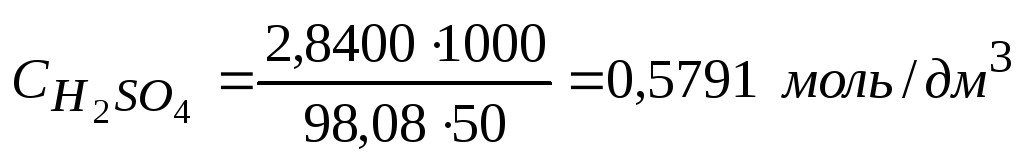
(1000 – коэффициент перевода см3 в дм3)
6. Молярную концентрацию эквивалента рассчитываем по формулам:
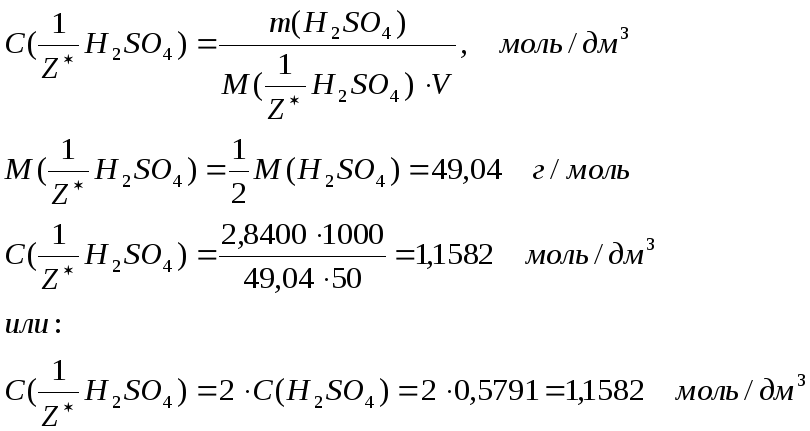
7. Моляльность раствора – количество серной кислоты в 1 кг растворителя – можно рассчитать по формуле
Массу растворителя можно рассчитать как разницу между массой раствора и растворенного вещества:
m(B) = mp=pa – m(H2SO4); mp-pa = Vp-pa p-pa; m(B) = [Vp-pa p-pa – m(H2SO4)], г
Так как масса серной кислоты в условии задачи дана в г, а плотность в г/см3, то для перевода массы растворителя из г в кг необходимо полученное выражение разделить на 1000. Окончательная формула расчета:
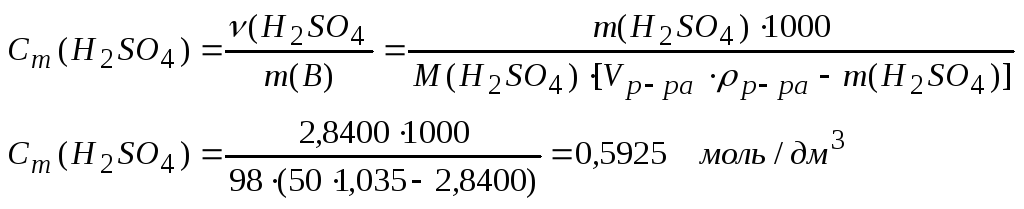
Тема 6. Равновесие в водных растворах электролитов
Основные типы взаимодействия в растворах электролитов включают в себя: реакции ионного обмена, гидролиз и кислотно-основное равновесие.
Формулы для вычисления рН растворов в зависимости от их состава
|
Состав раствора |
Формула расчета рН |
|
Сильная кислота (HCl, HNO3, HBr, HI) |
|
|
Сильное основание (NaOH, KOH) |
|
|
Слабая кислота |
|
|
Слабое основание |
|
|
Буферный раствор, состоящий из слабой кислоты и ее соли |
|
|
Буферный раствор, состоящий из слабого основания и его соли |
|
Если в растворе присутствует слабая кислота и ее соль или слабое основание и его соль, то эта смесь представляет собой буферный раствор.
Примеры вычислений рН водных растворов
При вычислении рН водных растворов придерживаемся следующей последовательности.
1. Определяется природа веществ, входящих в состав раствора, и подбирается формула для расчета рН.
2. Если в растворе присутствует слабая кислота или основание, находим по справочнику или в приложении значение рК этого соединения.
3. Подставляем числовые значения молярной концентрации и рК в расчетную формулу и вычисляем значение рН раствора.
В том случае, если смешиваем растворы двух веществ, вступающих в реакцию, то рассчитываем концентрацию вещества, взятого в избытке (при Z*= 1) по формуле:
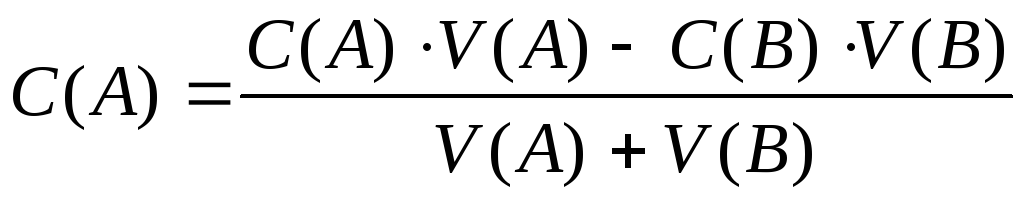 ,
моль/дм3
,
моль/дм3
где А – вещество, которое находится в избытке.
Пример 1. Вычислите рН раствора, в состав которого входит азотная кислота, С(HNO3) = 1 10-2 моль/дм3 и борная кислота, С(Н3ВО3) = 0,1 моль/дм3.
Решение. Азотная кислота относится к сильным кислотам. Борная кислота – слабая кислота, значение рК(Н3ВО3) = 9,24 (приложение табл.). В этом случае рН раствора зависит лишь от концентрации сильной азотной кислоты. Рассчитываем рН по формуле ().
рН = - lg C(HNO3), pH = - lg 1 10 –2 = 2
Пример 2. Вычислите рН раствора, состоящего из смеси гидроксида натрия, С(NaOH) = 0,025 моль/дм3, и гидроксида калия, С (КОН) = 0,075 моль/дм3.
Решение. Гидроксид натрия и гидроксид калия относятся к сильным основаниям (щелочам), поэтому прежде, чем вычислять значение рН по формуле (6), необходимо суммировать концентрации щелочей.
С(NaOH) + C(KOH) = 0,025 + 0,075 = 0,1 моль/дм3;
pOH = - lg0,1 = 1, pH = 14 – 1 = 13.