
Лекции по физике
.pdf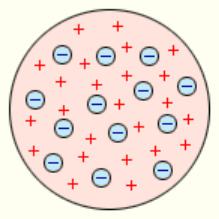
1. Опыт Резерфорда по рассеянию α-частиц. Ядерная модель атома
В 1903 году Дж. Дж. Томсон, предложил модель атома: сфера, равномерно заполненная положительным электричеством, внутри которой
находятся электроны (рис. 1). |
Суммарный |
заряд |
|||
|
такой сферы равен нулю. Атом в |
||||
|
целом нейтрален. Из теории такого |
||||
|
атома следовало, что спектр его |
||||
|
излучения |
должен |
быть |
||
Рис. 1 |
сплошным, |
но |
никак |
не ли- |
|
нейчатым, а |
это |
противоречило |
|||
|
|||||
экспериментальным наблюдениям242 .
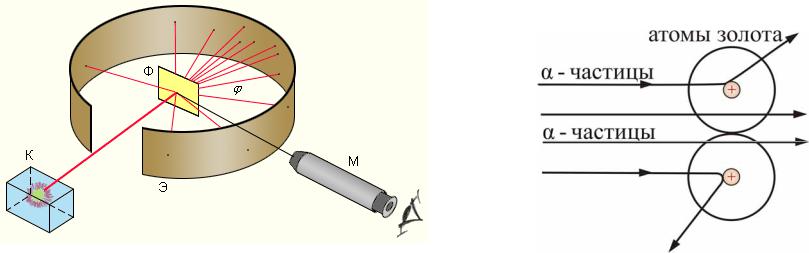
Узкий пучок α-частиц испускался радиоактивным веществом и попадал на фольгу. При прохождении через фольгу α-частицы отклонялись на различные углы. Рассеянные частицы ударялись об экран, покрытый ZnS и вызываемые им вспышки света, сцинцилляции, наблюдались в микроскоп. Микроскоп и связанный с ним экран можно было вращать вокруг оси, проходящей через центр фольги, т.е. можно было всегда измерить угол отклонения α-частиц . Весь прибор помещался в откачиваемый объем, чтобы устранить рассеяние α-частиц за счет столкновений с молекулами воздуха. 244
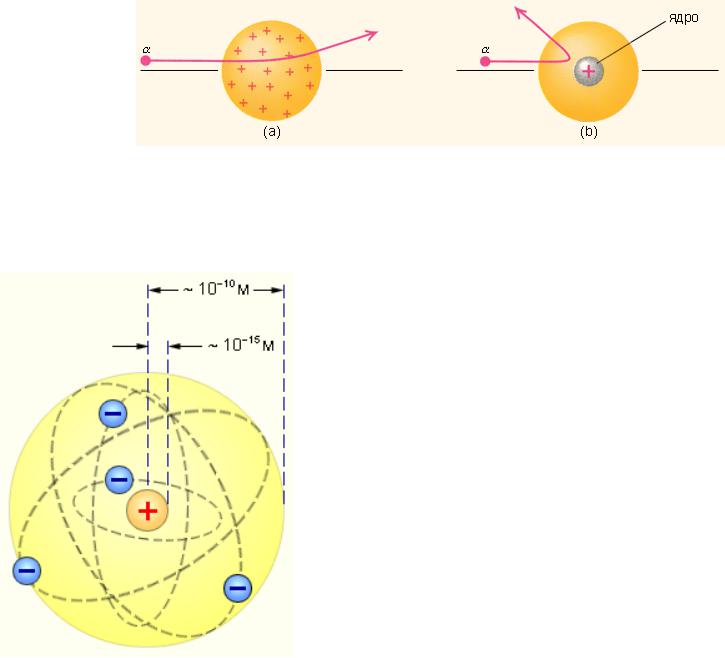
Обнаружилось, что некоторые α-частицы отклонялись на большие углы, до 180º. Резерфорд понял, что такое отклонение возможно лишь при встрече с положительно заряженной частицей большей массы. А малая вероятность отклонения на большие углы указывала на то, что эта положительная частица имеет малые размеры (~10–15 м). Электроны, по мнению Резерфорда, движутся вокруг ядра.
Но такая модель была в явном противоречии с классической электродинамикой, т.к. электрон, двигаясь по окружности, т.е. с нормальным ускорением, должен был излучать энергию, следовательно, замедлять скорость и упасть на ядро. Таким образом, модель Резерфорда на могла
245
объяснить, почему атом устойчив.
2. Закономерности в спектре атома водорода
Из опыта было известно, что атомы в виде разреженного газа или паров металлов испускают спектры, состоящие из отдельных спектральных линий (линейчатый спектр). Изучение атомных спектров послужило ключом к познанию строения атомов.
Прежде всего было замечено, что линии в спектрах расположены не беспорядочно, а сериями. Расстояние между линиями в серии закономерно уменьшается по мере перехода от длинных волн к коротким. 247
Швейцарский физик Й.Бальмер в 1885 году, исследуя спектр атомов водорода, установил, что длины волн в видимой части спектра излучения водорода могут быть представлены формулой:
λ = λ0 |
n2 |
|
|
||
|
|
, λ0 = const, n = 3, 4, 5,… |
или |
(1) |
|
n2 |
|
||||
|
− 4 |
|
|
||
|
1 |
|
1 |
|
1 |
|
|
|
|
|
|
|
|
||
|
|
|
|
1 |
|
1 |
|
|
|||||||
|
|
= R' |
|
|
− |
|
|
|
или |
ν = R |
|
− |
|
|
(2) |
|
λ |
2 |
2 |
n |
2 |
|
|
||||||||
|
|
n2 |
|||||||||||||
|
|
|
|
|
|
|
22 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R′ = 1,09·107 м-1 – постоянная Ридберга, n = 3, 4, 5,…
В физике постоянной Ридберга называют и другую величину равную R = R′·с.
248
R = 3,29·1015c-1
Дальнейшие исследования показали, что в спектре водорода имеется еще несколько серий спектральных линий:
|
|
|
1 |
|
|
|
|
|
1 |
|
|
|
|
||||||
Серия Лаймана |
ν = R |
|
|
|
|
|
− |
|
|
|
|
|
|
|
n = 2, 3, 4,… |
||||
|
|
2 |
|
|
n |
2 |
|
||||||||||||
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|||||
Серия Пашена |
ν = R |
|
|
1 |
|
|
− |
1 |
|
|
|
n = 4, 5, 6,… |
|||||||
|
32 |
|
|
|
n2 |
||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||
Серия Брэкета |
ν = R |
|
|
1 |
|
|
− |
1 |
|
|
n = 5, 6, 7,… |
||||||||
|
42 |
|
|
n2 |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
1 |
|
|
|
|
|
1 |
|
|
|
|
||||||
Серия Пфунда |
ν = R |
|
|
|
|
|
|
− |
|
|
|
|
|
|
|
n = 6, 7, 8,… |
|||
|
|
|
2 |
|
|
|
|
|
2 |
|
|
||||||||
|
|
|
5 |
|
|
|
|
|
|
|
n |
|
|
|
|
|
249 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
