
Himia_Bilety_19-24
.docНашёл что смог, хз, правильно ли.
итак
Вопрос номер 19 по теме: «Способы выражения состава в растворах. Примеры.»
Растворимость – способность в-ва растворяться в том или ином растворителе.
Растворитель - компонент раствора, агрегатное состояние которого не изменяется при образовании раствора.
Растворённое вещество – компоненты раствора за исключением растворителя.
Насыщенный раствор – термодинамически устойчивая равновесная система, в которой скорость растворения вещества равна скорости выделения его из раствора.
Ненасыщенный раствор – термодинамически устойчивая неравновесная система, в которой концентрация вещества меньше, чем в насыщенном растворе и поэтому скорость раствор больше скорости выделения.
Пересыщенный раствор - термодинамически неустойчивая псевдоравновесная система, в которой концентрация в-ва больше, чем в насыщенном растворе и поэтому скорость выделения больше скорости растворения.
Концентрированный раствор – раствор с высоким содержанием растворённого в-ва.
Разбавленный раствор - -//- с низким содержанием растворённого в-ва.
Массовая доля растворённого вещества w(B) - это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m :
w(B)= m(B) / m
Массовую долю растворённого вещества w(B) обычно выражают в долях единицы или в процентах. Например, массовая доля растворённого вещества – CaCl2 в воде равна 0,06 или 6%. Это означает,что в растворе хлорида кальция массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г.
Пример Сколько грамм сульфата натрия и воды нужно для приготовления 300 г 5% раствора?
Решение m(Na2SO4) = w(Na2SO4) / 100 = (5 · 300) / 100 = 15 г
где w(Na2SO4)) – массовая доля в %, m - масса раствора в г m(H2O) = 300 г - 15 г = 285 г.
Таким образом, для приготовления 300 г 5% раствора сульфата натрия надо взять 15 г Na2SO4) и 285 г воды.
Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора.
C(B) = n(B) / V = m(B) / (M(B) · V),
где М(B) - молярная масса растворенного вещества г/моль.
Молярная концентрация измеряется в моль/л и обозначается "M". Например, 2 M NaOH - двухмолярный раствор гидроксида натрия. Один литр такого раствора содержит 2 моль вещества или 80 г (M(NaOH) = 40 г/моль).
Пример Какую массу хромата калия K2CrO4 нужно взять для приготовления 1,2 л 0,1 М раствора?
Решение M(K2CrO4) = C(K2CrO4) · V · M(K2CrO4) = 0,1 моль/л · 1,2 л · 194 г/моль » 23,3 г.
Таким образом, для приготовления 1,2 л 0,1 М раствора нужно взять 23,3 г K2CrO4 и растворить в воде, а объём довести до 1,2 литра.
Концентрацию раствора можно выразить количеством молей растворённого вещества в 1000 г растворителя. Такое выражение концентрации называют моляльностью раствора.
Нормальность раствора обозначает число грамм-эквивалентов данного вещества в одном литре раствора или число миллиграмм-эквивалентов в одном миллилитре раствора. Грамм - эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту. Для сложных веществ - это количество вещества, соответствующее прямо или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода. Эоснования = Моснования / число замещаемых в реакции гидроксильных групп Экислоты = Мкислоты / число замещаемых в реакции атомов водорода Эсоли = Мсоли / произведение числа катионов на его заряд Пример Вычислите значение грамм-эквивалента (г-экв.) серной кислоты, гидроксида кальция и сульфата алюминия.
Э H2SO4 = М H2SO4 / 2 = 98 / 2 = 49 г Э Ca(OH)2 = М Ca(OH)2 / 2 = 74 / 2 = 37 г Э Al2(SO4)3 = М Al2(SO4)3 / (2· 3) = 342 / 2= 57 г
Величины нормальности обозначают буквой "Н". Например, децинормальный раствор серной кислоты обозначают "0,1 Н раствор H2SO4". Так как нормальность может быть определена только для данной реакции, то в разных реакциях величина нормальности одного и того же раствора может оказаться неодинаковой. Так, одномолярный раствор H2SO4 будет однонормальным, когда он предназначается для реакции со щёлочью с образованием гидросульфата NaHSO4, и двухнормальным в реакции с образованием Na2SO4.
Пример Рассчитайте молярность и нормальность 70%-ного раствора H2SO4 (r = 1,615 г/мл).
Решение Для вычисления молярности и нормальности надо знать число граммов H2SO4в 1 л раствора. 70% -ный раствор H2SO4 содержит 70 г H2SO4 в 100 г раствора. Это весовое количество раствора занимает объём
V = 100 / 1,615 = 61,92 мл
Следовательно, в 1 л раствора содержится 70 · 1000 / 61,92 = 1130,49 г H2SO4 Отсюда молярность данного раствора равна: 1130,49 / М (H2SO4) =1130,49 / 98 =11,53 M Нормальность этого раствора (считая, что кислота используется в реакции в качестве двухосновной) равна 1130,49 / 49 =23,06 H
Вопрос номер 20 по теме: «Давление пара растворов. Температура кипения и кристаллизации разбавленных растворов. Законы Рауля.»
Давление насыщенного пара растворов. Закон Рауля
Представим, что в равновесную систему жидкость А – пар введено некоторое вещество В. При образовании раствора мольная доля растворителя XА становится меньше единицы; равновесие в соответствии с принципом Ле Шателье – Брауна смещается в сторону конденсации вещества А, т.е. в сторону уменьшения давления насыщенного пара РА. Очевидно, что, чем меньше мольная доля компонента А в растворе, тем меньше парциальное давление его насыщенных паров над раствором. Для некоторых растворов выполняется следующая закономерность, называемая первым законом Рауля:
Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причем коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
![]() (1)
(1)
Поскольку сумма мольных долей всех компонентов раствора равна единице, для бинарного раствора, состоящего из компонентов А и В (компонент А считаем растворителем) легко получить следующее соотношение, также являющееся формулировкой первого закона Рауля:
![]() (2)
(2)
Относительное понижение парциального давления пара растворителя над раствором равно мольной доле растворенного вещества и не зависит от природы растворенного вещества.
Первый закон Рауля нетрудно вывести, используя понятие химического потенциала компонента, если считать пар над раствором идеальным газом. Условием гетерогенного равновесия является равенство химических потенциалов компонентов системы во всех фазах. Химический потенциал растворителя в растворе μА(р) связан с мольной долей растворителя в растворе XА уравнением (3):
![]() (3)
(3)
Химический потенциал растворителя в паре μА(п) можно выразить через парциальное давление пара растворителя РА:
![]() (4)
(4)
Химический потенциал чистого жидкого растворителя μ*А равен химическому потенциалу равновесного пара:
![]() (5)
(5)
В состоянии равновесия μА(п) = μА(р). Комбинируя выражения (3-5), легко получить:
![]() (6)
(6)
Принимая, что μ*А = μ°А(р), получаем следующее уравнение:
![]() (7)
(7)
Отсюда легко получить выражение для первого закона Рауля:
![]() =>
=> ![]() =>
=> ![]() (8)
(8)
Растворы, для которых выполняется первый закон Рауля, называют идеальными растворами. Идеальными при любых концентрациях являются растворы, компоненты которых близки по физическим и химическим свойствам (оптические изомеры, гомологи и т.п.) и образование которых не сопровождается объёмными и тепловыми эффектами. В этом случае силы межмолекулярного взаимодействия между однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором. Растворы, компоненты которых существенно различаются по физическим и химическим свойствам, подчиняются закону Рауля лишь в области бесконечно малых концентраций.
Если компоненты бинарного раствора летучи, то пар над раствором будет содержать оба компонента (относительное содержание компонентов в парах будет, как правило, отличаться от содержания их в растворе: пар относительно богаче компонентом, температура кипения которого ниже – см. следующий параграф). Рассмотрим идеальный бинарный раствор, состоящий из компонентов А и В, неограниченно растворимых друг в друге. Общее давление пара, согласно первому закону Рауля, равно
![]() (9)
(9)
Таким образом, для идеальных бинарных растворов зависимость общего и парциального давления насыщенного пара от состава раствора, выраженного в мольных долях компонента В, является линейной при любых концентрациях (рисунок 1). К таким системам относятся, например, системы бензол – толуол, гексан – гептан, смеси других изомерных углеводородов. Для реальных растворов данные зависимости являются криволинейными (рисунок 2).
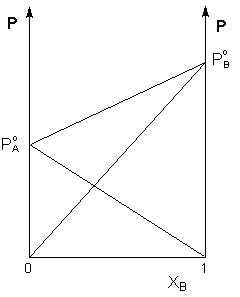
Рис. 1. Зависимость парциальных и общего давлений пара идеального раствора от концентрации.
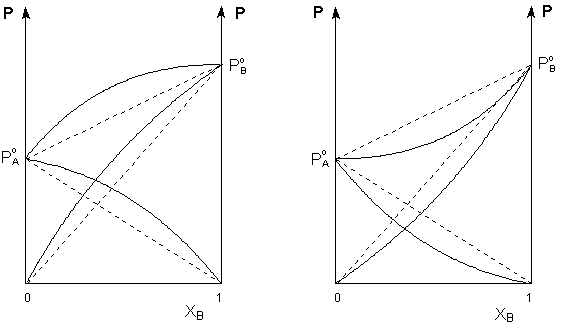
Рис. 2. Зависимость парциальных и общего давлений пара идеальных (штриховая линия) и реальных (сплошная линия) бинарных растворов от состава при положительных (слева) и отрицательных (справа) отклонениях от закона Рауля.
Если молекулы данного компонента взаимодействуют друг с другом сильнее, чем с молекулами другого компонента, то истинные парциальные давления паров над смесью будут больше, чем вычисленные по первому закону Рауля (положительные отклонения). Если же однородные частицы взаимодействуют друг с другом слабее, чем разнородные, парциальные давления паров компонентов будут меньше вычисленных (отрицательные отклонения).
Образование реальных растворов сопровождается тепловым и объёмным (т.н. контракция) эффектами. Реальные растворы с положительными отклонениями от закона Рауля образуются из чистых компонентов с поглощением теплоты (ΔНраств > 0); объём раствора оказывается больше, чем сумма исходным объёмов компонентов (ΔV > 0). Растворы с отрицательными отклонениями от закона Рауля образуются с выделением теплоты (ΔНраств < 0) ); объём раствора в этом случае будет меньше, чем сумма исходным объёмов компонентов (ΔV < 0).
Задание. 3.4. Определение молярной массы по температуре кипения.
Определите молярную массу серы, если раствор 0,324 г ее в 40 г бензола кипит на 0,081 градус выше,чем чистый бензол (Кэ = 2,61), какой формуле отвечает эта величина молярной массы? Решение. Определим моляльность раствора. Δt = Cm*Kэ 0,081 = Cm*2,61 Cm = 0,031 моль/кг. Определим молярную массу. Mr = mS/Cm*mC6H6 = 0,324/0,031*0,04 = 261 г/моль. Отсюда индекс составит s = Mr/Ar = 261/32 = 8.
Вопрос номер 21 по теме: «Осмос. Осмотическое давление. Закон Вант-Гоффа».
Определить осмотическое давление в 0,1% растворе хлорида натрия при температуре 25 оС, считая его диссоциацию полной. Плотность принять равной 1. Решение. Для электролитов необходимо учитывать изотонический коэффициент. При полной диссоциации степень диссоциации α = 1. Уравнение диссоциации: NaCl = Na+ + Cl-. Cоль распадается на 2 иона, k = 2. i = 1 + α(k - 1) = 1 + 1(2 - 1) = 2. Определим молярную концентрацию раствора. См = 10wp/Mr = 10*0,1*1/58,5 = 0,017 моль/л. Росм = iCRT = 2*0,017*8,31*298 = 84,2 кПа.
Явление осмоса наблюдается в тех средах, где подвижность растворителя больше подвижности растворённых веществ. Важным частным случаем осмоса является осмос через полупроницаемую мембрану. Полупроницаемыми называют мембраны, которые имеют достаточно высокую проницаемость не для всех, а лишь для некоторых веществ, в частности, для растворителя. (Подвижность растворённых веществ в мембране стремится к нулю). Если такая мембрана разделяет раствор и чистый растворитель, то концентрация растворителя в растворе оказывается менее высокой, поскольку там часть его молекул замещена на молекулы растворенного вещества (см. Рис. 1). Вследствие этого, переходы частиц растворителя из отдела, содержащего чистый растворитель, в раствор будут происходить чаще, чем в противоположном направлении. Соответственно, объём раствора будет увеличиваться (а концентрация вещества уменьшаться), тогда как объём растворителя будет соответственно уменьшаться.
Например, к яичной скорлупе с внутренней стороны прилегает полупроницаемая мембрана: она пропускает молекулы воды и задерживает молекулы сахара. Если такой мембраной разделить растворы сахара с концентрацией 5 и 10 % соответственно, то через нее в обоих направлениях будут проходить только молекулы воды. В результате в более разбавленном растворе концентрация сахара повысится, а в более концентрированном, наоборот, понизится. Когда концентрация сахара в обоих растворах станет одинаковой, наступит равновесие. Растворы, достигшие равновесия, называются изотоническими.
Осмос, направленный внутрь ограниченного объёма жидкости, называется эндосмосом, наружу — экзосмосом. Перенос растворителя через мембрану обусловлен осмотическим давлением. Оно равно избыточному внешнему давлению, которое следует приложить со стороны раствора, чтобы прекратить процесс, то есть создать условия осмотического равновесия. Превышение избыточного давления над осмотическим может привести к обращению осмоса — обратной диффузии растворителя.
В случаях, когда мембрана проницаема не только для растворителя, но и для некоторых растворённых веществ, перенос последних из раствора в растворитель позволяет осуществить диализ, применяемый как способ очистки полимеров и коллоидных систем от низкомолекулярных примесей, например электролитов.
-
При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза.
Уравнение, которое описывает это правило следующее:
![]()
где ![]() —
скорость реакции при температуре
—
скорость реакции при температуре ![]() ,
, ![]() —
скорость реакции при температуре
—
скорость реакции при температуре ![]() ,
, ![]() —
температурный коэффициент реакции
(если он равен 2, например, то скорость
реакции будет увеличиваться в 2 раза
при повышении температуры на 10 градусов).
—
температурный коэффициент реакции
(если он равен 2, например, то скорость
реакции будет увеличиваться в 2 раза
при повышении температуры на 10 градусов).
Следует помнить, что правило Вант-Гоффа применимо только для реакций с энергией активации 60-120 кДж/моль в температурном диапазоне 10-400oC. Правилу Вант-Гоффа также не подчиняются реакции, в которых принимают участие громоздкие молекулы, например белки в биологических системах.
Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле:
![]()
Вопрос номер 22 по теме: «Электролитическая диссоциация, её механизм.»
Электролитическая диссоциация, полный или частичный распад молекул растворенного вещества на катионы и анионы. Электролитической диссоциацией называют также распад на катионы и анионы ионных кристаллов при растворении или расплавлении. Электролитическая диссоциация, как правило, происходит в полярных растворителях.
При
электролитической диссоциации разрываются
обычно лишь наиболее полярные связи
молекул, например карбоновые кислоты
RCOOH диссоциируют на ![]() и
Н+,
электролитической диссоциации могут
подвергаться молекулы некоторых
растворителей, например воды.
и
Н+,
электролитической диссоциации могут
подвергаться молекулы некоторых
растворителей, например воды.
Мерой
электролитической диссоциации является
степень диссоциации ![]() -
отношение кол-ва диссоциированных на
ионы молекул электролита
к их исходному количеству в растворе.
Согласно этому определению,
-
отношение кол-ва диссоциированных на
ионы молекул электролита
к их исходному количеству в растворе.
Согласно этому определению, ![]() изменяется
от 0 (отсутствие диссоциации) до 1 (полная
диссоциация) и зависит от природы
растворенного вещества и растворителя,
а также от концентрации раствора
и температуры. Как правило, с увеличением
диэлектрической проницаемости
растворителя
изменяется
от 0 (отсутствие диссоциации) до 1 (полная
диссоциация) и зависит от природы
растворенного вещества и растворителя,
а также от концентрации раствора
и температуры. Как правило, с увеличением
диэлектрической проницаемости
растворителя ![]() его
его ![]() увеличивается,
хотя заметная диссоциация наблюдается
в некоторых растворителях с низкой
увеличивается,
хотя заметная диссоциация наблюдается
в некоторых растворителях с низкой ![]()
Способность
данного вещества MX к электролитическая
диссоциация в
определенном р-рителе по схеме MX ![]() M++
Х- характеризуется
константой электролитической
диссоциации KD, связанной,
согласно закону действующих масс, со
степенью диссоциации
M++
Х- характеризуется
константой электролитической
диссоциации KD, связанной,
согласно закону действующих масс, со
степенью диссоциации ![]() соотношением:
соотношением:

где х:
- молярная концентрация электролита; ![]() -
средний ионный коэффициент активности;
-
средний ионный коэффициент активности; ![]() -
коэффициент активности недиссоциированной
части электролита. Как и
-
коэффициент активности недиссоциированной
части электролита. Как и ![]() значение
константы KD зависит
от свойств растворенного вещества, в
частности от прочности связи между
фрагментами молекул электролита,
образующими катион и анион, от
диэлектрических свойств растворителя,
его способности сольватировать ионы,
а также от температуры и давления; в
отличие от
значение
константы KD зависит
от свойств растворенного вещества, в
частности от прочности связи между
фрагментами молекул электролита,
образующими катион и анион, от
диэлектрических свойств растворителя,
его способности сольватировать ионы,
а также от температуры и давления; в
отличие от ![]() не
зависит от концентрации раствора.
Константа KD может
быть определена экспериментально,
например, по зависимости электропроводности
раствора от концентрации электролита
или путем прямого измерения содержания
свободных ионов в
растворе, например, спектрофотометрическим
методом.
не
зависит от концентрации раствора.
Константа KD может
быть определена экспериментально,
например, по зависимости электропроводности
раствора от концентрации электролита
или путем прямого измерения содержания
свободных ионов в
растворе, например, спектрофотометрическим
методом.
Соответственно
понятиям полной и неполной электролитической
диссоциации электролиты классифицируют
на сильные ![]() и
слабые
и
слабые ![]() (см. Электролиты), полностью
диссоциируют в растворе многие соли
неорганических кислот, некоторые кислоты
и основания. Неполная электролитическая
диссоциация наблюдается для
солей, катионы которых
склонны к образованию ковалентных
связей с анионами, например соли Ag, Cd,
Zn. Некоторые многоосновные кислоты,
например H2SO4,
полностью диссоциируют лишь в отношении
отщепления одного иона Н+,
а дальнейшая диссоциация
(см. Электролиты), полностью
диссоциируют в растворе многие соли
неорганических кислот, некоторые кислоты
и основания. Неполная электролитическая
диссоциация наблюдается для
солей, катионы которых
склонны к образованию ковалентных
связей с анионами, например соли Ag, Cd,
Zn. Некоторые многоосновные кислоты,
например H2SO4,
полностью диссоциируют лишь в отношении
отщепления одного иона Н+,
а дальнейшая диссоциация ![]() затруднена.
Разбавленные растворы слабых электролитов по
своим свойствам близки к идеальным
растворам, для них в формуле (1) коэффициент
активности можно считать равными 1.
Тогда формула (1) переходит в закон
разведения Оствальда:
затруднена.
Разбавленные растворы слабых электролитов по
своим свойствам близки к идеальным
растворам, для них в формуле (1) коэффициент
активности можно считать равными 1.
Тогда формула (1) переходит в закон
разведения Оствальда: 
в
котором а можно заменить
отношением ![]() где
где ![]() и
и ![]() -соответственно
эквивалентная электропроводность
раствора при данной концентрации и
при бесконечном разведении. В соответствии
с законом Оствальда с уменьшением
концентрации раствора степень диссоциации а
и эквивалентная электропроводность
возрастают, причем при бесконечном
разведении
-соответственно
эквивалентная электропроводность
раствора при данной концентрации и
при бесконечном разведении. В соответствии
с законом Оствальда с уменьшением
концентрации раствора степень диссоциации а
и эквивалентная электропроводность
возрастают, причем при бесконечном
разведении ![]() и
и ![]() .
Растворы сильных электролитов не
являются идеальными и для их описания
необходим учет межионного взаимодействия
даже в области предельного разведения.
При определенных условиях, например в
растворителях с малой диэлектрической
проницаемостью, при низких температурах
или при образовании многовалентных
ионов, благодаря сильному электростатическому
притяжению противоположно
заряженных ионов могут
образовываться ионные ассоциаты,
простейшими из которых являются ионные
пары.
.
Растворы сильных электролитов не
являются идеальными и для их описания
необходим учет межионного взаимодействия
даже в области предельного разведения.
При определенных условиях, например в
растворителях с малой диэлектрической
проницаемостью, при низких температурах
или при образовании многовалентных
ионов, благодаря сильному электростатическому
притяжению противоположно
заряженных ионов могут
образовываться ионные ассоциаты,
простейшими из которых являются ионные
пары.
Равновесие между сольватированными ионами и ионными парами характеризуется константой диссоциации, аналогично исходному распаду молекул, или обратной ей величиной - константой ассоциации. В приближении электростатического взаимодействия между ионами константа диссоциации контактных ионных пар, образованных двумя ионами с радиусами r+ и r. и зарядовыми числами z+ и z-, может быть рассчитана по формуле:
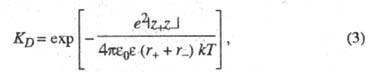
где е
- элементарный
электрический заряд; k
- постоянная
Больцмана; ![]() -
электрическая постоянная (диэлектрическая
проницаемость вакуума) ;
-
электрическая постоянная (диэлектрическая
проницаемость вакуума) ; ![]() -
диэлектрическая проницаемость
растворителя; Т
- абс.
температура.
-
диэлектрическая проницаемость
растворителя; Т
- абс.
температура.
Понятие электролитической диссоциации было введено С. Аррениусом в 1887. Электролитическая диссоциация играет важную роль во многих природных и производств, процессах, определяя как свойства растворов электролитов, так и особенности происходящих в них процессов.
Вопрос номер 23 по теме: «Степень диссоциации. Сильные и слабые электролиты. Активность ионов.»
Концентрация ионов в растворах зависит от того, насколько полно данный электролит диссоциирует на ионы. В растворах сильных электролитов, диссоциацию которых можно считать полной, концентрацию ионов легко определить по концентрации (c) и составу молекулы электролита (стехиометрическим индексам), например:
|
c H2SO4 = |
2c c 2H+ + SO42- |
|
|
|
Степень диссоциации зависит от концентрации раствора слабого электролита. При разбавлении водой степень диссоциации всегда увеличивается, т.к. увеличивается число молекул растворителя (H2O) на одну молекулу растворенного вещества. По принципу Ле Шателье равновесие электролитической диссоциации в этом случае должно сместиться в направлении образования продуктов, т.е. гидратированных ионов.
Степень электролитической диссоциации зависит от температуры раствора. Обычно при увеличении температуры степень диссоциации растет, т.к. активируются связи в молекулах, они становятся более подвижными и легче ионизируются. Концентрацию ионов в растворе слабого электролита можно рассчитать, зная степень диссоциации α и исходную концентрацию вещества c в растворе.
Электролитическая диссоциация ионных кристаллических веществ (М+)(А−) в воде является необратимой реакцией: (М+)(А−) = М+(р) + А−(р)
Такие вещества относятся к сильным электролитам. Например:
-
NaOH = Na+ + OH−
-
Ba(OH)2 = Ba2+ + 2 OH−
-
K2SO4 = 2K+ + SO42−
-
Na2S = 2Na+ + S2−
Электролитическая
диссоциация веществ МА, состоящих из
полярных ковалентных молекул, является
обратимой реакцией:
(Мδ+ -
Аδ−) ![]() М+(р) +
А−(р)
М+(р) +
А−(р)
Такие вещества относятся к слабым электролитам. Например:
-
HNO2
 H+ +
NO2−
H+ +
NO2− -
CH3COOH
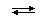 H+ +
CH3COO−
H+ +
CH3COO− -
H2CO3
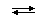 H+ +
HCO3−
HCO3−
H+ +
HCO3−
HCO3− 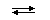 H+ +
CO32−
H+ +
CO32− -
NH3 · H2O
 NH4+ +
OH−
NH4+ +
OH−
Активность (ионов) — эффективная концентрация с учетом электростатического взаимодействия между ионами в растворе. Активность отличается от концентрации на некоторую величину. Отношение активности (а) к концентрации вещества в растворе (с, в г-ион/л) называется коэффициентом активности: γ = a/c.
Вопрос номер 24 по теме: «Константа диссоциации. Закон разбавления Освальда.»
Константа диссоциации — вид константы равновесия, которая показывает склонность большого объекта диссоциировать(разделяться) обратимым образом на маленькие объекты, как например когда комплекс распадается на составляющие молекулы, или когда соль разделяется в водном растворе на ионы. Константа диссоциации обычно обозначается Kd и обратна константе ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации.
В общей реакции
![]()
где комплекс AxBy разбивается на x единиц A и y единиц B, константа диссоциации определяется так:
![]()
где [A], [B] и [AxBy] — концентрации A, B и комплекса AxBy соответственно.
