
- •Кафедра химии, физики и биологии
- •Тема: Растворы. Способы выражения концентраций растворов.
- •Приготовление растворов (обучающие задачи).
- •Задания, выполняемые на занятии
- •Лабораторная работа № 2 «Приготовление раствора NaCl с заданной массовой долей путем разбавления концентрированного раствора»
- •1. Определение массовой доли NaCl [%] исходного концентрированного раствора по его плотности, измеренной при помощи ареометра.
- •2. Выполнение расчетов для приготовления раствора с заданной массовой долей
- •3. Приготовление раствора с заданной массовой долей
- •4. Дополнительное задание
- •5. Составляют отчет по выполненной работе. Задания для внеаудиторной самостоятельной работы студентов (приложить к отчету по лабораторной работе).
Коми филиал ГБОУ ВПО Кировская государственная медицинская академия Минздравсоцразвития России
Кафедра химии, физики и биологии
Занятие № 4 по Химии.
Руководство для студентов.
Тема: Растворы. Способы выражения концентраций растворов.
Теоретические аспекты
Растворы - это однородные (гомогенные) системы, состоящие из двух и более компонентов и продуктов их взаимодействия, относительные количества которых могут изменяться в широких пределах. Химический состав и физические свойства всех частей раствора одинаковы.
Всякий раствор состоит из растворенного вещества (растворенных веществ) и растворителя – среды, в которой это вещество равномерно распределено в виде молекул и ионов. Растворителем обычно считается тот компонент, который в чистом виде существует в том же агрегатном состоянии, что и полученный раствор. Если оба компонента раствора до их смешивания находились в одинаковом агрегатном состоянии, то растворителем считается компонент, находящийся в большем количестве. Деление на растворитель и растворенные вещества является условным и применяется в основном для жидких растворов.
В медицинской практике наибольшее значение имеют жидкие растворы, в которых растворителем является вода. Все биохимические и физико - химические процессы в живых организмах происходят в водной среде. Растворами являются плазма крови и лимфа, спинномозговая жидкость. Лекарственные вещества эффективны лишь в растворенном состоянии в организме. Изучение свойств водных растворов показывает, что их поведение подчиняется ряду законов, которые необходимо учитывать в медицинской практике.
Растворимость веществ зависит от их природы и свойств растворителя, температуры и давления (при растворении газа). Растворимостью называют способность данного вещества растворяться в том или ином растворителе при данных условиях. Количественно растворимость характеризуется концентрацией насыщенного раствора при определенных температуре и давлении.
Раствор, находящийся в динамическом равновесии с избытком растворенного вещества называется насыщенным. Раствор, который содержит меньшее количество растворенного вещества, чем в насыщенном растворе при тех же условиях, называется ненасыщенным.
Насыщенные растворы применяют сравнительно редко. В большинстве случаев используют ненасыщенные растворы, содержащие меньше растворенного вещества, чем его содержит при данной температуре насыщенный раствор. При этом растворы с низким содержанием растворенного вещества называются разбавленными, с высоким – концентрированными. Называя раствор разбавленным или концентрированным, характеризуют лишь сравнительные качества раствора.
Количественный состав раствора задают с помощью концентрации – характеристики раствора, определяющей пропорции, в которых смешаны растворенные вещества и растворитель. В общем случае концентрация – это относительное содержание вещества в растворе. Существуют весовые и объемные способы задания концентрации раствора.
Обозначим: А – растворенное вещество, В – растворитель.
Массовой долей растворенного вещества (А) называется отношение его массы m(A) к массе раствора mр-р:
![]()
![]()
![]() (2.1)
(2.1)
где 0 ω(А) 1, а масса раствора может быть определена: mр-р= m(A) + m(B)
или mр-р.= Vр-р[мл] [г/мл], где Vр-р – объем раствора; р-р – его плотность.
Безразмерную величину ω(А) часто выражают в процентах: ω(A) = ω (A) 100
Поскольку
![]() (А)
+
(А)
+
![]() (В)
= 1, то массовая
доля растворителя может быть легко
определена по уравнению:
(В)
= 1, то массовая
доля растворителя может быть легко
определена по уравнению:
![]() (B)
= 1 –
(B)
= 1 –
![]() (A).
(A).
Массы растворенного вещества А и растворителя В в растворе легко могут быть найдены по формулам:
m(A)
= mр-р
(А)
= Vр-р.
р-р
![]() (А)
m(B)
= mр-р
– m(A)
= mр-р
(1 –
(А)
m(B)
= mр-р
– m(A)
= mр-р
(1 –
![]() (А))
(А))
Молярная доля (А) – это отношение количества молей вещества данного компонента раствора к сумме чисел молей всех компонентов раствора; в частности, растворенного вещества (А) и растворителя (В):
![]() (2.2)
(2.2)
Молярная доля выражается в долях единицы: 0 < 1 или в процентах.
Из концентраций, которые выражаются размерными величинами, наиболее употребительны следующие.
Молярную концентрацию растворенного вещества с(А) рассчитывают как отношение количества вещества (А) [моль] к объему раствора Vр-р [л], выраженному в литрах, и она показывает число моль А, приходящееся на 1 литр раствора:
с(A)
=
![]() ,
(2.3)
,
(2.3)
откуда (А) = с(А)[моль/л] Vр-р[л] и
m(A) = c(A)[моль/л] Vр-р[л] M(A)[ г/моль].
Для обозначения молярной концентрации используется символ М (после численного значения молярной концентрации), например, 1М – одномолярный раствор, с(А) = 1 моль/л; 0,1М – децимолярный раствор, с(А) = 0,1 моль/л; 0,01М – сантимолярный раствор, с(А) = 0,01 моль/л.
На практике часто используют массовую (весовую) объемную концентрацию, определяемую как отношение массы растворенного вещества, выраженной в граммах, миллиграммах и др., к объему раствора, выраженному в литрах:
сm(А)[г/л]
=
![]() ,
(2.4)
,
(2.4)
тогда m(А) = сm(А) [г/л]Vр-р[л]
Между
концентрациями
![]() (A),
с(А)[моль/л]
и cm(A)[г/л]
существует связь:
(A),
с(А)[моль/л]
и cm(A)[г/л]
существует связь:
с(А)
=
![]() , (2.5)
, (2.5)
сm(А) = с(А)М(А) и (2.6)
(А)
=
![]() , (2.7)
, (2.7)
где
с(А) – молярная
концентрация вещества А,
моль/л; ρ
– плотность раствора, г/мл;
![]() (A)
– массовая доля вещества
А (доли
единицы); М(А)
– молярная масса вещества А,
г/моль;
1000
– коэффициент пересчета размерностей.
(A)
– массовая доля вещества
А (доли
единицы); М(А)
– молярная масса вещества А,
г/моль;
1000
– коэффициент пересчета размерностей.
Для твердых и газообразных растворенных веществ существует предельное количество вещества, которое при данных условиях может быть растворено в определенной массе или объеме растворителя. Образующийся при этом раствор называется насыщенным, а его концентрация соответствует растворимости данного вещества.
В
справочниках из соображений удобства
растворимость веществ S
при разных условиях выражают не в виде
концентраций насыщенных растворов -
![]() (А)
или с(А),
а указывают для твердых веществ – массу
вещества А,
растворимую в 100 г
растворителя (Н2О)
при температуре t
C
[г100г
Н2О];
для газообразных веществ – объем газа,
растворимого в 1л
растворителя (Н2О)
при температуре tC
и давлении p[Па].
Например, растворимость хлорида калия
в 100г
воды при 25
С обозначается
S(KCl)
= 36,0 (250С).
На основе этих данных легко рассчитать
обычные концентрации
(А)
или с(А),
а указывают для твердых веществ – массу
вещества А,
растворимую в 100 г
растворителя (Н2О)
при температуре t
C
[г100г
Н2О];
для газообразных веществ – объем газа,
растворимого в 1л
растворителя (Н2О)
при температуре tC
и давлении p[Па].
Например, растворимость хлорида калия
в 100г
воды при 25
С обозначается
S(KCl)
= 36,0 (250С).
На основе этих данных легко рассчитать
обычные концентрации
![]() (А)
и с(А)
насыщенных растворов.
(А)
и с(А)
насыщенных растворов.
Молярная концентрация эквивалента с(1/z A) [моль/л] вещества А в растворе – отношение количества вещества эквивалента (1/zA)[моль] к объему раствора Vр-р[л], которое показывает число молей эквивалента вещества в 1л:
с![]() [моль/л]
=
[моль/л]
=
 (2.8)
(2.8)
где – 1/z фактор эквивалентности вещества.
Уравнение связи между концентрацией эквивалента и молярной концентрацией: С(1/z A) = z · с(А),
где z – число эквивалентности.
Молярная концентрация эквивалента известна в практике химического анализа как нормальная концентрация. Для обозначения нормальной концентрации используют символ “н” (после численного значения молярной концентрации эквивалента), например, 1н – однонормальный раствор, т.е. с(1/z A) = 1 моль/л; 0,1н – децинормальный раствор или с(1/z A) = 0,1 моль/л; 0,01н – сантинормальный раствор или с(1/z A) = 0,01 моль/л.
Таким образом, молярная концентрация эквивалента или нормальная концентрация показывает количество вещества эквивалента частиц сорта А в 1 л раствора.
Молярная концентрация эквивалента или нормальная концентрация наиболее широко используется в практике химического анализа при решении экспериментальных задач, в частности в объемном анализе при титровании. Главной теоретической основой объемного анализа является закон эквивалентов (1.1), который позволяет рассчитать количество анализируемого вещества по результатам титрования.
Титр раствора Т равен отношению массы растворенного вещества (m, г) к объему раствора (Vр-р, мл):
T[г/мл] = m[г] / Vр-р[мл] (2.9)
Титр раствора показывает массу растворенного вещества в 1 мл раствора. (Не отожествлять с плотностью раствора!).
Титр при известной нормальной концентрации раствора рассчитывают по формуле:
Т =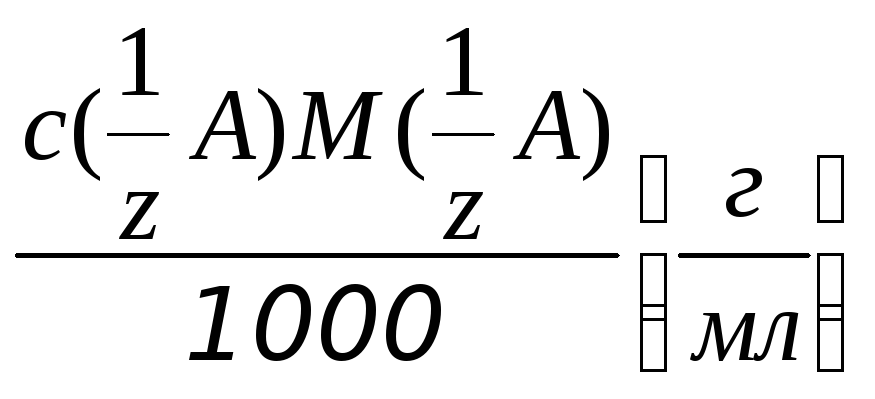 , (2.10)
, (2.10)
где М(1/z A) г/моль – молярная масса эквивалента вещества А.
Масса вещества (m, г) в определенном объеме раствора (Vр-р, мл), нормальная концентрация раствора (с(1/z A), моль/л) и молярная масса эквивалента (М(1/z A)г/моль) связаны соотношением:
m
= с![]() M
M![]() Vр-р (2.11).
Vр-р (2.11).
Удобным способом выражения нормальной концентрации раствора при массовых анализах является титр стандарта по определяемому веществу.
Титр стандарта по определяемому веществу – Тст/опр [г/мл] – равен массе анализируемого вещества А [г], которая взаимодействует с одним миллилитром раствора реагента R(стандартного раствора):
Тст/опр
=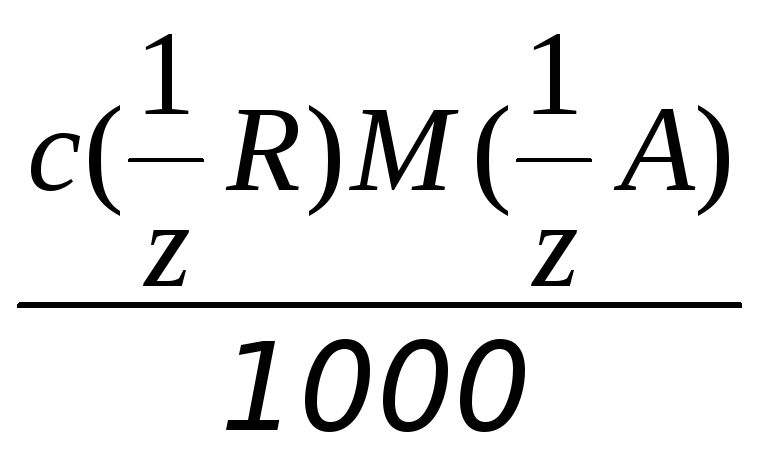 , (2.12)
, (2.12)
где
с![]() моль/л
– нормальная концентрация стандартного
раствора реагента;
моль/л
– нормальная концентрация стандартного
раствора реагента;
М(1/z A) г/моль – молярная масса эквивалента определяемого вещества А.
Моляльная концентрация b(А) [моль/кг] – отношение количества вещества А [моль] в растворе к массе растворителя В [кг]:
b(А)
=![]() .
(2.13)
.
(2.13)
Например: b(H2SO4) = 0,1моль/кг – децимоляльный раствор серной кислоты в одном килограмме растворителя (воды) содержится 0,1 моль H2SO4.
