
- •Российский химико-технологический университет им. Д.И. Менделеева Раздаточный материал по теме: квантовая химия атома
- •Содержание
- •1. Принципы квантовой механики
- •2. Вариационный принцип. Решение уравнения Шредингера
- •3. Приближение независимых частиц
- •4. Метод самосогласованного поля (Хартри)
- •5. Приближение центрального поля
- •6. Атомные орбитали и их характеристики
- •Угловые части волновой функции атома, обладающего центральным полем
- •7. Антисимметричность электронной волновой функции
- •8. Детерминант Слейтера
- •9. Метод Хартри-Фока
- •10. Ограниченный и неограниченный методы Хартри-Фока
- •Собственные значения спинового момента электронов в зависимости от спинового состояния
- •11. Квантово-химическая трактовка решений уравнений Хартри-Фока
- •12. Электронные конфигурации атомов с точки зрения квантовой химии
- •Список литературы
10. Ограниченный и неограниченный методы Хартри-Фока
Многоэлектронная волновая функция N-электронной системы должна быть антисимметричной и отвечать определенным проекциям N-электронных орбитального углового и спинового моментов. Она также будет собственной функцией оператора квадрата полного спина системы S2, если она построена из пространственных спин-орбиталей, занятых парой электронов с противоположными спинами (табл. 5). Когда волновая функция аппроксимируется единственным детерминантом Слейтера, состоящим из таких спин-орбиталей, метод называется ограниченным (по спину) методом Хартри-Фока (ОХФ). Если же требование быть собственной функцией S2 на волновую функцию не накладывается, метод называется неограниченным методом ХФ (НХФ). Последний обеспечивает большую гибкость волновой функции и, как правило, применяется для систем с открытыми оболочками, обеспечивая для них более низкое значение энергии.
Таблица 5
Собственные значения спинового момента электронов в зависимости от спинового состояния
|
Спиновое состояние |
Спин(ы) |
Собственное значение S2 |
Спиновое состояние |
Спин(ы) |
Собственное значение S2 |
|
Синглет |
0 |
0 |
квартет |
1.5 |
3.75 |
|
Дуплет |
0.5 |
0.75 |
квинтет |
2 |
6.0 |
|
Триплет |
1 |
2.0 |
"N-тет" |
(N-1)/2 |
s(s+1) |
Пример: энергия дуплетного спинового состояния молекулы CH3, рассчитанная ОХФ равна -39.5548 a.е. при S2 = 0.750, тогда как расчет НХФ дает 39.5590 a.е. при S2 = 0.761. Говорят, что волновая функция НХФ не соответствует чистому спиновому состоянию. Степень чистоты спинового состояния оценивается по величине квадрата полного спина системы S2, которая должно быть приближенно равна s(s+1).
Из-за снятия фундаментального требования быть собственной функцией оператора S2 в больших системах иногда получают НХФ-решения с более низкой энергией и с собственными значениями S2, завышенными более чем на 10% по сравнению с истинными. Решения, где симметрия по спину понижена, называются "НХФ-нестабильными". Такая нестабильность указывает на непригодность описания волновой функции единственным детерминантом. Однако свойства ОХФ-решения часто точны даже в присутствии очень большой НХФ-нестабильности.
11. Квантово-химическая трактовка решений уравнений Хартри-Фока
Х-Ф энергии орбиталей i имеют определенный физический смысл. Если удалить с орбитали i один электрон (ионизировать атом), изменение энергии системы можно приближенно записать как
![]() , (72)
, (72)
считая, что после удаления электрона система останется “замороженной”. Этот результат - теорема Купманса. Орбитальные ХФ-энергии дают оценку потенциалов ионизации (I) - энергий, которые необходимо сообщить системе, чтобы удалить какой-либо из ее электронов. По I можно судить о прочности связи электрона данной орбитали с атомным остовом.
Первый потенциал ионизации (I1) описывает энергию отрыва электрона с высшей занятой атомной орбитали. При этом предполагается, что и исходный атом, и образовавшийся ион находятся в основных (невозбужденных) состояниях. Потенциалы ионизации I2, I3, I4 и т.д. отвечают дальнейшим последовательным отрывам электронов от ионов. Для атома с N электронами I1 < I2 < I3 <I4 …< IN. Зависимость потенциала ионизации от порядкового номера элемента имеет ярко выраженный периодический характер (рис.9).В пределах периода, как правило, с увеличением атомного номера потенциалы ионизации возрастают. Исключения связаны с устойчивостью замкнутых оболочек (I0 < IN; IMg > IAl) с максимальной мультиплетностью.
Для экспериментального определения I применяют фотоэлектронную и рентгеноэлектронную спектроскопию.
Использование теоремы Купманса оправдано для молекул с жесткой структурой (для сопряженных углеводородов и др.), не изменяющих свою геометрию при ионизации. Более точно потенциал ионизации следует вычислять по разности ХФ энергий атома (молекулы) с замкнутой оболочкой и образующегося иона. Для первого потенциалаионизации:
I1 = E(N) – E(N-1). (73)
25
20
15
10
5

20 40 60
80
Порядковый
номер
элемента
Рис.9. Потенциалы ионизации элементов
Сродством к электрону Ax называют энергию, которая высвобождается при присоединении к нейтральному атому одного электрона. Наибольшими значениями Ax обладают атомы галогенов. По аналогии с (73):
A1 = E(N+1) – E(N), (74)
т.е. сродство к электрону можно приближенно охарактеризовать энергией низшей свободной (виртуальной) АО.
Зная многоэлектронную
волновую функцию ,
можно вычислить электронную плотность
![]() .
Если положение i-го электрона описать
оператором локальной плотности
.
Если положение i-го электрона описать
оператором локальной плотности![]() ,
то электронная плотность есть
,
то электронная плотность есть
(80)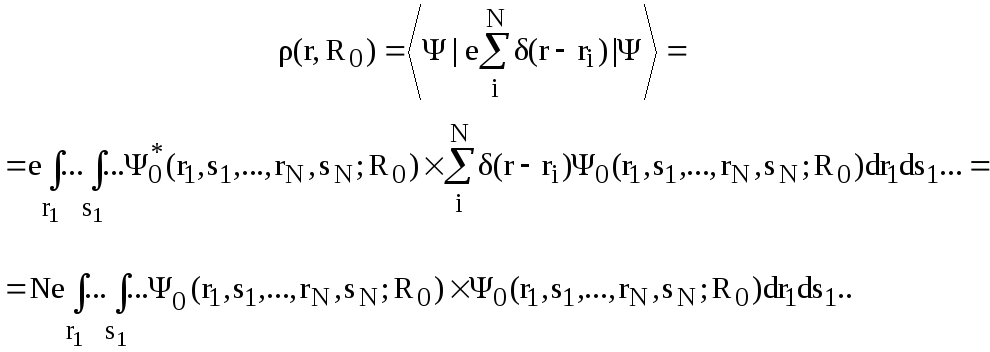
Теорема Хоэнберга-Кона
связывает
![]() и электронную энергию системы:
и электронную энергию системы:
E[] = Vяд(r) r dv + F[]. (81)
F[] одинаковый для всех многоэлектронных систем (универсальный) функционал электронной плотности, представляющий собой сумму кинетической энергии и энергии электрон-электронного взаимодействия, включая обмен и корреляцию электронов; Vяд(r) - потенциал ядер. Точная электронная плотность основного состояния обеспечивает минимум функционала (81).
Приравнивая нулю дифференциал электронной энергии при постоянном числе электронов и при неизменном ядерном потенциале
d{E[] - N[r]}Vяд = const = 0, (82)
(N = r dv), можно определить электронный химический потенциал :
![]() . (83)
. (83)
При образовании химической системы из атомов химический потенциал выравнивается, при этом происходит переток электронов к атому с большим значением . По смыслу это совпадает с эмпирически введенной Полингом электроотрицательностью.
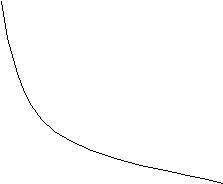
Рис.11 - зависимость
энергии атома от числа электронов. Как
видно из этого рисунка,
характеризует наклон кривой E = E (N).
Представим производную
![]() в конечно-разностном виде (предполагая
Е гладкой функцией N):
в конечно-разностном виде (предполагая
Е гладкой функцией N):
![]() . (84)
. (84)
Отсюда следует
![]() , (85)
, (85)
ч
I
N - 1
N N + 1
Число
электронов
Энергия
(-E)
EN-1
EN
EN+1 A I












Определенная таким образом величина
![]()
![]() (86)
(86)
называется абсолютной электроотрицательностью; она имеет вполне определенный физический смысл. Значения для некоторых атомов [11] приведены на рис. 12.
Пирсон (1986), действуя аналогичным образом, показал, что скорость изменения химического потенциала при изменении N есть абсолютная химическая жесткость
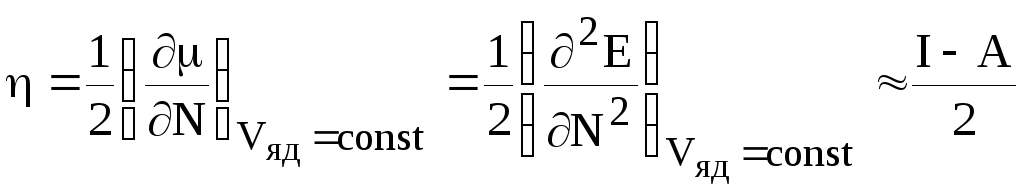 . (87)
. (87)
Порядковый номер
элемента
Рис.12. Зависимость электроотрицательности от порядкового номера элемента (исключены инертные газы)
В рамках метода Хартри-Фока атомная жесткость есть
=
![]() (ЕНСАО
– ЕВЗАО). (88)
(ЕНСАО
– ЕВЗАО). (88)
Величины
![]() и
и![]() являются характеристическими не только
для атомов, ионов, молекул, но и для
других многоэлектронных многоядерных
систем. Они лежат в основе широко
применяемых в химии концепцийпринципа
жестких и мягких кислот и оснований
и принципа
максимальной жесткости.
Кроме того, эти характеристики позволяют
проводить оценку технологических
свойств материалов. Например, существует
явная корреляция между величиной
электроотрицательности элемента и
температурой
его перехода в сверхпроводящее состояние
Тсп
[12].
Наивысшими температурами Тсп
обладают металлы с
являются характеристическими не только
для атомов, ионов, молекул, но и для
других многоэлектронных многоядерных
систем. Они лежат в основе широко
применяемых в химии концепцийпринципа
жестких и мягких кислот и оснований
и принципа
максимальной жесткости.
Кроме того, эти характеристики позволяют
проводить оценку технологических
свойств материалов. Например, существует
явная корреляция между величиной
электроотрицательности элемента и
температурой
его перехода в сверхпроводящее состояние
Тсп
[12].
Наивысшими температурами Тсп
обладают металлы с
![]()
3.9 эВ: Nb, Tc, Pb (рис.13). Максимальные
температуры перехода в сверхпроводящее
состояние
Тсп
бинарных сплавов наблюдаются для систем
со средней электроотрицательностью
3.9 эВ: Nb, Tc, Pb (рис.13). Максимальные
температуры перехода в сверхпроводящее
состояние
Тсп
бинарных сплавов наблюдаются для систем
со средней электроотрицательностью
![]()
4 эВ.
4 эВ.
1 2 3 4 5 6 7 0 2 4 6 8 10 Nb Tc Pb V Ta Sn In Tl Re Mo Ga Au As
Te Pt Si Cr Sc Cs
Rb K



























































Р
![]() ,
[эВ]
,
[эВ]
Вывод: по свойствам элементов можно отобрать вещества, перспективные для поиска материалов с высокими температурами перехода в сверхпроводящее состояние.
Важная характеристика веществ - энергия когезии. Для чистых металлов в кристаллической фазе эта величина связана с электронной плотностью свободного атома а следующим приближенным соотношением [13]:
 , (89)
, (89)
где
V0
- объем
элементарной ячейки кристалла, R0
=![]() -
радиус Вигнера-Зейца, N - число электронов
в атоме,
-
радиус Вигнера-Зейца, N - число электронов
в атоме,![]() -атомный
объем.
-атомный
объем.
Рис. 14- сравнение рассчитанных по формуле (89) энергий когезии с эксперимен-тальным и данными для металлов.

Рис.14. Энергия когезии чистых металлов в кристаллической фазе.
* - экспериментальные данные, - расчет
