
- •1.Основные понятия в химии: вещество, молекула, атом. Строение атома. Химический элемент. Изотопы. Атомная единица массы. Число Авогадро. Моль.
- •3.Понятие эквивалента вещества. Определение эквивалента. Определение эквивалентной массы кислот, оснований, солей, оксидов, простых веществ в овр. Закон эквивалентов. Объемный анализ.
- •5.Принципы и правила заполнения орбиталей. Принцип минимальной энергии. Принцип запрета Паули. Правило Хунда. Правило Клечковского.
- •6. Периодический закон и периодическая система
- •8. Ионная, металлическая, водородная связи. Влияние водородной связи на физико-химические свойства веществ.
- •9.Классификация неорганических соединений
- •10. Соли, их классификация, номенклатура, получение, химические свойства.
- •11.Скорость химической реакции. Гомогенные и гетерогенные реакции. Кинетическое уравнение реакции. Период полупревращения.
- •12.Влияние температуры на скорость реакции. Правило Вант-Гоффа. Энергия активации. Уравнение Аррениуса. Эндотермические и экзотермические реакции
- •13. Кинетика обратимых реакций. Химическое равновесие, выражение для константы равновесия, сдвиг химического равновесия. Принцип ле Шателье
- •14.Гомогенный и гетерогенный катализ, цели применения катализаторов. Ферментативный катализ и его особенности.
- •15. Тепловой эффект реакции. Первый закон термодинамики. Понятие энтальпии. Закон Гесса. Калорийность пищи.
- •16.Энтропия. Второй закон термодинамики. (постулат Планта): Энергия Гиббса.
- •18. Ионное произведение воды. Водородный и гидроксильный показатель (pH и pOh). Индикаторы. Расчет pH растворов слабых электролитов. Буферные растворы, расчет pH буферных систем.
- •19. Гидролиз солей. Степень и константа гидролиза. Расчет рН растворов солей, образованных слабой кислотой и сильным основанием, сильной кислотой и слабым основанием.
- •20 .Овр. Основные понятия. Метод электронного баланса. Метод полуреакций. Классификация овр.
- •21. Перманганатомерия; иодометрия: определение концентрации н2о2 и активного хлора в хлорной извести. Эквивалент в овр.
- •23.Коллигативные свойства, законы Рауля, закон Вант-Гоффа
- •24 . Комплексные соединения, классификация, структура, номенклатура. Химическая связь в кс.
- •25.Протеолитическая теория кислот и оснований.
- •26.Протолитический баланс.
- •27.Биогенные элементы- элементы ответственные за построение и жизнедеятельность клеток организма.
- •29Азот, его свойства. Аммиак. Кислородные соединения азота. Круговорот азота в природе.
- •30.Фосфор,его содинения
- •32.Кислород его свойства. Озон. Пероксид водорода его свойства. Круговорот кислорода в природе.
- •33.Сера
- •38. Сорбция и её виды: абсорбция, адсорбция. Коэффициент абсорбции. Удельная адсорбция. Уравнение Ленгмюра, его линейная аппроксимация.
- •39. Дисперсная система. Их классификация. Мицелла.
18. Ионное произведение воды. Водородный и гидроксильный показатель (pH и pOh). Индикаторы. Расчет pH растворов слабых электролитов. Буферные растворы, расчет pH буферных систем.
Вода является очень слабым электролитом: при комнатной температуре в чистой воде диссоциирует 1 из 10 молекул.
H20↔H++OH-
[H+]=[OH-]=10-7 моль/л при T=250(1)
Как и для любого слабого элуктролита процесс диссоциации воды характеризуется своей константой равновесия:
Kp= (2)
(2)
Но т.к. концентрация воды практически не изменяется, вносим конценрация воды под знак константы равновесия; произведения двух постоянных также является величиной постоянной, которая получила название ионного произведения воды (KW)
Kw=Kp*[H2O]=[H+][OH-]
Kw=[H+][OH-]
Kw=[H+][OH-]=10-7*10-7=10-14(3)
Kw не зависит от концентрации ионов H+ или OH-, зависит только от температуры. Зная концентрацию одного из ионов H+ или OH- через Kw легко определить концентрацию другого иона
[OH-]= (4)
(4)
Для количественного отображения концентрации ионов H+ или OH- в растворе ввели понятие водородного показателя pH(аналогичным образом характеризуется и концентрация гидроксилиных ионов OH-=pOH)
pH=-lg[H+](5)
pOH=-lg[OH-](6)
pH≈7 среда нейтральная
pH<7 ([H+]>10-7 моль\л) среда кислая
pH>7 ([H+]<10-7 моль\л) среда щелочная
pH крови 7,35±0,05
слюны 6,35-6,75
желуд.сока 1-2
моча 5-8
кожные покровы 5,5
слезы 7
Определим связь между pH и pOH, для этого прологарифмируем (3) и результат умножим на -1
-lg [H+]-lg[OH-]=14
pH+pOH=14(7)
Зная pH или pOH легко определить абсолютные концентрации ионов в расворе
[H+]=10-pH
[OH-]=10-pOH(15)
Индикаторы
Индикаторы – вещества, которые изменяют окраску растворов в зависимости от их среды.
Как правило индикатор представляет собой сложные орг молекулы либо слабых кислот либо слабых оснований
HInd↔H++Ind-
Действие индикаторов основано на том, что их молекулярные и ионные формы поглощают видимый свет в разном спектральном диапазоне. При избытке в растворах H+ индикатор преимущественно находится в молекулярной форме(1 окраска). При избытке OH- преимущественно анионная форма(другая окраска).
|
Индикатор, pH перехода окраски |
Окраска в зависимости от кислотности среды | ||
|
кислая |
нейтральная |
щелочная | |
|
Лакмус,≈7 |
красный |
фиолет |
синий |
|
Метилоранж, 3-4 |
красный |
оранж |
желтый |
|
Фенолфталеин, 8 |
- |
- |
малиновый |
Наиболее точно pH среды (с точностью до сотых единиц pH) опр инструментальными приборами (pH метрами, ионометрами)
Расчет pH растворов слабых электролитов.
А) растворы слабых кислот
C(HCN)=10-2 M
Ka=10-10
α= =10-4
=10-4
[H+]=αCo=10-4*10-2=10-6M
pH=-lg10-6=6
В случае многоосновной слабой кислоты (H2CO3,H3PO4) рассматривать диссоциацию только по 1 ступени, соответственно и константу диссоциации брать по 1 ступени
Б) растворы слабых оснований
C(NH4OH)=0,1 M
Kb=10-5
α =10-2
=10-2
[OH]=αCo=10-2*10-2=10-3M
pOH=-lg10-3=3
pH=14-3=11
Буферные растворы
Буферные растворы представляют собой смеси слабой кислоты и ее соли, слабого основания и его соли либо смеси солей слабых многоосновных кислот.
CH3COOH+CH3COONa
NH4Oh+NH4Cl
NaH2PO4+Na2HPO4
Особенностью данных растворов явл то, что при прибавлении небольших количеств сильной кислоты или щелочи pH такого раствора практически не меняется.
Механизм действия буферного раствора рассмотрим на примере ацетатного буфера
CH3COOH+CH3COONa
При появлении в растворе избытка H+ (+кислоты) они связываются с ацетат-ионами, обр при диссоциации соли молекулы слабого электролита – уксусной кислоты.
При добавлении к раствору щелочи избыток OH- нейтрализуется в реакции с уксусной кислотой, обр молекулы слабого электролита – воды.
CH3COO-+H+↔CH3COOH
CH3COOH+OH-↔CH3COO-+H2O
Главной характеристикой буферных растворов является их pH и буферная емкость.
Рассчитаем pH ацетатного буфера.
Расчет основан на константе диссоциации уксусной кислоты:
CH3COOH↔CH3COO-+ H+(1)
Ka= (2)
(2)
Выразим из ур(2) концентрацию [H+]
[H+]=Ka
Т.к. соль – сильный электролит, то CH3COONa диссоциирует в растворе полностью и можно считать, что равновесная концентрация ацетат ионов = исходной концентрации соли в буферном растворе.
Как следует из ур. Диссоциации (1) присутствие в растворе ацетат ионов смещает равновесие в сторону обр молекул кислоты, т.е. можно считать, что равновесная концентрация кислоты = исходной концентрации кислоты в буферном растворе, тогда ур(3) может быть записано в след виде:
[H+]=Ka* (4)
(4)
Прологарифмируем ур(4) и умножим на -1
-lg[H+]=-lgKa-lgCk+lgCc(5)
pH=pKa+lg (6)
(6)
где pKa=-lgKa силовой показатель кислоты
рассуждая аналогично для буферных растворов, представляющих смесь для слабого основания и его соли, можно вывести формулу
pOH=pKb+lg (7)
(7)
pKb силовой показатель слабого основания
Рассчитаем pH ацетатного буфера
Сk=Cc=0,1 M, Ka=1.175*10-5
Подставляем в формулу (6)
pH=-lg(1.75*10-5)+lg =5-lg1.75=4.76
=5-lg1.75=4.76
соотношение компонентов бферного раствора(напр, кислоты и ее соли) как правило берется в соот не превыш 1:10
рассчитаем как измен pH буферного раствора объемом 1 л, с концентрациями кислоты и соли = 0,1 М, если к нему добавить 2 мл 1 молекулярного раствора HCl
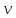 (HCl)=2*10-3*1=2*10-3
моль
(HCl)=2*10-3*1=2*10-3
моль
данное кол-во H+ связывается с ацетат ионами в молекулы уксусной кислоты, при этом концентрация соли в буферном растворе уменьш на 0,002 моль в литре, а конц кислоты возраст на ту же величину. При равенстве конц компонентов буферного раствора, его pH=силовому показателю слабого электролита, т.е. pH=pK
pH=pK+lg =4,76
+l
=4,76
+l =4.76+lg
=4.76+lg =4.74
=4.74
ΔpH=4.76-4.74=0.02
Др важнейшей характеристикой буферного раствора явл его буферная емкость(В) – кол-во эквивалентов сильной кислоты или щелочи, кот можно дабавить к 1 л буферного раствора, чтобы изменить его pH на 1.
Буферная емкость опр эквивалентно титрованием пробы буферного раствора сильной кислотой или щельчью известной концентрации, фиксируя при этом изменение pH.
Рассчет буф емкости по кислоте и основанию ведут по формулам
Ва=
Ba=
