
- •1.Основные понятия в химии: вещество, молекула, атом. Строение атома. Химический элемент. Изотопы. Атомная единица массы. Число Авогадро. Моль.
- •3.Понятие эквивалента вещества. Определение эквивалента. Определение эквивалентной массы кислот, оснований, солей, оксидов, простых веществ в овр. Закон эквивалентов. Объемный анализ.
- •5.Принципы и правила заполнения орбиталей. Принцип минимальной энергии. Принцип запрета Паули. Правило Хунда. Правило Клечковского.
- •6. Периодический закон и периодическая система
- •8. Ионная, металлическая, водородная связи. Влияние водородной связи на физико-химические свойства веществ.
- •9.Классификация неорганических соединений
- •10. Соли, их классификация, номенклатура, получение, химические свойства.
- •11.Скорость химической реакции. Гомогенные и гетерогенные реакции. Кинетическое уравнение реакции. Период полупревращения.
- •12.Влияние температуры на скорость реакции. Правило Вант-Гоффа. Энергия активации. Уравнение Аррениуса. Эндотермические и экзотермические реакции
- •13. Кинетика обратимых реакций. Химическое равновесие, выражение для константы равновесия, сдвиг химического равновесия. Принцип ле Шателье
- •14.Гомогенный и гетерогенный катализ, цели применения катализаторов. Ферментативный катализ и его особенности.
- •15. Тепловой эффект реакции. Первый закон термодинамики. Понятие энтальпии. Закон Гесса. Калорийность пищи.
- •16.Энтропия. Второй закон термодинамики. (постулат Планта): Энергия Гиббса.
- •18. Ионное произведение воды. Водородный и гидроксильный показатель (pH и pOh). Индикаторы. Расчет pH растворов слабых электролитов. Буферные растворы, расчет pH буферных систем.
- •19. Гидролиз солей. Степень и константа гидролиза. Расчет рН растворов солей, образованных слабой кислотой и сильным основанием, сильной кислотой и слабым основанием.
- •20 .Овр. Основные понятия. Метод электронного баланса. Метод полуреакций. Классификация овр.
- •21. Перманганатомерия; иодометрия: определение концентрации н2о2 и активного хлора в хлорной извести. Эквивалент в овр.
- •23.Коллигативные свойства, законы Рауля, закон Вант-Гоффа
- •24 . Комплексные соединения, классификация, структура, номенклатура. Химическая связь в кс.
- •25.Протеолитическая теория кислот и оснований.
- •26.Протолитический баланс.
- •27.Биогенные элементы- элементы ответственные за построение и жизнедеятельность клеток организма.
- •29Азот, его свойства. Аммиак. Кислородные соединения азота. Круговорот азота в природе.
- •30.Фосфор,его содинения
- •32.Кислород его свойства. Озон. Пероксид водорода его свойства. Круговорот кислорода в природе.
- •33.Сера
- •38. Сорбция и её виды: абсорбция, адсорбция. Коэффициент абсорбции. Удельная адсорбция. Уравнение Ленгмюра, его линейная аппроксимация.
- •39. Дисперсная система. Их классификация. Мицелла.
25.Протеолитическая теория кислот и оснований.
В основе данной теории лежит способность веществ отдавать или присоединять ион водорода Н+ (протон).
Кислота - молекула или ион, способная отдавать протон (донор-протон).
 HCl
Н+
+ Cl-
HCl
Н+
+ Cl-
 NH4+
NH3
+ H+
NH4+
NH3
+ H+
Основание - молекула или ион способный присоединять протон (акцептор-протон).
 OH-
+ H+
H2O
OH-
+ H+
H2O
Кислоты отдавая протон превращаются в частицу стремящиеся его присоединить, которые называются - сопряженное основание.
Основание принимающее протон превращается в частицу, стремящуюся его отдать, которая называется - сопряженной кислотой.
 Кислота
сопряженное основание + Н+
Кислота
сопряженное основание + Н+
 Основание
+ Н+
сопряженная кислота.
Основание
+ Н+
сопряженная кислота.
Совокупность кислоты и его сопряженного основания, а так же основания его сопряженной кислоты, образуют сопряженную кислотно-основную пару.
Омфалиты - молекулы или ионы способный как отдавать, так и принимать протоны, способный вступить в реакции характерные как для кислот так и для и оснований. (Классический омфалит вода Н2О).
 Н2О
+ HCl H3O+
+ Cl-
Н2О
+ HCl H3O+
+ Cl-
 H2O
+ NH3
NH4+
+ OH-
H2O
+ NH3
NH4+
+ OH-
Омфалитами так же являются ряд гидроксидов металлов (амфотерные основания), которые растворяются как в кислотах так и в щелочах.
 Zn(OH)2
+ 2HCl
ZnCl
+ 2H2O
Zn(OH)2
+ 2HCl
ZnCl
+ 2H2O
 Zn(OH)2
+ 2NaCl
Na2[Zn(OH)4]
Zn(OH)2
+ 2NaCl
Na2[Zn(OH)4]
К омфалитам так же относятся ряд биологически активных органических молекул, которые одновременно содержат функциональные группы ответственные за основные и кислотные свойства (аминокислоты, белки и др).
 O
O
H2N – CH2 - C
O - H
В молекуле глицина за основные свойства ответственны аминогруппа NH2, за кислотные - карбоксильная группа СООН.
В зависимости от рН среды в растворе глицина существует равновесие: в кислой среде (принимаемый протон выступает в качестве основания):
 O
O
 H2N
– CH2
– C
+ Н+
H2N
– CH2
– C
+ Н+
O–H
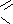 О
О
 H3N+
- СН2
– С
H3N+
- СН2
– С
О – Н
В щелочной среде (отдаваемый протон выступает в качестве кислоты):
 O
O
 H2N
– CH2
– C + ОН+
H2N
– CH2
– C + ОН+
O – H
 О
О
 H2N-
- СН2
– С + Н2О
H2N-
- СН2
– С + Н2О
О – Н
Общая, активная и потенциальная кислотность.
Содержание кислот в биологических жидкостях и в окружающей среде относятся к факторам влияющим на функционирование клеток, отдельных органов и организма в целом. Поэтому определение кислотности желудочного сока, крови, мочи относят к обязательным анализам, при диагностики заболевания.
Охрана окружающей среды так же требует постоянного контроля кислотности почвы, водоемов, осадков.
Кислотность подразделяется на:
Общую - [Н+]общ
Активную свободную - [Н+] акт
Потенциальную (связанною) - [ Н +]пот, которая измеряется в молл/л, в клинической практике в титрационных единицах.
Общая кислотность - концентрация ионов Н+ (свобод и связанных) присутствующих в растворе. Равна сумме нормальных концентраций всех кислот в растворе.
Общую кислотность определяют титрованием щелочью, в присутствие индикатора, точка эквивалентности которой (точкам перехода окраски) лежит в диапазон рН= 8-10 (слабощелочная среда). В качестве индикатора как правило используют фенолфталеин. (Титрование ведут до появления устойчивой, слабо розовой окраски).
Активные кислоты концентрации свободных ион Н+ присутствуют в растворах.
Ионы Н+ появляются как в результате диссоциации сильных кислот так и слабых, однако слабые кислоты, диссоциируют в незначительной степени и кроме того в присутствие сильных кислот их диссоциация подавляется, т.к в соответствии с принципами Леша-Терье равновесие смещается в сторону образования молекул слабой кислоты:
CH3COOH CH3COO- + H+
Поэтому под активной кислотностью, понимают суммарную нормальную концентрацию присутствующие в растворе сильных кислот.
Эту кислотность определяет либо инструментальными методами (ионамеры, рН - метры), либо титрование сильной щелочью, в присутствии индикатора точка эквивалентности которая лежит в диапазоне рН 2-4.
Если в качестве индикатора использовать метилоранж то титрование ведут до перехода окраски с розовой на желтый.
Потенциал (связанная) кислотность - концентрация ионов Н+ связанных с молекулами или ионами, слабых кислот. Определяют, как разность между общей и активной кислотностью, равна суммарной нормальной концентрации слабых кислот.
Для определения всех типов кислотности титрование проводят сил щелочью в присутствие двух индикаторов (метиловокрасный (активная кислотность), фенолфталеина (общая кислотность)).
Отмечают 2 точки эквивалентности:
При рН 2-4 определяет активную кислотность;
При рН 8-10 определяет общую кислотность.
По разности между общей и активной кислотностью определяют потенциальную (связанную кислотность):
[H+]пот = [H+]общ – [H+]акт
рН

В биохимических исследования при определении кислотности желудочного сока в качестве сильных кислот выступает НСl в качестве связанной кислоты - соли белкового происхождения, нейтрализация которой протекает по уравнению:
 [R-NH3+]Cl-
+ OH-
R*NH2
+ H2O
+ Cl-
[R-NH3+]Cl-
+ OH-
R*NH2
+ H2O
+ Cl-
При определении концентрации белковых солей для нахождения общей кислотности используют индикатор ализаминсульфоновокислый точка перехода окраски которого лежит в диапазоне рН 5-6,8. Концентрацию солей находят по разности между общей и активной кислотностью.
К клинической практике. Кислотность желудочного сока выражают в клинических (титрационных (т.е)) единицах - число мл 0,1 молярного раствора (NaOH) которое необходимо затратить на титрование 100 мл отфильтрованного желудочного сока.
При выполнении лабораторных работ для перехода от объема щелочи затраченного на титрование к титрационным единицам необходимо затраченный объем умножить на 10.
В норме общая кислотность желудочного сока должна составлять 40-60 т.е. При язве повышенная кислотность, при инфекционных заболеваниях, гастрите, раке - пониженная. В норме активных кислот - 20-40 т.е
