
- •1.Основные понятия в химии: вещество, молекула, атом. Строение атома. Химический элемент. Изотопы. Атомная единица массы. Число Авогадро. Моль.
- •3.Понятие эквивалента вещества. Определение эквивалента. Определение эквивалентной массы кислот, оснований, солей, оксидов, простых веществ в овр. Закон эквивалентов. Объемный анализ.
- •5.Принципы и правила заполнения орбиталей. Принцип минимальной энергии. Принцип запрета Паули. Правило Хунда. Правило Клечковского.
- •6. Периодический закон и периодическая система
- •8. Ионная, металлическая, водородная связи. Влияние водородной связи на физико-химические свойства веществ.
- •9.Классификация неорганических соединений
- •10. Соли, их классификация, номенклатура, получение, химические свойства.
- •11.Скорость химической реакции. Гомогенные и гетерогенные реакции. Кинетическое уравнение реакции. Период полупревращения.
- •12.Влияние температуры на скорость реакции. Правило Вант-Гоффа. Энергия активации. Уравнение Аррениуса. Эндотермические и экзотермические реакции
- •13. Кинетика обратимых реакций. Химическое равновесие, выражение для константы равновесия, сдвиг химического равновесия. Принцип ле Шателье
- •14.Гомогенный и гетерогенный катализ, цели применения катализаторов. Ферментативный катализ и его особенности.
- •15. Тепловой эффект реакции. Первый закон термодинамики. Понятие энтальпии. Закон Гесса. Калорийность пищи.
- •16.Энтропия. Второй закон термодинамики. (постулат Планта): Энергия Гиббса.
- •18. Ионное произведение воды. Водородный и гидроксильный показатель (pH и pOh). Индикаторы. Расчет pH растворов слабых электролитов. Буферные растворы, расчет pH буферных систем.
- •19. Гидролиз солей. Степень и константа гидролиза. Расчет рН растворов солей, образованных слабой кислотой и сильным основанием, сильной кислотой и слабым основанием.
- •20 .Овр. Основные понятия. Метод электронного баланса. Метод полуреакций. Классификация овр.
- •21. Перманганатомерия; иодометрия: определение концентрации н2о2 и активного хлора в хлорной извести. Эквивалент в овр.
- •23.Коллигативные свойства, законы Рауля, закон Вант-Гоффа
- •24 . Комплексные соединения, классификация, структура, номенклатура. Химическая связь в кс.
- •25.Протеолитическая теория кислот и оснований.
- •26.Протолитический баланс.
- •27.Биогенные элементы- элементы ответственные за построение и жизнедеятельность клеток организма.
- •29Азот, его свойства. Аммиак. Кислородные соединения азота. Круговорот азота в природе.
- •30.Фосфор,его содинения
- •32.Кислород его свойства. Озон. Пероксид водорода его свойства. Круговорот кислорода в природе.
- •33.Сера
- •38. Сорбция и её виды: абсорбция, адсорбция. Коэффициент абсорбции. Удельная адсорбция. Уравнение Ленгмюра, его линейная аппроксимация.
- •39. Дисперсная система. Их классификация. Мицелла.
15. Тепловой эффект реакции. Первый закон термодинамики. Понятие энтальпии. Закон Гесса. Калорийность пищи.
Тепловой эффект реакции – количество поглощённой или выделившейся в ходе реакции теплоты. Равен разности между Еа обратимой и прямой реакции.
Первый закон термодинамики – закон сохранения и превращения энергии (физик Мейер). Энергия не исчезает и не возникает из ничего., а только превращается из одного вида в другой в строго эквивалентных соотношениях. Если система в замкнутом объеме атомов, то поглощенная энергия идёт на изменение внутренней энергии.
Q = ∆ U = U2 – U1
Если система находится под постоянным давлением, то поглощаемая теплота идёт на увеличение внутренней энергии и на совершение работы против внешних сил.
Qp = ∆U + A
Сумма u + pv называют энтальпией и обозначают Н. Энтальпия – термодинамическая функция состояния системы, зависит только от начального и конечного состояния системы, но не зависит от пути перехода. Тепловой эффект реакции для изобарных процессов = изменению энтальпии. Термохимическое уравнение – уравнение в котором указан тепловой эффект реакции. Зная стандартные энтальпии образования по закону Гесса можно найти тепловой эффект реакции.
∆Н = ∑
Энтальпия реакции равна разности сумм энтальпии образования всех продуктов реакции и сумме энтальпии образования всех исходных веществ.
- стехеометрический коэффициент и энтальпия образования - продукта, - исходных веществ.
Al2O3 + 3SO2 => Al2(SO4)3
Калорийность пищи:
При окислении продуктов питания в организме выделяется теплота. Калорийность пищи – энергия, выделяемая при полном окислении 1г питательных веществ. Измеряется энергетическая ценность продуктов в кКалл/г
1калл = 4,19 Дж
Калл – количество теплоты, которое надо сообщить 1г воды чтобы нагреть его на 1С (масло сливы – 7,26, жир – 9)
16.Энтропия. Второй закон термодинамики. (постулат Планта): Энергия Гиббса.
Все химические процессы можно разделить на 2 типа:
Протекающие самопроизвольно (окисление металлов)
Не протекающие самопроизвольно
Самопроизвольным, или спонтанным, является процесс, который совершается в системе без затраты работы извне и который уменьшает работоспособность системы после своего завершения.
Критерии самопроизвольной протекании реакции является:
Энтальпический фактор – как правило самопроизвольно протекают процессы, идущие с выделением тепла.
Энтропийный фактор – в самопроизвольных процессах неупорядоченность системы возрастает.
Энтропия – термодинамическая функция, характеризующая меру неупорядоченности системы.
Энтропия может быть охарактеризована числом микросостояний:
Числом мгновенных координат и скоростей молекул, образующих химическую систему, так как это число огромно, то для количественной характеристики берется логарифм от числа микросостояний.
В этом случае энтропия
равна:
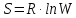 [
[ ]
(1)
]
(1)
Где R – газовая постоянная равна 8,31 Дж/моль∙К;
W – число микросостояний.
В отличии от внутренней энергии и энтальпии, которые измерить абсолютно невозможно, энтропию можно измерить непосредственно, что вытекает из 3 закона термодинамики (постулат Планта):
Энтропия индивидуального кристаллического вещества при абсолютном нуле равна нулю: S0=0.
Постулат планка справедлив только для индивидуальных веществ, кристаллы которых идеально построены (в кристаллической решетке все узлы заняты молекулами или атомами, правильно чередующимися и закономерно ориентированными). Такие кристаллы называются идеальными твердыми телами.
Max Энтропией обладают газы. При усложнении молекул(повышении числа атомов) энтропия также возрастает.
Энтропия вычисленная при стандартных условиях (T=298 К, 25 ̊С, р=1 атмосфере) называется стандартной энтропией S0 (табличные данные).
Изменения энтропии в ходе реакции находится по аналогии с изменениями энтальпии:
 (2)
(2)
Энтропия простых веществ ≠0
Второй закон термодинамики.
Второй закон термодинамики определяет направленность и пределы протекания самопроизвольных процессов, в том числе и биохимических.
В изолированных системах самопроизвольно идут только те процессы, которые сопровождаются увеличением энтропии (ΔS>0).
Таким образом, при протекании химических реакций возможно 2 противоположные тенденции:
Образование более прочных упорядоченных систем, сопровождающихся снижением энергии (Δh<0)$
Стремление к беспорядку количественно характеризуется возрастанием энтропии (ΔS>0).
Характер протекания химических процессов определяется соотношением этих 2-х факторов – энтальпийного и энтропийного.
Для неизолированных систем нужно учитывать не только изменения энтропии, но и изменение энергии.
Все процессы, при которых энергия в системе уменьшается, а энтропия возрастает, протекает самопроизвольно. Самопроизвольность других процессов зависит от того, какая из этих 2-х тенденций – энергетическая или энтропийная – скажется более эффективной, какая из этих противоборствующих тенденций получит перевес над другой.
Энергия Гиббса.
Биохимические реакции обычно происходят при изобарно-изотермических условиях. В этих случаях энергетическое состояние системы характеризуется энтальпией, а мерой неупорядоченности системы будет произведение ее энтропии и температуры. Функцией, учитывающей обе эти характеристики и противоположность в тенденции их изменения при самопроизвольных процессах, является энергия Гиббса.
Свободная энергия Гиббса (G) – термодинамическая функция объединяющая энтальпийный и энтропийный факторы и являющиеся критерием самопроизвольного протекания химический реакции.
 (3)
(3)
 –изменение энергии
Гиббса в ходе химической реакции;
–изменение энергии
Гиббса в ходе химической реакции;
 и
и
 - соответственно изменения энтальпии
и энтропии;
- соответственно изменения энтальпии
и энтропии;
T – температура, при которой протекает реакция.
Как следует из формулы (3) энергия Гиббса может быть сосчитана изменением энтальпии и энтропии с учетом
Исходя из полученного значения, можно судить о возможности протекания данной химической реакции.
Возможны следующие 3 случая:
 <0
– самопроизвольное протекание химической
реакции возможно;
<0
– самопроизвольное протекание химической
реакции возможно;
 >0
– реакция протекать самопроизвольно
не может;
>0
– реакция протекать самопроизвольно
не может;
 =0
– химическая система находится в
равновесие (обратима).
=0
– химическая система находится в
равновесие (обратима).
Энергия Гиббса. Образование вещества.
- изменение энергии Гиббса при образовании 1 моль вещества из простых веществ.
Если изменение энергии Гиббса рассматривать при стандартных условиях, то говорят о стандартном изменении энергии Гиббса.
 0
образование
простых веществ
принимается
равным 0.
0
образование
простых веществ
принимается
равным 0.
 0
– табличные данные
0
– табличные данные
Энергия Гиббса – термодинамическая функция зависит только отначального и конечного состояния системы поэтому изменение энергии Гиббса в ходе реакции вычисляется по полной аналогии с изменениями энтальпии и энтропии.
 (4)
(4)
При достижении равновесия химической системы константа равновесия связана со стандартными изменениями энергии Гиббса соотношение:
 (5)
(5)
Где
 - константа равновесия при температуре
Т
- константа равновесия при температуре
Т
Исходя из изменения энергии Гиббса в ходе реакции можно рассчитать константу равновесия при произвольной температуре Т:
 (6)
(6)
Также может быть
решена обратная задача: по экспериментальному
определению
 рассчитывает из уравнения (5) изменения
стандартной энергии Гиббса.
рассчитывает из уравнения (5) изменения
стандартной энергии Гиббса.
17. Электролитическая диссоциация (ЭД). Механизм ЭД. Степень и константа диссоциации, их взаимосвязь. Закон разбавления Оствальда.
По своей способности проводить электрический ток, все вещества можно разделить на электролиты – растворы или расплавы этих веществ проводят электрический ток, и неэлектролиты - растворы или расплавы этих веществ не проводят электрический ток.
Основные положения теории ЭД:
При растворении в воде молекулы электролитов распадаются (диссоциируют) на положительно и отрицательно заряженные ионы.
При пропускании постоянного электрического тока через растворы (расплавы) электролитов положительно заряженные ионы двигаются к отрицательно заряженному электроду (катоду) – катионы, отрицательно заряженные ионы к положительно заряженному электроду (аноду) – анионы.
Диссоциация – обратимый процесс: одновременно с распадом молекул на ионы протекает обратный процесс – образование из ионов исходных нейтральных молекул.
В основе электролитической диссоциации лежит взаимодействие ионного кристалла или поляризованных молекул с полярными молекулами растворителя (в частности, с молекулами воды).
За счет электростатического
направления диполи воды «вырывают»
поверхностные ионы в объеме раствора.
При этом ионы находятся в гидратированном
состоянии. Если в растворе присутствуют
полярные молекулы, то за счет
электростатического напряжения диполей
воды они подвергаются еще более глубокой
поляризации и, в конечном итоге,
распадаются на ионы. Реально ионы
 в водных растворах присутствуют в
гидратированном состоянии в виде ионов
гидроксония
в водных растворах присутствуют в
гидратированном состоянии в виде ионов
гидроксония ,
образование которого можно представить
как присоединение
,
образование которого можно представить
как присоединение к
к за счет донорно-акцепторной связи.
за счет донорно-акцепторной связи.
Количественно
процесс диссоциации характеризуется
степенью диссоциации
 -
отношение количества (концентрации)
молекул, распавшихся на ионы к общему
количеству исходной концентрации
молекул растворенного вещества:
-
отношение количества (концентрации)
молекул, распавшихся на ионы к общему
количеству исходной концентрации
молекул растворенного вещества:
 (1).
(1).
Молекулы сильных
электролитов практически полностью
диссоциируют в растворе ( стремится
к 1), молекулы слабых электролитов
диссоциируют в очень незначительных
степенях (
стремится
к 1), молекулы слабых электролитов
диссоциируют в очень незначительных
степенях ( намного
меньше 1).
намного
меньше 1).
В растворах слабых
электролитов имеет место равновесие,
которое характеризуется своей константой
равновесия – константой диссоциации
(для раствора слабых кислот -
 ,
для растворов слабых оснований -
,
для растворов слабых оснований - ).
).
Т.к. степень диссоциации и константа диссоциации характеризуют один и тот же процесс – диссоциацию слабого электролита, то между ними существует связь.
Определим ее на
примере диссоциации
 :
:



 +
+ =
= (2).
Выразим концентрацию продиссоциировавших
молекул через
(2).
Выразим концентрацию продиссоциировавших
молекул через и исходную концентрацию: [
и исходную концентрацию: [ ]=[
]=[
 ]=
]= *
* .
Непродиссоциировавших молекул в растворе
осталось:
.
Непродиссоциировавших молекул в растворе
осталось: -
- *
* =
= (1-
(1- ).
Подставим полученное выражение для
равновесной концентрации:
).
Подставим полученное выражение для
равновесной концентрации:
 =
= (3).
(3).
Так как для слабых
электролитов
 ,
то ее значением в знаменателе уравнения
(3) можно пренебречь. Тогда
,
то ее значением в знаменателе уравнения
(3) можно пренебречь. Тогда =
=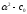
 .
.
 -
закон разбавления Оствальда: при снижении
концентрации в растворе слабого
электролита (разбавление раствора)
степень диссоциации возрастает.
-
закон разбавления Оствальда: при снижении
концентрации в растворе слабого
электролита (разбавление раствора)
степень диссоциации возрастает.
Константа диссоциации
слабых электролитов - табличные данные,
не зависят от концентрации ионов в
растворе, а зависят только от температуры.
Данное понятие применимо только для
слабых электролитов, т.к. для сильных
электролитов
 стремится
к 1, знаменатель уравнения (3) = 0 и
стремится
к 1, знаменатель уравнения (3) = 0 и теряет
смысл.
теряет
смысл.
К сильным электролитам относятся:
все растворимые
основания – щелочи (гидроксиды щелочных
и щелочноземельных металлов), кроме
 ;
;
ряд минеральных
кислот, все галогеноводородные (кроме
HF):
 и т.д.;
и т.д.;
практически все соли (в том числе и малорастворимые).
