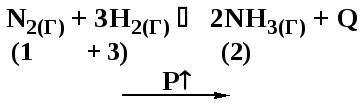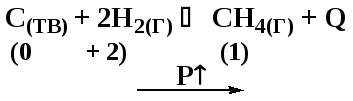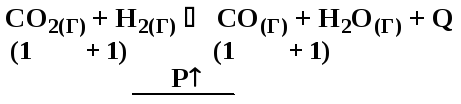- •Росжелдор
- •Введение
- •Демонстрационные тесты
- •Тема 1. Классы неорганических соединений
- •Тема 2. Термодинамика и направленность химических реакций
- •Тема 3. Химическая кинетика
- •Тема 4. Химическое равновесие
- •Тема 5. Строение атома. Периодическая система
- •Тема 6. Химическая связь
- •Тема 7. Растворы неэлектролитов
- •Тема 8. Растворы электролитов
- •Тема 9. Дисперсные системы
- •Тема 10. Окислительно-восстановительные реакции
- •Тема 11. Электрохимические процессы. Гальванический элемент. Коррозия металлов
- •Тема 12. Электрохимические процессы. Электролиз
- •Тема 13. Высокомолекулярные вещества
- •Тема 14. Химическая идентификация
- •Тема 15. Свойства элементов
- •Библиографический список
- •Содержание
- •Доронькин Владимир Николаевич
Росжелдор
Государственное образовательное учреждение
высшего профессионального образования
«Ростовский государственный университет путей сообщения»
(РГУПС)
В.Н.Доронькин, Ю.Ф.Мигаль, В.А.Февралева
РЕПЕТИЦИОННЫЕ ТЕСТЫ ПО ХИМИИ
Учебное пособие
Ростов-на-Дону
2009

Р ОСЖЕЛДОР
ОСЖЕЛДОР
Государственное образовательное учреждение
высшего профессионального образования
«Ростовский государственный университет путей сообщения»
(РГУПС)
В.Н.Доронькин, Ю.Ф.Мигаль, В.А.Февралева
РЕПЕТИЦИОННЫЕ ТЕСТЫ ПО ХИМИИ
Учебное пособие
Утверждено
методическим советом университета
Ростов-на-Дону
2009

УДК 541: 378
Доронькин В.Н., Мигаль Ю.Ф., Февралева В.А.
Репетиционные тесты по химии : учебное пособие / В.Н.Доронькин, Ю.Ф.Мигаль, В.А.Февралева ; Рост. гос. ун-т путей сообщения. – Ростов н/Д, 2009. – 150 с. Библиогр. : 4 назв.
Учебное пособие предназначено для подготовки студентов РГУПС к промежуточной и итоговой аттестации по общей химии, проводимой в тестовой форме. В пособии подробно разбирается методика поиска ответов на демонстрационные тесты, а также приводятся репетиционные тесты, предназначенные для подготовки к аттестации.
Книга предназначена для студентов всех специальностей, изучающих дисциплину «Химия».
Рецензенты: д-р хим. наук, проф. А.Г. Бережная (ЮФУ);
канд. техн. наук, доц. Г.Н. Соколова (РГУПС)
© Ростовский государственный университет
п утей
сообщения, 2009
утей
сообщения, 2009
Введение
Для подготовки к решению тестов по химии студентам следует изучать теоретический материал по учебникам общей химии, рекомендованным для использования в РГУПС [1 – 3], Пособию по общей химии (под ред. В.М. Виленского) [4] и, безусловно, по лекциям.
Содержание тестов соответствует государственному образовательному стандарту (ГОС) по химии, однако материал приводится в той последовательности, в которой читается курс общей химии в РГУПС.
В пособие включены как авторские разработки преподавателей кафедры химии, апробированные в последние годы в центре тестирования РГУПС, так и тесты, позволяющие осуществить углубленное изучение материала и, в частности, подготовку к интернет-экзамену по химии1. Внимательное изучение предлагаемых в этом пособии тестов позволит вам познакомиться с большинством заданий, которые могут встретиться при выполнении экзаменационного тестового опроса.
По содержанию тесты можно условно разделить на «тесты на узнавание» и тесты, требующие самостоятельного решения различных задач. Методика решения разъясняется в приводимых ниже демонстрационных примерах.
Демонстрационные тесты
Д1. Формулы нерастворимых оснований, солей и кислот соответственно указаны в ряду:
|
а) Mg(OH)2, HCl, Ca(NO3)2 |
в) Fe(OH)2, BaSO4, H2SiO3 |
|
б) Cu(OH)2, H2SiO3, FeS |
г) NaOH, Na2SO4, H2SO3 |
Основаниями называются сложные вещества, состоящие из атомов металла и одной или нескольких гидроксильных групп, например KOH, Ba(OH)2, Al(OH)3.
Кислотами называются сложные вещества, в состав которых входят атомы водороды, способные замещаться на атом металла, и кислотные остатки, например, HNO3, H3PO4, H2CO3.
Солями называются сложные вещества, в состав которых входят атомы металла (или катионы NH+4) и кислотные остатки, например
FeSO4, NH4NO3, CuCl2, NaHCO3, (CuOH)2CO3.
а) Mg(OH)2 – нерастворимое (проверяем по таблице растворимости) основание
HCl – растворимая кислота
Вывод: одно из веществ не соответствует условию.
б) Cu(OH)2 – нерастворимое основание
H2SiO3 – нерастворимая кислота
Вывод: нарушен порядок веществ, предложенный в условии – основание – соль – кислота.
в) Fe(OH)2 – нерастворимое основание
BaSO4 – нерастворимая соль
H2SiO3 – нерастворимая кислота.
Вывод: все вещества соответствуют условию.
Ответ: в).
Д2. Сокращенное ионное уравнение Al(OH)3 + 3H+ = Al3+ + 3H2O
соответствует взаимодействию
|
а) Al(OH)3 и H2CO3 |
в) Al(OH)3 и H2S |
|
б) Al(OH)3 и CH3COOH |
г) Al(OH)3 и HNO3 |
Составляем молекулярные и ионные уравнения реакций:
а) Al(OH)3 + H2CO3
б) Al(OH)3 + CH3COOH = Al(OH)2CH3COO + H2O
Al(OH)3 + CH3COOH = Al(OH)2+2 + CH3COO– + H2O
в) Al(OH)3 + H2S
г) Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O
Al(OH)3 + 3H+ = Al3+ + 3H2O
Ответ: г).
Д3. Система – это группа тел, которые
а) находятся в окружающей среде и отделены от окружающей среды поверхностью;
б) взаимодействуют друг с другом и изменяются в результате взаимодействия с окружающей средой;
в) находятся во взаимодействии и мысленно или фактически обособлены от окружающей среды;
г) находятся во взаимодействии, обособлены от окружающей среды и совершают работу против внешних сил.
«Системой называется совокупность находящихся во взаимодействии веществ, мысленно (или фактически) обособленных от окружающей среды». ([1], § IV.1 «Основные понятия и величины в химической термодинамике. Внутренняя энергия и энтальпия».)
Ответ: в).
Д4. Изохорный процесс протекает при постоянном (ой)
|
а) давлении |
в) объеме |
|
б) количестве вещества |
г) температуре |
«В зависимости от условий перехода системы из одного состояния в другое в термодинамике различают изотермические, изобарические, изохорические и адиабатические процессы. Первые – протекают при постоянной температуре (T = const), вторые – при постоянном давлении (P = const), третьи – при постоянном объеме (V = const), четвертые – в условиях отсутствия обмена теплотой между системой и окружающей средой (q = const)» ([1], § IV.1 «Основные понятия и величины в химической термодинамике. Внутренняя энергия и энтальпия».)
Ответ: в).
Д5. Мгновенную скорость гомогенной реакции вычисляют по формуле
|
а)
|
б)
|
в)
|
г)
|
«В химической
кинетике различают среднюю и истинную
(или мгновенную) скорость реакции.
Средняя скорость
![]() равна отношениюC/t(C=C2– –C1;t=t2–t1).
Чтобы величина скорости всегда была
положительной, перед дробью ставят
знаки «»:
равна отношениюC/t(C=C2– –C1;t=t2–t1).
Чтобы величина скорости всегда была
положительной, перед дробью ставят
знаки «»:
|
|
|
(V.1) |
Истинная скорость
химической реакции
![]() определяется пределом, к которому
стремится отношениеC/tприt→ 0, т.е. производной концентрации по
времени:
определяется пределом, к которому
стремится отношениеC/tприt→ 0, т.е. производной концентрации по
времени:
|
|
|
(V.2)» |
([1], § V.1 «Скорость химической реакции».)
Ответ: в).
Д6. Скорость прямой реакции CO2(Г) + СТВ 2CO(Г) ... , если увеличить давление в 4 раза.
|
а) увеличится в 4 раза |
в) увеличится в 2 раза |
|
б) увеличится в 16 раз |
г) уменьшится в 2 раза |
«Современная формулировка закона действующих масс такова: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции». ([1], § V.1 «Скорость химической реакции».)
Концентрацию
твердых веществ в выражение для скорости,
составленное по закону действующих
масс, не включают; для газов вместо
концентраций можно использовать
парциальные давления, поэтому
![]() .
.
Следовательно,
![]() .
.
Ответ: а)
Д7. В какой системе увеличение концентрации водорода смещает химическое равновесие влево?
|
а) C(ТВ) + 2H2(Г) CH4(Г) |
в) 2H2(Г) + O2(Г) 2H2O(Г) |
|
б) 2NH3(Г) N2(Г) + 3H2(Г) |
г) FeO(ТВ) + H2(Г) Fe(ТВ) + H2O(Г) |
«Направление смещения положения равновесия определяется принципом Ле-Шателье: если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет оказанное воздействие». ([1], § V.5 «Кинетические представления о химическом равновесии».)
На положение равновесия влияют только три фактора – концентрация (для растворов и газов), давление (для газообразных веществ) и температура. Любое другое воздействие – катализатор, ингибитор, перемешивание … – положение равновесия не изменяет, а только изменяет время его установления.
В качестве модели влияния концентрации удобно рассматривать систему сообщающихся сосудов:
|
а) исходная равновесная система |
|
|
б) при добавлении вещества (увеличении концентрации) происходит «перетекание», количество добавленного вещества уменьшается и положение равновесия смещается в сторону, ослабляющую оказанное воздействие |
|
|
в) при удалении вещества (уменьшении концентрации) происходит «перетекание», и положение равновесия смещается в сторону, ослабляющую оказанное воздействие |
|
При увеличении концентрации H2 положение равновесия будет смещаться в системе:
а) C(ТВ) + 2H2(Г) CH4(Г) – вправо, к продуктам реакции
б) 2NH3(Г) N2(Г) + 3H2(Г) – влево, в сторону исходных веществ
Ответ: б).
Д8. В какой системе при повышении давления химическое равновесие сместится в сторону исходных веществ?
а) N2(Г) + 3H2(Г) 2NH3(Г) + Q
б) C(ТВ) + 2H2(Г) CH4(Г)
в) CO2(Г) + H2(Г) CO(Г) + H2O(Г) + Q
г) N2O4(Г) 2NO2(Г) – Q
Направление смещения положения равновесия определяется принципом Ле-Шателье. Давление условно можно связывать с количеством газообразных веществ, входящих в состав равновесной системы. Очевидно, что при повышении давления система должна переходить в состояние с меньшим числом газообразных веществ, ослабляя оказанное воздействие.
Вычисляем количества газообразных веществ в левой и правой частях уравнения реакции:
|
а) |
|
– повышение давления будет смещать положение равновесия вправо |
|
б) |
|
– положение равновесия будет смещаться вправо при повышении давления |
|
в) |
|
– давление не влияет на положение равновесия |
|
г) |
|
– повышение давления смещает положение равновесия влево |
Ответ: г).
Д9. Какая электронная конфигурация внешнего энергетического уровня соответствует атому элемента VА группы?
|
а) 3s23p6 |
б) 2s22p5 |
в) 4s13d5 |
г) 4s24p3 |
Используя правила заполнения атомных орбиталей в многоэлектронном атоме (правила Клечковского), составляем полные электронные формулы атомов, находим число электронов и, следовательно, заряд ядра атома:
а) Э – 1s22s22p63s23p6, число электронов (2 + 2 + 6 + 2 + 6 = ) 18, следовательно Э = 18Ar, находится в главной подгруппе 8-й группы (группа 8А) 3-го периода.
б) Э – 1s22s22p5 , число электронов (2 + 2 + 5 = ) 9, следовательно, Э = 9F, находится во 2-м периоде, главной подгруппе 7-й группы (группа 7А).
в) Ожидаемая электронная формула Э – 1s22s22p63s23p64s23d4, однако более устойчивой (обладающей меньшей энергией) является 1s22s22p63s23p64s13d5 (происходит «проскок» электрона). Порядковый номер элемента 24, соответствует 24Cr, находится в 4-м периоде, побочной подгруппе 6-й группы (6Б группа).
г) Э – 1s22s22p63s23p64s23d104p3, элемент – 33As, находится в 4-м периоде, главной подгруппе 5-й группы (5А группа).
Ответ: г).
Д10. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
|
а) Li, Be, B, C |
в) Mg, Si, Cl, Ar |
|
б) Sb, As, P, N |
г) O, S, Se, Te |
|
Радиус атома по периоду убывает слева направо, по группе увеличивается сверху вниз.
|
|
Определяем положение элементов в периодической системе и закономерность изменения радиуса атома в группе элементов.
а) Li – находится в главной подгруппе 1-й группы 2-го периода
Be – находится в главной подгруппе 2-й группы 2-го периода
B – находится в главной подгруппе 3-й группы 2-го периода
C – находится в главной подгруппе 4-й группы 2-го периода
Вывод: элементы одного периода, радиус атома в рассматриваемой последовательности уменьшается.
б) Sb – находится в главной подгруппе 5-й группы 5-го периода
As – находится в главной подгруппе 5-й группы 4-го периода
P – находится в главной подгруппе 5-й группы 3-го периода
N – находится в главной подгруппе 5-й группы 2-го периода
Вывод: элементы одной группы, радиус атома в рассматриваемой группе уменьшается.
в) Mg – находится в главной подгруппе 2-й группы 3-го периода
Si – находится в главной подгруппе 4-й группы 3-го периода
Cl – находится в главной подгруппе 7-й группы 3-го периода
Ar – находится в главной подгруппе 8-й группы 3-го периода
Вывод: элементы одного периода, радиус атома в рассматриваемой последовательности уменьшается.
г) O – находится в главной подгруппе 6-й группы 2-го периода
S – находится в главной подгруппе 2-й группы 3-го периода
Se – находится в главной подгруппе 4-й группы 4-го периода
Te – находится в главной подгруппе 5-й группы 5-го периода
Вывод: элементы одной группы, радиус атома в рассматриваемой группе увеличивается.
Ответ: г).
Д11. Кислотные свойства водородных соединений усиливаются в ряду:
|
а) HI – HBr – HCl – HF |
в) HF – NH3 – H2O – CH4 |
|
б) HCl – H2S – PH3 – SiH4 |
г) H2O – H2S – H2Se – H2Te |
|
В группе, так как увеличивается радиус атома и, соответственно, увеличивается длина связи Э – Н, то кислотные свойства соединений H2Э усиливаются сверху вниз.
|
|
По периоду кислотно-основные свойства летучих водородных соединений изменяются в следующей последовательности: соединения элементов 4-й группы (CH4 …) индифферентны, то есть не взаимодействуют с кислотами и щелочами; водородные соединения элементов 5-й группы проявляют основные свойства (NH3, PH3, …) и далее, при переходе к элементам 7-й группы, происходит усиление кислотных свойств (HF, HCl,…).
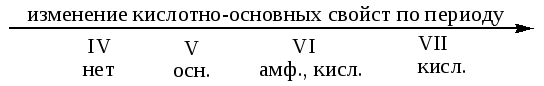
а) I находится в главной подгруппе 7-й группы 5-го периода
Br находится в главной подгруппе 7-й группы 4-го периода
Cl находится в главной подгруппе 7-й группы 3-го периода
F находится в главной подгруппе 7-й группы 2-го периода
Вывод: соединения образованы элементами одной группы, кислотные свойства ослабевают.
б) Cl находится в главной подгруппе 7-й группы 3-го периода
S находится в главной подгруппе 6-й группы 3-го периода
P находится в главной подгруппе 5-й группы 3-го периода
Si находится в главной подгруппе 4-й группы 3-го периода
Вывод: соединения образованы элементами одного периода, кислотные свойства ослабевают.
в) F находится в главной подгруппе 7-й группы 2-го периода
N находится в главной подгруппе 5-й группы 2-го периода
O находится в главной подгруппе 6-й группы 2-го периода
C находится в главной подгруппе 4-й группы 2-го периода
Вывод: соединения образованы элементами одного периода, кислотные свойства изменяются не закономерно.
г) O находится в главной подгруппе 6-й группы 2-го периода
S находится в главной подгруппе 6-й группы 3-го периода
Se находится в главной подгруппе 6-й группы 4-го периода
Te находится в главной подгруппе 6-й группы 5-го периода
Вывод: соединения образованы элементами одной группы, кислотные свойства усиливаются.
Ответ: г).
Д12. Вещества с ковалентной полярной связью находятся в ряду:
|
а) CO, HF, N2 |
в) NH3, SF6, H2S |
|
б) KF, HF, CF4 |
г) SO2, NO2, Cl2 |
Ковалентные полярные связи образуются между атомами различных неметаллов (H–Cl, N–H, P–O, …).
Взаимодействие атомов металла и неметалла приводит к возникновению ионной связи (Na–Cl, Mg–O, K–S,…).
а) C – неметалл, O – неметалл, в CO связь ковалентная полярная
H – неметалл, F – неметалл, в HF связь ковалентная полярная
N – неметалл, в N2 – связь ковалентная неполярная (простое вещество, образованное одинаковыми атомами)
Вывод: не удовлетворяет условию задания.
б) K – металл, F – неметалл, в KF связь ионная
Вывод: прекращаем рассмотрение этой группы веществ, так как KF не удовлетворяет условию.
в) N – неметалл, H – неметалл, в NH3 связь ковалентная полярная
S – неметалл, F – неметалл, в SF6 связь ковалентная полярная
H – неметалл, S – неметалл, в H2S связь ковалентная полярная
Вывод: все вещества удовлетворяют условию задания.
Ответ: в).
Д13. Низшую степень окисления хром проявляет в соединении:
|
а) К2Cr2O7 |
в) Cr2O3 |
|
б) Na[Cr(H2O)2F4] |
г) Cr(OH)2 |
Степень окисления – формальный заряд атома в молекуле, вычисленный исходя из предположения что все электронные пары смещены в сторону атома
с большей электроотрицательностью.
Cтепень окисления водорода в соединениях с неметаллами +1, кислорода –2 (кроме пероксидов), калия и натрия +1, фтора –1; для определения соединения, в котором степень окисления хрома минимальная, составляем уравнения электронейтральности молекулы и определяем значения степеней окисления хрома:
а) K2Cr2O7: K+2CrX2O–27 2(+1) + 2X +7(–2) = 0, X = +6, Cr+6
б) CrO3: CrXO–23 X + 3(–2) = 0, X = +6, Cr+6
в) Na[Cr(H2O)2F4]: Na +[CrX (H+2O–2)2 F–4]
+1 +X + 2[2(+1) + (–2)] + 4(–1) = 0, X = +3, Cr+3
г) Cr(OH)2: CrX(O–2H+)2 X + 2[(–2) + (+1)] = 0, X = 2, Cr+2
Ответ: г).
Д14. Оксид серы (IV) является восстановителем в реакции:
|
а) SO2 + CaO = CaSO3 |
в) SO2 + 2H2S = 3S + 2H2O |
|
б) 2SO2 + O2 = 2SO3 |
г) SO2 + 2NaOH = Na2SO3 + H2O |
Восстановитель в окислительно-восстановительной реакции окисляется, отдает электроны и повышает свою степень окисления.
Вычисляем степени окисления и находим уравнение реакции, в которой сера, входящая в состав SO2, повышает свою степень окисления.
а) S+4O–2 + Ca+2O–2 = Ca+2S+4O–23
б) 2S+4O–2 + O02 = 2S+6O3
Ответ: б).
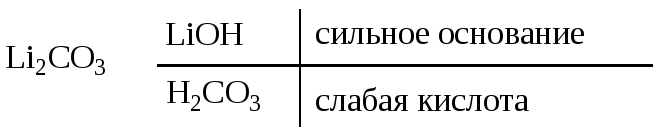
Д15. Среда раствора карбоната лития:
|
а) щелочная |
в) слабокислая |
|
б) кислая |
г) нейтральная |
Гидролизом называется реакция обменного взаимодействия соли с водой, в результате которой образуется слабый электролит (схема 1). Этот процесс происходит при растворении соли в воде.
![]()
В результате гидролиза изменяется кислотность среды в кислую (pH < 7) или щелочную (pH > 7) сторону. Принципы определения возможности протекания гидролиза и ионные уравнения приведены на схеме 1.
( М – металл, Аn – кислотный остаток)
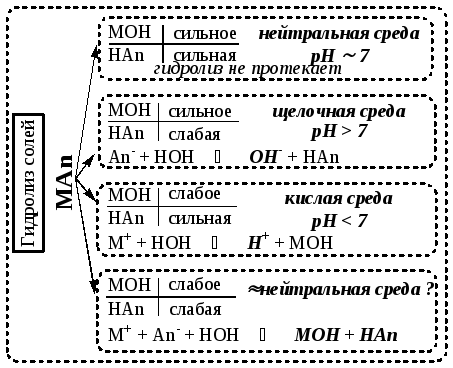
Схема 1. Общая схема гидролиза солей
|
|
– гидролиз происходит, среда щелочная |
Ответ: а).
Д16. Установите соответствие между формулой соли и типом гидролиза этой соли.
|
ФОРМУЛА СОЛИ |
ТИП ГИДРОЛИЗА |
|
а) (NH4)2CO3 |
1) по катиону |
|
б) NH4Cl |
2) по аниону |
|
в) Na2CO3 |
3) по катиону и аниону |
|
г) NaNO2 |
|
Определение возможности протекания процесса гидролиза было подробно рассмотрено в вопросе Д15 и схеме 1.
1) (NH4)2CO3 – карбонат аммония – образован слабым основанием NH4OH и слабой кислотой H2CO3, гидролиз происходит и по катиону, и по аниону (а – 3).
2) NH4Cl: – хлорид аммония – образован слабым основанием NH4OH и сильной соляной кислотой, гидролиз происходит по катиону (б – 1).
3) Na2CO3 – карбонат натрия – образован сильным основанием NaOH и слабой угольной кислотой H2CO3, гидролиз происходит по аниону (в – 2).
4) NaNO2 – нитрит натрия – образован сильным основанием NaOH и слабой азотистой кислотой HNO2, гидролиз по аниону (г – 2).
Ответ: а – 3; б – 1; в – 2; г – 2.
Д17. Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе её водного раствора.
|
ФОРМУЛА СОЛИ |
ПРОДУКТ НА АНОДЕ |
|
а) Al(NO3)3 |
1) H2 |
|
б) LiBr |
2) O2 |
|
в) Ca(NO3)2 |
3) NO2 |
|
г) KCl |
4) NO |
|
|
5) Cl2 |
|
|
6) Br2 |
Электролизом называется окислительно-восстановительная реакция, которая протекает на электродах при пропускании через раствор или расплав электролита электрического тока.
На катоде более легко восстанавливаются частицы с наибольшим электродным потенциалом. Продукты восстановления определяются величиной стандартного электродного потенциала металла (схема 2).

Схема 2. Катодные процессы при электролизе
На аноде может происходить либо процесс окисления материала растворимого (металлического, кроме платины) анода, либо окисление бескилородного аниона или молекул воды (схема 3).
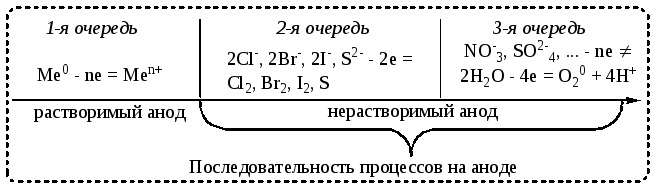
Схема 3. Последовательность процессов окисления на аноде
1) Al(NO3)3 – нитрат алюминия – образован катионом алюминия и анионом кислородсодержащей кислоты, анодная реакция (см. схему 3)
2H2O – 4e = O02 + 4H+
Вывод: выделяется O2 и в растворе накапливается HNO3 (а –2).
2) LiBr – бромид лития – содержит катион Li+ (Li в ряду активности находится левее, чем Al) и бескислородный анион Br–; анодная реакция (см. схему 3)
2Br– – 2e = Br02
Вывод: ответ б – 6.
3) Ca(NO3)2 – нитрат кальция, образован катионом Ca2+ и анионом кислородсодержащей кислоты, анодный процесс (см. схему 3)
2H2O – 4e = O02 + 4H+
Вывод: образуется O2, ответ в – 2.
4) KCl – хлорид калия – образован катионом K+ и бескислородным анионом Cl–; анодный процесс (см. схему 3)
2Cl– – 2e = Cl02
Вывод: ответ г – 5.
Ответ: а – 2; б – 6; в – 2; г – 5.
Д18. Какие из металлов – алюминий, никель, серебро, магний – можно использовать для защиты железа от атмосферной коррозии?
|
а) алюминий |
б) серебро |
в) магний |
г) никель |
При контакте двух
металлов более активный из них окисляется
(разрушается), а на менее активном
происходит процесс восстановления
окислителя и этот металл защищен от
коррозии. По величинам стандартных
электродных потенциалов (![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() )
определяем: более активными, чем железо,
являются алюминий и магний (
)
определяем: более активными, чем железо,
являются алюминий и магний (![]() <
<![]() <
<![]() <
<![]() <
<![]() ).
).
Ответ: а, в.
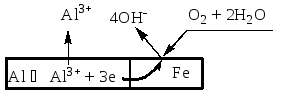
Д19. Анодный процесс, протекающий при коррозии железных пластин, скрепленных алюминиевыми заклепками, во влажном воздухе, описывается уравнением:
|
а) Al0 – 3e = Al3+ |
г) Fe0 – 2e = Fe2+ |
|
б) O2 + 2H2O + 4e = 4OH– |
д) Fe2+ + 2e = Fe0 |
|
в) Al3+ + 3e = Al0 |
е) O2 + 4e = 2O2– |
При контакте двух
металлов более активный из них окисляется
(разрушается) и является анодом, а на
менее активном (катоде) происходит
процесс восстановления окислителя. По
величинам стандартных электродных
потенциалов определяем: алюминий более
активный металл, чем железо (![]() )
< (
)
< (![]() ),
и будет анодом.
),
и будет анодом.
|
|
|
|
Электронные уравнения процессов:
|
А)
Al0
–
3 |
ּ4 |
|
|
К)
O02
+ 2H2O
+ 4 |
ּ3 |
|
4Al0 + 3O02 + 6H2O = 4Al3+ + 12OH–
Молекулярное уравнения:
Первичный процесс коррозии: 4Al + 3O2 + 6H2O = 4Al(OH)3
Вторичный процесс, протекающий при коррозии: гидроксид алюминия разлагается с выделением H2O
2Al(OH)3
![]() 3H2O
+ Al2O3
3H2O
+ Al2O3
Ответ: а).