1. 2.
где X = O, NH.
Образовавшиеся структуры (1) и (2) лишены ароматичности, и в дальнейшем происходит либо разрыв цикла с образованием полимера (наиболее вероятный процесс для фурана), либо полимеризация с сохранением цикла.
Таким образом, фуран и пиррол в присутствии минеральных кислот осмоляются, образуя полимерные продукты темного цвета. Такое отношение к кислотам называется ацидофобностью. Тиофен из-за своей жесткой ароматической структуры обладает ацидофобностью, но в меньшей степени. Это связано со способностью атома серы в данных условиях изменять свою гибридизацию и неспособностью образовывать сульфониевые соли [4].
В реакциях электрофильного замещения в тиофене, фуране и пирроле в первую очередь замещается атом водорода при α-углеродном атоме, если это положение занято, то замещение протекает по β-положению.

Для сульфирования фурана и пиррола используют мягкий сульфирующий реагент — пиридинсульфотриоксид [4]:

где X = O, NH.
Тиофен легко сульфируется концентрированной серной кислотой на холоде:
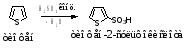
Нитрование фурана, пиррола и тиофена проводят ацетилнитратом — продуктом взаимодействия азотной кислоты с уксусным ангидридом (мягкий нитрующий агент):


При ацилировании ацидофобных гетероциклов в качестве ацилирующих реагентов используют ангидриды карбоновых кислот в присутствии катализаторов — кислот Льюиса (олова тетрахлорид, цинка хлорид и др.). Тиофен ацилируют хлорангидридами карбоновых кислот в присутствии катализатора — хлорида алюминия, хлорида олова, хлорида титана [4]:

Прямое галогенирование фурана и пиррола протекает очень бурно, реакция поддается контролю с трудом и может привести к разрушению гетероциклических ядер. Галогенирование осуществляют с помощью сульфурилхлорида. Происходит постепенное замещение атомов водорода на галогены. Тиофен галогенируется на холоде непосредственным действием галогена (хлора или брома). Образуются моно-, ди-, три- и тетразамещенные производные тиофена [4]:

1.3 Формилирование пятичленных гетероциклов
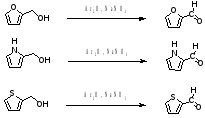
Формилирование пятичленных гетероциклов проходит в основном с образованием альдегидов с хорошими выходами. Одним из способов получения карбальдегидов фурана является гидролиз ацеталей. Синтез проводится с FeCl3 в этаноле при нагревании до 70˚С. За ходом реакции следят при помощи ТСХ, растворитель отгоняют при пониженном давлении [5]:

Также гидролиз проводится с трибромидом индия в воде при нагревании или с кремнеземом фосфорной кислоты в метаноле при температуре до 20 ˚С [6,7].
По Перкину формилирование протекает при взаимодействии гетероциклического спирта с ангидридом карбоновой кислоты в присутствии катализаторов основного характера (щелочных солей карбоновых кислот, третичных аминов и т. п.) [8].
По реакции Сузуки фенилбороновые кислоты и галогензамещенные карбальдегиды в присутствии карбоната натрия, тетракис (трифенилфосфин) палладия (0), диметилого эфира этиленгликоля и этанола в течение часа при нагревании до 90 ˚С сшиваются [9].
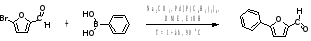
Широкое применение в реакциях формилирования достигли металлорганические катализаторы.
Галогензамещенный карбальдегид с диацетат палладием, карбонатом цезия, трифенилфосфином в 1-метилпирролидин-2-оне [10]:

Хлорангидрид тиофена в присутствии Pd-BaSO4 , водорода и ксилола при нагревании до 140 ˚С [11]:

Для получения 5-фенилпиррол-2-карбальдегида характерна реакция с гидроксидом натрия в тетрагидрофуране [12]:


Одним из основных способов введения карбонильной группы является реакция Вильсмайера-Хаака, состоящая из двух стадий - образование реагента Вильсмайера-Хаака и его присоединение. Реагент представляет собой слабый электрофил, поэтому реакция лучше протекает с электронообогащенными карбо- и гетероциклами.В случае пятичленных гетероциклов формильная группа вводится в положение 2 или 5.
Классический пример именной реакции реакция 2-фенилфурана с
N,N-диметил-формамидом и трихлорфосфатом [13]:
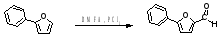
2-фенилпиррол реагирует с трихлорфосфатом в присутствии 1,2-дихлор-этана и N,N-диметил-формамида [14]:

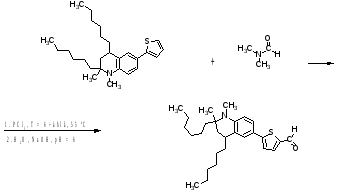
Арилзамещенные тиофены активно вступают в реакцию Вильсмайера-Хаака. Реакция может проходить в несколько стадий:
1 стадия: с трихлорфосфатом в течение 6 часов при температуре 55˚С и в инертной атмосфере;
2 стадия: с водой, гидроксидом натрия при рН = 6 и охлаждении на бане со льдом [15].
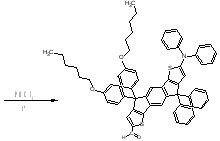
Так же реакция может проходить в одну стадию с трихлорфосфатом при температуре 0 ˚С или с трихлорфосфатом в течение 5 часов при температуре
0 – 80 ˚С [16, 17]:

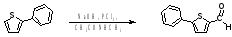
2-Фенилтиофен вступает в реакцию с гидроксидом натрия, трихлорфосфатом в N-метил-ацетамиде [18]:
1.4 Методы получения карбанитрильных групп в ароматическом ряду
Нитрилы широко применяются в органическом синтезе и являются переходным соединением для получения лекарств, аминокислот, витаминов, пестицидов и полимеров [19].
Общим методом получения нитрилов для тиофена и фурана является реакция с трихлорид галлием в 1,2-дихлорэтане в инертной атмосфере при температуре 120 ˚С [20]:
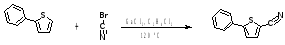

Для арилзамещенных фурана возможен синтез нитрила с помощью реакции уксусного ангидрида при нагревании в течение 2,5 часов [21].

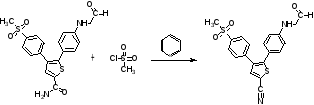
Получение нитрилов в ряду арилзамещенных тиофена в основном состоит из сшивок. Реакция возможна с бромидом тетрабутиламмония, диацетатом палладия, карбонатом калия в воде и ацетонитрилом в инертной среде при нагревании [22]:

Галогензамещенный нитрил может реагировать с бензолом при 20 ˚С и облучении [23]:
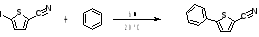
Также реакция протекает в пиридине [24]: