
биохимия (Восстановлен)
.pdfЧасть глюкозы (более половины) через капилляры кишечных ворсинок попадает в кровеносную систему и по воротной вене доставляется в печень. Остальное количество глюкозы поступает в клетки других тканей.
Б. Транспорт глюкозы из крови в клетки
Потребление глюкозы клетками из кровотока происходит также путѐм облегчѐнной диффузии. Следовательно, скорость трансмембранного потока глюкозы зависит только от градиента еѐ концентрации. Исключение составляют клетки мышц и жировой ткани, где облегчѐнная диффузия регулируется инсулином (гормон поджелудочной железы). В отсутствие инсулина плазматическая мембрана этих клеток непроницаема для глюкозы, так как она не содержит белки-переносчики (транспортѐры) глюкозы. Транспортѐры глюкозы называют также рецепторами глюкозы. Например, описан транспортѐр глюкозы, выделенный из эритроцитов. Это трансмембранный белок, полипептидная цепь которого построена из 492 аминокислотных остатков и имеет доменную структуру. Полярные домены белка расположены по разные стороны мембраны, гидрофобные располагаются в мембране, пересекая еѐ несколько раз. Транспортѐр имеет участок связывания глюкозы на внешней стороне мембраны. После присоединения глюкозы конформация белка изменяется, в результате чего глюкоза оказывается связанной с белком в участке, обращѐнном внутрь клетки. Затем глюкоза отделяется от транспортѐра, переходя внутрь клетки (см. раздел
5).
Считают, что способ облегчѐнной диффузии по сравнению с активным транспортом предотвращает транспорт ионов вместе с глюкозой, если она транспортируется по градиенту концентрации.
Глюкозные транспортѐры (ГЛЮТ) обнаружены во всех тканях. Существует несколько разновидностей ГЛЮТ (табл. 7-1), они пронумерованы в соответствии с порядком их обнаружения.
Структура белков семейства ГЛЮТ отличается от белков, транспортирующих глюкозу через мембрану в кишечнике и почках против градиента концентрации.
Описанные 5 типов ГЛЮТ имеют сходные первичную структуру и доменную организацию.
ГЛЮТ-1 обеспечивает стабильный поток глюкозы в мозг;
ГЛЮТ-2 обнаружен в клетках органов, выделяющих глюкозу в кровь. Именно при участии ГЛЮТ-2 глюкоза переходит в кровь из энтероцитов и печени. ГЛЮТ-2 участвует в транспорте глюкозы в β- клетки поджелудочной железы;
ГЛЮТ-3 обладает большим, чем ГЛЮТ-1, сродством к глюкозе. Он также обеспечивает постоянный приток глюкозы к клеткам нервной и других тканей;
ГЛЮТ-4 - главный переносчик глюкозы в клетки мышц и жировой ткани;
ГЛЮТ-5 встречается, главным образом, в клетках тонкого кишечника. Его функции известны недостаточно.
Все типы ГЛЮТ могут находиться как в плазматической мембране, так и в цитозольных везикулах. ГЛЮТ-4 (и в меньшей мере ГЛЮТ-1) почти полностью находятся в цитоплазме клеток. Влияние инсулина на такие клетки приводит к перемещению везикул, содержащих ГЛЮТ, к плазматической мембране, слиянию с ней и встраиванию транспортѐров в мембрану. После чего возможен облегчѐнный транспорт глюкозы в эти клетки. После снижения концентрации инсулина в крови транспортѐры глюкозы снова перемещаются в цитоплазму, и поступление глюкозы в клетку прекращается (рис. 7-19).
Перемещение глюкозы из первичной мочи в клетки почечных канальцев происходит вторичноактивным транспортом, подобно тому, как это осуществляется при всасывании глюкозы из просвета кишечника в энтероциты. Благодаря этому глюкоза может поступать в клетки даже в том случае, если еѐ концентрация в первичной моче меньше, чем в клетках. При этом глюкоза реабсорбируется из первичной мочи почти полностью (99%).
Известны различные нарушения в работе транспортѐров глюкозы. Наследственный дефект этих белков может лежать в основе инсулинонезависимого сахарного диабета (см. раздел 11). В то же время причиной нарушения работы транспортѐра глюкозы может быть не только дефект самого белка. Нарушения функции ГЛЮТ-4 возможны на следующих этапах:
передача сигнала инсулина о перемещении этого транспортѐра к мембране;
перемещение транспортѐра в цитоплазме;

включение в состав мембраны;
отшнуровывание от мембраны и т.д.
56.Глюкоза как важный метаболит углеводного обмена: общая схема источников и путей расходования глюкозы в организме. Поддерживание постоянного уровня глюкозы крови, количественное определение глюкозы крови.
В организме человека имеется несколько десятков различных моносахаридов и очень много (тысячи) разных олиго- и полисахаридов. Функции углеводов в организме заключаются в следующем.
Углеводы служат источником энергии: за счет их окисления удовлетворяется примерно половина всей потребности человека в энергии. В энергетическом обмене главная роль принадлежит глюкозе и гликогену.
Углеводы входят в состав структурно-функциональных компонентов клеток. К ним относятся пентозы нуклеотидов и нуклеиновых кислот, углеводы гликолипидов и гликопротеинов, гетерополисахариды межклеточного вещества.
Из углеводов в организме могут синтезироваться соединения других классов, в частности липиды и некоторые аминокислоты.
Таким образом, углеводы выполняют разнообразные функции, но главная функция углеводов - энергетическая.
Наиболее распространенный углевод животных - глюкоза. Именно в форме глюкозы поступает в кровь основная масса углеводов пищи. В глюкозу превращаются углеводы в печени и из глюкозы могут образовываться все остальные углеводы. Глюкоза используется как основной вид топлива в тканях млекопитающих. Таким образом, она играет роль связующего между энергетическими и пластическими функциями углеводов. Источником углеводов организма служат углеводы пищи - главным образом крахмал, а также сахароза и лактоза. Кроме того, глюкоза может образовываться в организме из аминокислот, а также из глицерина, входящего в состав жира.
В результате сложного взаимодействия описанных выше процессов создается тонко сбалансированное равновесие, обеспечивающее постоянный уровень глюкозы в циркулирующей крови. Если глюкоза не поступает с пищей, то у здорового человека в крови поддерживается постоянная концентрация глюкозы от 70 до 90 мг/100 мл. После приема содержащей углеводы пищи концентрация глюкозы на короткое время
возрастает примерно до 150 мг/ 100 мл, но через 2 ч она обычно возвращается к норме. Печень действует как первая буферная система; она удаляет поступающие по воротной вене моносахариды, образующиеся при переваривании пищи, и превращает их в глюкозу, а затем в гликоген. Поступление избытка глюкозы приводит к повышению ее концентрации в общем кровотоке, что в свою очередь стимулирует поглощение глюкозы периферическими тканями (мышцы, жировая клетчатка и другие). Достигая поджелудочной железы, избыточная концентрация глюкозы крови стимулирует выделение инсулина клетками островков Лангерганса; инсулин вызывает дальнейшее усиление поглощения глюкозы периферическими тканями. Как было отмечено выше, инсулин также стимулирует использование глюкозы для синтеза гликогена и подавляет образование глюкозы в ходе реакций глюконеогенеза; инсулин представляет собой главный действующий по принципу отрицательной обратной связи агент, участвующий в снижении содержания глюкозы в крови до нормальных величин после гипергликемии. Во время длительного голодания клетки почек также вносят значительный вклад в поддержание постоянного уровня глюкозы в крови. Другие ткани участвуют лишь в удалении глюкозы из внеклеточных жидкостей, поскольку в этих тканях отсутствует глюкозо-6-фосфатаза, необходимая для превращения других углеводных соединений в свободную глюкозу. Снижение концентрации глюкозы в крови, достигающей поджелудочной железы, стимулирует выделение островковыми клетками глюкагона. Этот гормон оказывает избирательное действие на печень, ускоряя гликогенолиз и способствуя повышению уровня глюкозы в крови. Таков кратковременный и быстро действующий ответ на лишение организма пищи, но он не обеспечит поддержания уровня глюкозы более чем на 24 ч; по истечении этого времени запасы гликогена в печени оказываются истощенными. Вторую линию обороны держит кора надпочечников, которая включается в эти процессы при длительном голодании, выделяя глюкокортикоиды. Эти гормоны стимулируют более медленный синтез ферментов глюконеогенеза в печени и усиливают распад белков в других тканях, что обеспечивает процесс глюконеогенеза углеродсодержащими субстратами. Поскольку этим эффектам в норме противодействует инсулин, реагирующий на гипергликемию. Очевидно, что именно сочетание и согласованность действия этих взаимосвязанных факторов, определяющих совершенство регуляции уровня глюкозы в крови, обеспечивает приспособление обмена углеводов в целом организме к изменяющимся условиям питания, роста, активности и другим физиологическим функциям.
Методы определение глюкозы в крови
Определение глюкозы в крови – важный этап, чтобы диагностировать сахарный диабет. Для этого необходимо определить состояние углеводного обмена, а в первую очередь содержание глюкозы в крови. В норме ее концентрация лежит в пределах 3, 3-5, 5 ммоль/л. Существует огромное количество методик определения, позволяющих установить глюкозы в крови.
Среди них можно выделить редуктометрические, колориметрические, ферментативные методы определения:
Редуктометрические методы определения. Основаны на способности сахаров, в частности глюкозы, восстанавливать соли тяжелых металлов в щелочной среде. Существуют различные реакции. Одна из них заключается в восстановлении красной кровяной соли в желтую кровяную соль сахарами при условии кипячения и щелочной среде. После этой специфической реакции путем титрования определяется содержание сахаров. Но этот метод не нашел широкого применения в клинике из-за своей трудоемкости и недостаточной точности;
Колорометрические методы определения. Глюкоза способна реагировать с различными соединениями, в результате чего образуются новые вещества определенной окраски (так называемые «цветные реакции»). По степени окраски раствора с помощью специального прибора (фотоколориметра) судят о концентрации глюкозы в крови. Примером такой реакции может послужить метод Самоджи. В основе его лежит реакция восстановление глюкозой гидрата окиси меди, в результате чего образуется молибденовая лазурь.
Ферментативные методы определения концентрации глюкозы в крови наиболее распространены. Выделяют две основные разновидности этих методов: глюкозооксидазный и гексокиназный. На данный момент наиболее распространенными являются глюкозооксидазные методы определения. Они основаны на применении фермента глюкозооксидазы. Этот фермент реагирует с глюкозой, в результате чего образуется перекись водорода. Количество образовавшейся перекиси водорода равно количеству глюкозы в исходной пробе.
Гексокиназный метод определения также является высокоспецифичным и точным, поэтому нашел широкое применение в клинической практике.
57. Аэробный гликолиз. Последовательность реакций до образования пирувата (аэробный гликолиз). Физиологическое значение аэробного гликолиза. Использование глюкозы для синтеза жиров.
Катаболизм глюкозы - основной поставщик энергии для процессов жизнедеятельности организма.
А. Основные пути катаболизма глюкозы
Окисление глюкозы до СО2 и Н2О (аэробный распад). Аэробный распад глюкозы можно выразить суммарным уравнением:
С6Н12О6 + 6 О2 → 6 СО2 + Н2О + 2820 кДж/моль.
Этот процесс включает несколько стадий (рис. 7-33).
Аэробный гликолиз - процесс окисления глюкозы с образованием двух молекул пирувата;
Общий путь катаболизма, включающий превращение пирувата в ацетил-КоА и его дальнейшее окисление в цитратом цикле;
ЦПЭ на кислород, сопряжѐнная с реакциями дегидрирования, происходящими в процессе распада глюкозы.
Б. Аэробный гликолиз
Аэробным гликолизом называют процесс окисления глюкозы до пировиноградной кислоты, протекающий в присутствии кислорода. Все ферменты, катализирующие реакции этого процесса, локализованы в цитозоле клетки.
1. Этапы аэробного гликолиза
Ваэробном гликолизе можно выделить 2 этапа.
1.Подготовительный этап, в ходе которого глюкоза фосфорилируется и расщепляется на две молекулы фосфотриоз. Эта серия реакций протекает с использованием 2 молекул АТФ.
2.Этап, сопряжѐнный с синтезом АТФ. В результате этой серии реакций фосфотриозы превращаются в пируват. Энергия, высвобождающаяся на этом этапе, используется для синтеза 10 моль АТФ.

Аэробный распад глюкозы. 1-10- реакции аэробного гликолиза; 11 - малат-аспартатный челночный механизм транспорта водорода в митохондрии; 2 (в кружке) - стехиометрический коэффициент.
Пути катаболизма глюкозы. 1 - аэробный гликолиз; 2, 3 - общий путь катаболизма; 4 - аэробный распад глюкозы; 5 - анаэробный распад глюкозы (в рамке); 2 (в кружке) - стехиометрический коэффициент.


58. Анаэробный гликолиз. Реакция гликолитической оксидоредукции; субстратное фосфорилирование. Распространение и физиологическое значение анаэробного распада глюкозы.
Анаэробным гликолизом называют процесс расщепления глюкозы с образованием в качестве конечного продукта лактата. Этот процесс протекает без использования кислорода и поэтому не зависит от работы митохондриальной дыхательной цепи. АТФ образуется за счѐт реакций субстратного фосфорилирования. Суммарное уравнение процесса:
С6Н1206 + 2 Н3Р04 + 2 АДФ = 2 С3Н6О3 + 2 АТФ + 2 Н2O.
1. Реакции анаэробного гликолиза
При анаэробном гликолизе в цитозоле протекают все 10 реакций, идентичных аэробному гликолизу. Лишь 11-я реакция, где происходит восстановление пирувата цитозольным NADH, является специфической для анаэробного гликолиза. Восстановление пирувата в лактат катализирует лактатдегидро-геназа (реакция обратимая, и фермент назван по обратной реакции). С помощью этой реакции обеспечивается регенерация NAD+ из NADH без участия митохондриальной дыхательной цепи в ситуациях, связанных с недостаточным снабжением клеток кислородом. Роль акцептора водорода от NADH (подобно кислороду в дыхательной цепи) выполняет пируват. Таким образом, значение реакции восстановления пирувата заключается не в образовании лактата, а в том, что данная цитозольная реакция обеспечивает регенерацию NAD+. К тому же лактат не является конечным продуктом метаболизма, удаляемым из организма. Это вещество выводится в кровь и утилизируется, превращаясь в печени в глюкозу, или при доступности кислорода превращается в пируват, который вступает в общий путь катаболизма, окисляясь до СО2 и Н2О. Строение лактатдегидрогеназы, механизм действия и значение определения активности этого фермента для диагностики заболеваний описывались ранее в разделе 2.
Баланс АТФ при анаэробном гликолизе
Анаэробный гликолиз по сравнению с аэробным менее эффективен. В этом процессе катаболизм 1 моль глюкозы без участия митохондриальной дыхательной цепи сопровождается синтезом 2 моль АТФ и 2 моль лактата. АТФ образуется за счѐт 2 реакций субстратного
Рис. 7-40. Анаэробный гликолиз.

фосфорилирования. Поскольку глюкоза распадается на 2 фосфотриозы, то с учѐтом стехиометри-ческого коэффициента, равного 2, количество моль синтезированного АТФ равно 4. Учитывая 2 моль АТФ, использованных на первом этапе гликолиза, получаем конечный энергетический эффект процесса, равный 2 моль АТФ. Таким образом, 10 цитозольных ферментов, катализирующих превращение глюкозы в пируват, вместе с лактатдегидрогеназой обеспечивают в анаэробном гликолизе синтез 2 моль АТФ (на 1 моль глюкозы) без участия кислорода.
Анаэробный распад глюкозы происходит в мышцах, в первые минуты мышечной работы, в эритроцитах (в которых отсутствуют митохондрии), а также в разных органах в условиях ограниченного снабжении их кислородом, в том числе в клетках опухолей. Для метаболизма клеток опухолей характерно ускорение как аэробного, так и анаэробного гликолиза. Но преимущественный анаэробный гликолиз и увеличение синтеза лактата служит показателем повышенной скорости деления клеток при недостаточной обеспеченности их системой кровеносных сосудов.
59. Биосинтез глюкозы (глюконеогенез) из аминокислот, глицерина и молочной кислоты; регуляция глюконеогенеза. Биотин, роль в образовании оксалоацетата. Взаимосвязь гликолиза в мышцах и глюконеогенеза в печени (цикл Кори).
Рис. 7-44. Включение субстратов в глюконеогенез.
Рис. 7-45. Гликолиз и глюконеогенез. Ферменты обратимых реакций гликолиза и глюконеогенеза: 2 - фосфоглюкоизоме-раза; 4 - альдолаза; 5 - триозофосфатизомераза; 6 - глицеральдегидфосфатдегидрогеназа; 7 -фосфоглицераткиназа; 8 - фосфоглицератмутаза; 9 - енолаза. Ферменты необратимых реакций глюконеогенеза: 11 - пируваткарбоксилаза; 12 - фосфоенолпируваткарбоксикиназа; 13 - фруктозо-1,6-бисфосфатаза; 14 -глюкозо-6-фосфатаза. I-III -субстратные циклы.
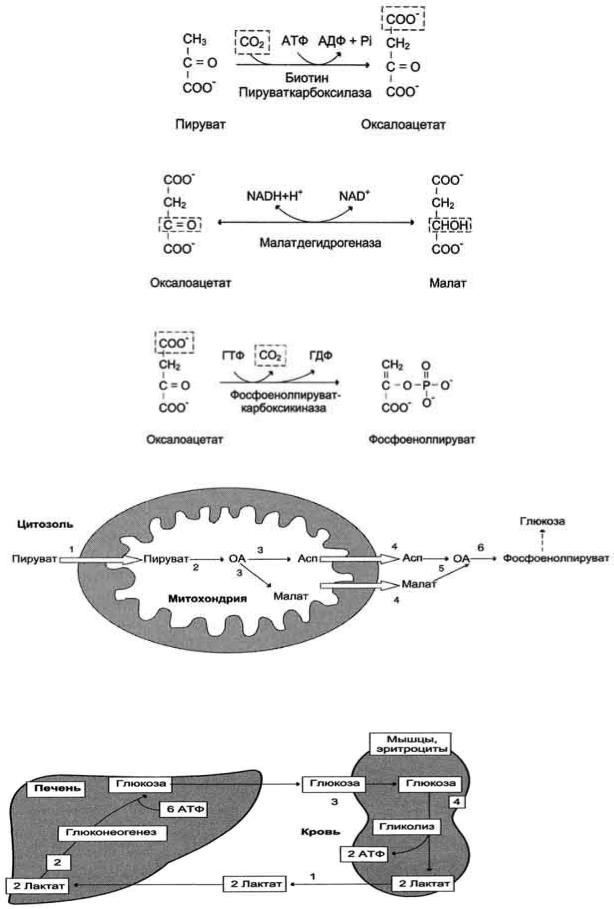
Рис. 7-46. Образование оксалоацетата из пирувата.
Рис. 7-47. Превращение оксалоацетата в малат.
Рис. 7-48. Превращение оксалоацетата в фосфоенолпируват.
Рис. 7-49. Образование оксалоацетата, транспорт в цитозоль и превращение в фосфоенолпируват. 1 - транспорт пирувата из цитозоля в митохондрию; 2 - превращение пирувата в оксалоацетат (ОА); 3 - превращение ОА в малат или аспартат; 4 - транспорт аспартата и малата из митохондрии в цитозоль; 5 - превращение аспартата и малата в ОА; 6 - превращение ОА в фосфоенолпируват.
Рис. 7-50. Цикл Кори (глюкозолактатный цикл). 1 - поступление лактата из сокращающейся мышцы с током крови в печень; 2 - синтез глюкозы из лактата в печени; 3 - поступление глюкозы из печени с током крови в работающую мышцу; 4 - использование глюкозы как энергетического субстрата сокращающейся мышцей и образование лактата.

59. Гликоген, биологическое значение. Биосинтез и мобилизация гликогена. Регуляция синтеза и распада гликогена.
Многие ткани синтезируют в качестве резервной формы глюкозы гликоген. Синтез и распад гликогена обеспечивают постоянство концентрации глюкозы в крови и создают депо для еѐ использования тканями по мере необходимости.
Гликоген - разветвлѐнный гомополимер глюкозы, в котором остатки глюкозы соединены в линейных участках α-1,4-гликозидной связью. В точках ветвления мономеры соединены α-1,6-гликозидными связями. Эти связи образуются примерно с каждым десятым остатком глюкозы. Следовательно, точки ветвления в гликогене встречаются примерно через каждые десять остатков глюкозы. Так возникает древообразная структура с молекулярной массой >107Д, что соответствует приблизительно 50 000 остатков глюкозы (рис. 7-21). Таким образом, в молекуле гликогена имеется только одна свободная аномерная ОН-группа и, следовательно, только один восстанавливающий (редуцирующий) конец.
В клетках животных гликоген - основной резервный полисахарид. При полимеризации глюкозы снижается растворимость образующейся молекулы гликогена и, следовательно, еѐ влияние на осмотическое давление в клетке. Это обстоятельство объясняет, почему в клетке депонируется гликоген, а не свободная глюкоза.
Гликоген хранится в цитозоле клетки в форме гранул диаметром 10-40 нм. С гранулами связаны и некоторые ферменты, участвующие в метаболизме гликогена, что облегчает их взаимодействие с субстратом. Разветвлѐнная структура гликогена обусловливает большое количество концевых мономеров, что способствует работе ферментов, отщепляющих или присоединяющих мономеры при распаде или синтезе гликогена, так как эти ферменты могут одновременно работать на нескольких ветвях молекулы. Гликоген депонируется главным образом в печени и скелетных мышцах.
После приѐма пищи, богатой углеводами, запас гликогена в печени может составлять примерно 5% от еѐ массы. В мышцах запасается около 1% гликогена, однако масса мышечной ткани значительно больше и поэтому общее количество гликогена в мышцах в 2 раза больше, чем в печени. Гликоген может синтезироваться во многих клетках, например в нейронах, макрофагах, клетках жировой ткани, но содержание его в этих тканях незначительно. В организме может содержаться до 450 г гликогена.
Распад гликогена печени служит в основном для поддержания уровня глюкозы в крови в постабсорбтивном периоде. Поэтому содержание гликогена в печени изменяется в зависимости от ритма питания. При длительном голодании оно снижается почти до нуля. Гликоген мышц служит резервом глюкозы - источника энергии при мышечном сокращении. Мышечный гликоген не используется для поддержания уровня глюкозы в крови. Как уже упоминалось ранее, в клетках мышц нет фермента глюкозо- 6-фосфатазы, и образование свободной глюкозы невозможно. Расход гликогена в мышцах зависит в основном от физической нагрузки .
