
биохимия (Восстановлен)
.pdf
Рис. 6-19. Катаболизм основных пищевых веществ. 1-3 - пищеварение; 4-8 - специфические пути катаболизма; 9-10 - заключительный (общий путь) катаболизма; 11 - ЦПЭ; 12 - окислительное фосфорилирование.
Превращение пирувата в ацетил-КоА происходит при участии набора ферментов, структурно объединѐнных в пируватдегидрогеназный комплекс (ПДК). Ацетильный остаток - ацетил-КоА далее окисляется в цикле лимонной кислоты до СО2 и Н2О. В этих реакциях окисления принимают участие NAD- и FAD-зависимые дегидрогеназы, поставляющие электроны и протоны в ЦПЭ, по которой они передаются на О2.
А. Окислительное декарбоксилирование пирувата
Окислительное декарбоксилирование пирувата происходит в матриксе митохондрий. Транспорт пирувата в митохондриальный матрикс через внутреннюю мембрану митохондрий осуществляется при участии специального белка-переносчика по механизму симпорта с Н+ .
Превращение пирувата в ацетил-КоА описывают следующим суммарным уравнением:
СН3-СО-СООН + NAD+ + HSKoA → CH3-CO SKoA + NADH + H+ + CO2
В ходе этой реакции происходит окислительное декарбоксилирование пирувата, в результате которого карбоксильная группа удаляется в виде СО2, а ацетильная группа включается в состав ацетилКоА. Один атом водорода оказывается в составе NADH, а другой в виде Н+ поступает в среду. Реакция необратима, поскольку ΔG0' = -33,5 кДж/моль.
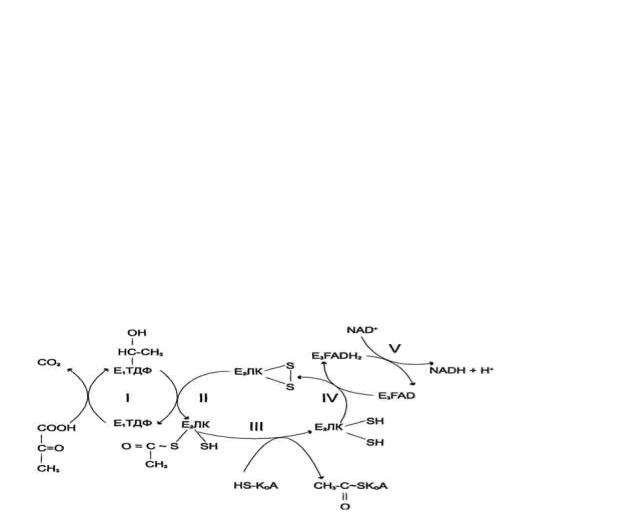
1. Строение пируватдегидрогеназного комплекса
Процесс окислительного декарбоксилирования пирувата катализирует сложноорганизованный пируватдегидрогеназный комплекс. В пируватдегидрогеназный комплекс (ПДК) входят 3 фермента: пируватдекарбоксилаза (Е1), дигидролипоилтрансацетилаза (Е2) и дигидролипоилдегидрогеназа (Е3), а также 5 коферментов: тиаминдифосфат (ТДФ), липоевая кислота,. FAD, NAD+ и КоА. Кроме того, в состав комплекса входят регуляторные субъединицы: протеинкиназа и фосфопротеинфосфатаза .
Пируватдегидрогеназный комплекс (ПДК) млекопитающих
|
Фермент |
|
Число мономеров |
Кофермент |
Витамин |
|
|
|
|
|
|
1. |
Пируватдекарбоксилаза |
E1 |
120 (30 тетрамеров) |
ТДФ |
B1 |
(пируватдегидрогеназа) |
|
|
|
|
|
|
|
|
|
|
|
2. |
Дигидролипоилтрансацетилаза |
Е2 |
180(60тримеров) |
Липоамид |
Липоевая кислота |
|
|
|
|
|
(ЛК) |
|
|
|
|
KoA |
Пантотеновая |
|
|
|
|
|
кислота |
|
|
|
|
|
|
3. |
Дигидролипоилдегидрогеназа |
Е3 |
12 (6 димеров) |
FAD |
В2 |
|
|
|
|
|
|
|
|
|
NAD+ |
РР |
|
|
|
|
|
Все эти ферменты и коферменты объединены в мультиферментную систему, содержащую разные количества каждого из ферментов и имеющую молекулярную массу более 6×106.
В центре комплекса располагается дигидролипоилтрансацетилаза (Е2), образуя его ядро. К дигидролипоилтрансацетилазе присоединены молекулы: пируватдекарбоксилазы (Е1) и дигидролипоилдегидрогеназы (Е3).
Пируватдекарбоксилаза содержит прочно связанный с белковой частью ТДФ, а дигидролипоилдегидрогеназа - FAD.
Липоиллизиновые группы центрального фермента (Е2) функционируют как поворотные "кронштейны", переносящие атомы водорода и ацетильные группы от одной ферментной молекулы комплекса к другой.
3.Окислительное декарбоксилирование пирувата
Рис. 6-21. Последовательность реакций, катализируемых ПДК. I - Е1 катализирует декарбоксилирование пирувата и перенос С2-фрагмента на ТДФ; II - Е2 катализирует окисление гидроксиэтильной группы и перенос С2-фрагмента на липоевую кислоту (ЛК); III - ацетилированная дигидролипоилтрансацетилаза взаимодействует с КоА с образованием восстановленной формы липоевой кислоты и ацетил-КоА; IV - окисленная форма трансацетилазы регенерируется при участии E3;V - окисленная форма Е3 регенерируется при участии NAD+.
Пируватдегидрогеназный комплекс характеризуется большим отрицательным окислительновосстановительным потенциалом, который обеспечивает наряду с восстановлением кофермента (NADH) образование высокоэнергетической тиоэфирной связи в ацетил-КоА.
Структурное объединение 3 видов ферментов создаѐт возможности для координации отдельных этапов сложной ферментативной реакции. Все промежуточные продукты реакции окислительного декарбоксилирования пирувата прочно связаны с комплексом, что увеличивает суммарную скорость процесса и сводит к минимуму побочные реакции.
Пируватдегидрогеназный комплекс, как и все белки, участвующие в реакциях ЦТК, кодируется ядерной ДНК. Транспорт субъединиц ПДК в митохондрии происходит сложным путѐм за счѐт энергии АТФ или трансмембранного электрохимического потенциала при участии белков теплового шока, или шаперонов (см. раздел 1), предотвращающих их преждевременный фолдинг до поступления в митохондриальный матрикс или внутреннюю мембрану митохондрий.
3. Связь окислительного декарбоксилирования пирувата с ЦПЭ
Окислительное декарбоксилирование пирувата сопровождается образованием NADH, поставляющим электроны в дыхательную цепь и обеспечивающим синтез 3 молей АТФ на 1 моль пирувата путѐм окислительного фосфорилирования.
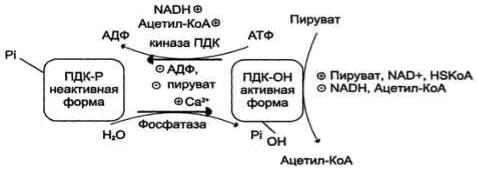
Так как отношения АДФ/АТФ и NADH/NAD+ в клетке относительно постоянны, ускорение утилизации АТФ приводит к повышению концентрации АДФ и ускорению окисления NADH в дыхательной цепи. Повышение концентрации NAD+, в свою очередь, стимулирует окислительное декарбоксилирование пирувата. Напротив, повышение концентрации АТФ и NADH снижает скорость этого процесса. Таким образом, изменения отношений АДФ/АТФ и NADH/ NAD+ - важнейшие сигналы, отражающие энергетические потребности клетки и регулирующие скорость окислительного декарбоксилирования пирувата. Каталитическая активность пируватдегидрогеназного комплекса снижается, когда в клетках имеется достаточно "топлива" в виде жирных кислот и ацетил-КоА.
Регуляция пируватдегидрогеназного комплекса. ПДК аллостерически активируется АДФ, NAD+,
КоА, Са2+ и пируватом; ацетил-КоА, NADH и АТФ активируют киназу и ингибируют ПДК. Фосфатаза активируется Са2+.
53.Цикл лимонной кислоты: последовательность реакций и характеристика ферментов. Роль цикла в метаболизме.
Цикл лимонной кислоты
Цикл лимонной кислоты (цитратный цикл, цикл Кребса, цикл трикарбоновых кислот, ЦТК) - заключительный этап катаболизма, в котором углерод ацетильного остатка ацетил-КоА окисляется до 2 молекул СО2. Атомы водорода, освобождающиеся в окислительно-восстановительных реакциях, доставляются в ЦПЭ при участии NAD- и FAD-зависимых дегидрогеназ, в результате чего происходят синтез воды и окислительное фосфорилирование АДФ. Связь между атомами углерода в ацетил-КоА устойчива к окислению. В условиях организма окисление ацетильного остатка происходит в несколько этапов, образующих циклический процесс из 8 реакций
1. Последовательность реакций цитратного цикла
Образование цитрата
В реакции образования цитрата углеродный атом метильной труппы ацетил-КоА связывается с карбонильной группой оксалоацетата ; одновременно расщепляется тиоэфирная связь и освобождается коэнзим A (ΔG0' = -37,6 кДж/моль).
Равновесие реакции в клетке сильно сдвинуто вправо, о чѐм свидетельствует отрицательная величина стандартной свободной энергии. Реакция сопровождается потерей большого количества энергии в виде теплоты. Катализирует реакцию цитрат синтаза, фермент, локализованный в матриксе митохондрий.
Превращение цитрата в изоцитрат
Вторая реакция цитратного цикла - обратимое превращение цитрата в изоцитрат. Фермент, катализирующий эту реакцию, назван аконитазой по промежуточному продукту, цис-аконитовой кислоте,
которая предположительно образуется в реакции. Однако это соединение не обнаруживается в свободном виде, так как не отделяется от активного центра фермента до завершения реакции.
Окислительное декарбоксилирование изоцитрата
Эту реакцию катализирует изоцитратдегидрогеназа. Существуют 2 формы изоцитратдегидрогеназы: одна содержит в качестве коферментa NAD+, вторая - NADP+. NAD-зависимый фермент локализован в митохондриях и участвует в ЦТК; NADP-зависимый фермент, присутствующий и в митохондриях, и В) цитоплазме, играет иную метаболическую роль, В результате действия этого фермента на изоцитрат образуется α-кетоглутарат .
Реакция, катализируемая NAD-зависимой изоцитратдегидрогеназой, - самая медленная реакция цитратного цикла. АДФ - аллостерический активатор фермента.
Окислительное декарбоксилирование α-кетоглутарата
В этой реакции α-кетоглутарат подвергается окислительному декарбоксилированию с образованием в качестве конечных продуктов сук-цинил-КоА, СО2 и NADH + Н+. В результате этой реакции образуется сукцинил-КоА (см. рис. 6-24).
Реакцию катализирует α-кетоглутаратдегидрогеназный комплекс, который по структуре и функциям сходен с пируватдегидрогеназным комплексом (ПДК). Подобно ПДК, он состоит из 3 ферментов: α- кетоглутаратдекарбоксилазы, дигидролипоилтранссукцинилазы и дигидролипоилдегидрогеназы. Кроме того, в этот ферментный комплекс входят 5 коферментов: тиаминдифосфат, кофермент А, липоевая кислота, NAD+ и FAD. Существенное отличие этой ферментной системы от ПДК - то, что она не имеет сложного механизма регуляции, какой характерен для ПДК. В частности, в этом комплексе отсутствуют регуляторные субъединицы. Равновесие реакции окислительного декарбоксилирования α-кетоглутарата сильно сдвинуто в сторону образования сукцинил-КоА, и еѐ можно считать однонаправленной.
Превращение сукцинил-КоА в сукцинат
Сукцинил-КоА - высокоэнергетическое соединение. Изменение свободной энергии гидролиза этого тиоэфира составляет ΔG0'= -35,7 кДж/моль. В митохондриях разрыв тиоэфирной связи сук-цинил-КоА сопряжѐн с реакцией фосфорилирования гуанозиндифосфата (ГДФ) до гуанозинтрифосфата (ГТФ).
Сукцинил-КоА → Сукцинат (ΔG0 = -10,36 кДж/моль).
Эту сопряжѐнную реакцию (см. рис. 6-24) катализирует сукцинаттиокиназа. Промежуточный этап реакции - фосфорилирование молекулы фермента по одному из гистидиновых остатков активного центра. Затем остаток фосфорной кислоты присоединяется к ГДФ с образованием ГТФ.
С ГТФ концевая фосфатная группа может переноситься на АДФ с образованием АТФ; эту обратимую реакцию катализирует нуклеозид-дифосфаткиназа.
ГТФ + АДФ ↔ ГДФ + АТФ.
Образование высокоэнергетической фосфо-ангидридной связи за счѐт энергии субстрата (сукцинилКоА) - пример субстратного фосфорилирования.
Дегидрирование сукцината
Образовавшийся на предьщущем этапе сукцинат превращается в фумарат под действием сукцинатдегидрогеназы (см. рис. 6-24). Этот фермент - флавопротеин, молекула которого содержит прочно связанный кофермент FAD.
Сукцинат дегидрогеназа прочно связана с внутренней митохондриальной мембраной. Она состоит из 2 субъединиц, одна из которых связана с FAD. Кроме того, обе субъединицы содержат железо-серные центры; одна - Fe2S2, a другая - Fe4S4. В железо-серных центрах атомы железа меняют свою валентность, участвуя в транспорте электронов.
Образование малата из фумарата
Образование малата происходит при участии фермента фумаратгидратазы . Этот фермент более известен как фумараза.
Фумараза - олигомерный белок, состоящий из 4 идентичных полипептидных цепей. Он расположен в матриксе митохондрий. Фумаразу относят к ферментам с абсолютной субстратной специфичностью: она катализирует гидратацию только транс-формы фумарата.
Дегидрирование малата
В заключительной стадии цитратного цикла малат дегидрируется с образованием оксалоацетата. Реакцию катализирует NAD-зависимая малатдегидрогеназа, содержащаяся в матриксе митохондрий.
Равновесие малатдегидрогеназной реакции сильно сдвинуто влево. Тем не менее, в интактных клетках эта реакция идѐт слева направо, потому что продукт реакции, оксалоацетат, активно используется в цитратсинтазной реакции.
В цитозоле содержится изоформа малат-дегидрогеназы, также NAD-зависимая, но не принимающая участие в цитратном цикле. Обе изоформы малатдегидрогеназы - димеры.
Образованием оксалоацетата завершается один оборот цитратного цикла. В одном обороте цикла лимонной кислоты в 2 реакциях декарбоксилирования (превращение изоцитрата в а-кетоглутарат и оскетоглутарата в сукцинил-КоА) происходит образование 2 молекул СО2. В 4 реакциях цитратного цикла происходит дегидрирование с образованием восстановленных коферментов: 3 молекул NADH+H+ и 1 молекулы FADH2. B составе сукцинатдегидрогеназы.
Наконец, на один оборот цикла затрачивается 2 молекулы воды: одна - на стадии образования цитрата, вторая - на стадии гидратации фумарата.
Восстановленные коферменты (3 молекулы NADH и 1 молекула FADH2), образованные в цикле лимонной кислоты, отдают электроны в ЦПЭ на кислород - конечный акцептор электронов. Восстановленный кислород взаимодействует с протонами с образованием воды.
На каждую молекулу NADH при образовании молекулы воды в процессе тканевого дыхания синтезируются 3 молекулы АТФ, а на каждую молекулу FADH2 - 2 молекулы АТФ .
Таким образом, каждый оборот цикла лимонной кислоты сопровождается синтезом 11 молекул АТФ путѐм окислительного фосфорилирования. Одна молекула АТФ образуется путѐм субстратного фосфорилирования.
54. Цикл лимонной кислоты, схема процесса. Связь цикла с целью переноса электронов и протонов. Регуляция цикла лимонной кислоты. Анаболические и анаплеротические функции цитратного цикла.

Общая схема цитратного цикла. Цифры 1-8 обозначают реакции цитратного цикла. Цикл начинается с того, что ацетильный остаток конденсируется с оксалоацетатом, в результате чего образуется шестиуглеродное соединение - цитрат. На образование цитрата в каждом обороте цикла расходуется одна молекула оксалоацетата; в результате завершения цикла происходит регенерация оксалоацетата. Таким образом, одна молекула оксалоацетата может многократно использоваться для окисления ацетильных остатков.
Регуляция общего пути катаболизма. 1 - ПДК активируется пируватом, NAD+, КоА; ингибируется NADH и ацетил-КоА; 2 - цитратсинтаза (реакция ускоряется при повышении концентрации оксалоацетата и замедляется при повышении концентрации цитрата, NADH, АТФ и сукцинил-КоА); 3 - изоцитратдегидрогеназа аллостерически активируется АДФ, ионами кальция, ингибируется NADH; 4 - α- кетоглутаратдегидрогеназный комплекс ингибируется NADH, АТФ и сукцинил-КоА, а активируется ионами кальция.
В. Анаболические функции цитратного цикла

Цикл лимонной кислоты - один из амфиболических путей метаболизма. В нѐм осуществляются не только окислительные превращения энергетических субстратов до конечных продуктов СО2 и Н2О, но и происходит образование субстратов для других метаболических путей .
Некоторые промежуточные продукты цикла лимонной кислоты: α-кетоглутарат, сукцинат, оксалоацетат могут использоваться для синтеза заменимых аминокислот .
Убыль промежуточных продуктов цикла восполняется в реакциях, катализируемых специфическими ферментами. В нормальных условиях реакции, отвлекающие промежуточные продукты из цикла и восполняющие их убыль, находятся в состоянии динамического равновесия, так что концентрация этих продуктов в митохондриях остаѐтся постоянной.
Реакции, обеспечивающие пополнение фонда промежуточных продуктов ЦТК, называются анаплеротическими (пополняющими). Важнейшая из них - реакция синтеза оксалоацетата из пирувата. Эту реакцию катализирует митохондриальный фермент - пируваткарбоксилаза.
Если для цикла лимонной кислоты не хватает оксалоацетата или какого-нибудь другого промежуточного продукта, то карбоксилирование пирувата ускоряется. В этой реакции в качестве источника энергии используется АТФ.
Реакция протекает в 2 стадии. На первой стадии происходит активация СО2 путѐм присоединения к одному из атомов азота в молекуле биотина. Эта реакция сопряжена с гидролизом АТФ.
АТФ + СО2+ Е-биотин + Н2О → АДФ + Н3РО4 + Е-биотин-СОО- + 2 Н+.
На второй стадии активированная карбоксильная группа переносится на пируват.
Е-биотин-СОО" + Пируват -" Е-биотин + Оксалоацетат.
Пируваткарбоксилаза - регуляторный фермент. Если концентрация ацетил-КоА увеличивается, то он действует как аллостерический активатор пируваткарбоксилазы, ускоряя образование оксалоацетата. Таким образом, избыток ацетил-КоА способствует активации цитратного цикла.
Метаболиты цитратного цикла используются не только как субстраты синтеза углеродного
Рис. 6-28. Использование метаболитов ЦТК в синтезе различных соединений. Синтез заменимых аминокислот (1, 2, 3), глюкозы (4, 5, 6), жирных кислот (7), тема (8).

скелета ряда соединений, но и являются донорами водорода для образования восстановленных коферментов, участвующих в реакциях синтеза жирных кислот, стероидов и других веществ. Два метаболита нитратного цикла могут дегидрироваться при участии NADP-зависимых дегидрогеназ: малата и изоцитрата. Например, малат может поступать из митохондрий в цитозоль клетки. В цитозоле находится NADP-зависимая дегидрогеназа (малик-фермент), катализирующая реакцию:
Малат и изоцитрат обеспечивают образование около половины общего фонда NADPH, используемого в восстановительных синтезах; вторая половина образуется в пентозофосфатном пути превращения глюкозы
55. Основные углеводы животных, биологическая роль. Углеводы пищи, переваривание углеводов. Всасывание продуктов переваривания.
Углеводы входят в состав живых организмов и вместе с белками, липидами и нуклеиновыми кислотами определяют специфичность их строения и функционирования. К углеводам относят соединения, обладающие разнообразными и зачастую сильно отличающимися функциями. Углеводы участвуют во многих метаболических процессах, но прежде всего они являются основными поставщиками энергии. На долю углеводов приходится примерно 75% массы пищевого суточного рациона и более 50% от суточного количества необходимых калорий. Однако неправильно сводить функцию углеводов только к энергетическому обеспечению процессов жизнедеятельности организма. Следует отметить и структурную роль углеводов. Так, в виде гликозаминогликанов углеводы входят в состав межклеточного матрикса. Большое число белков (ферменты, белки-транспортѐры, белки-рецепторы, гормоны) - гликопротеины, углеводная составляющая которых повышает их специфичность. Например, различия в строении олигосахаридных фрагментов клеточной оболочки эритроцитов обеспечивают групповую принадлежность крови. Из углеводов в процессе метаболизма образуется большое число органических соединений, которые служат исходными субстратами для синтеза липидов, аминокислот, нуклеотидов. Производные углеводов - глюкурониды - участвуют в детоксикации ксенобиотиков и инактивации веществ эндогенного происхождения. Углеводы могут быть синтезированы в организме с использованием других метаболитов: некоторых аминокислот, глицерина, молочной кислоты. Углеводы нельзя считать незаменимыми компонентами пищи. Однако если исключить углеводы из диеты, то следствием может быть гипогликемия, для компенсации которой будут расходоваться белки и липиды. Таким образом, углеводы - обязательные пищевые компоненты, потому что помимо их основной энергетической функции (клеточные "дрова") углеводы участвуют во многих метаболических клеточных процессах
Эпителиальные клетки кишечника способны всасывать только моносахариды. Поэтому процесс переваривания заключается в ферментативном гидролизе гликозидных связей в углеводах, имеющих олигоили полисахаридное строение .
А. Переваривание углеводов в ротовой полости
В ротовой полости пища измельчается при пережѐвывании, смачиваясь при этом слюной. Слюна на 99% состоит из воды и обычно имеет рН 6,8. В слюне присутствует гидролитический фермент α- амилаза (α-1,4-гликозидаза), расщепляющая в крахмале α-1,4-гликозидные связи. В ротовой полости не может происходить полное расщепление крахмала, так как действие фермента на крахмал кратковременно. Кроме того, амилаза слюны не расщепляет α- 1,6-гликозидные связи (связи в местах разветвлений), поэтому крахмал переваривается лишь частично с образованием крупных фрагментов - декстринов и небольшого количества мальтозы. Следует отметить, что амилаза слюны не гидролизует гликозидные связи в дисахаридах.
Действие амилазы слюны прекращается в резко кислой среде содержимого желудка (рН 1,5-2,5). Однако внутри пищевого комка активность амилазы может некоторое время сохраняться, пока рН не изменится в кислую сторону. Желудочный сок не содержит ферментов, расщепляющих углеводы. В желудочном содержимом возможен лишь незначительный кислотный гидролиз гликозидных связей.
Б. Переваривание углеводов в кишечнике
Последующие этапы переваривания нерасщеплѐнного или частично расщеплѐнного крахмала, а также других углеводов пищи происходит в тонком кишечнике в разных его отделах под действием гадролитических ферментов - гликозидаз.
Панкреатическая α-амилаза
В двенадцатиперстной кишке рН среды желудочного содержимого нейтрализуется, так как секрет поджелудочной железы имеет рН 7,5-8,0 и содержит бикарбонаты (НСО3-). С секретом поджелудочной железы в кишечник поступает панкреатическая α-амилаза. Этот фермент гидролизует α-1,4-гликозидные связи в крахмале и декстринах.
Продукты переваривания крахмала на этом этапе - дисахарид мальтоза, содержащая 2 остатка глюкозы, связанные α-1,4-связью. Из тех остатков глюкозы, которые в молекуле крахмала находятся в местах разветвления и соединены α-1,6-гликозидной связью, образуется дисахарид изомальтоза. Кроме того, образуются олигосахариды, содержащие 3-8 остатков глюкозы, связанные α-1,4- и α-1,6-связями (рис. 7-11).
α-Амилаза поджелудочной железы, так же, как α-амилаза слюны, действует как эндогликозидаза. Панкреатическая α-амилаза не расщепляет α-1,6-гликозидные связи в крахмале. Этот фермент также не гидролизует (3-1,4-гликозидные связи, которыми соединены остатки глюкозы в молекуле целлюлозы. Целлюлоза, таким образом, проходит через кишечник неизменѐнной. Тем не менее непереваренная целлюлоза выполняет важную функцию балластного вещества, придавая пище дополнительный объѐм и положительно влияя на процесс переваривания. Кроме того, в толстом кишечнике целлюлоза может подвергаться действию бактериальных ферментов и частично расщепляться с образованием спиртов, органических кислот и СО2. Продукты бактериального расщепления целлюлозы важны как стимуляторы перистальтики кишечника.
Мальтоза, изомальтоза и триозосахариды, образующиеся в верхних отделах кишечника из крахмала, - промежуточные продукты. Дальнейшее их переваривание происходит под действием специфических ферментов в тонком кишечнике. Дисахариды пищи сахароза и лактоза также гидролизуются специфическими дисахаридазами в тонком кишечнике.
Особенность переваривания углеводов в тонком кишечнике заключается в том, что активность специфических олиго- и дисахаридаз в просвете кишечника низкая. Но ферменты активно действуют на поверхности эпителиальных клеток кишечника.
Тонкий кишечник изнутри имеет форму пальцеобразных выростов - ворсинок, покрытых эпителиальными клетками. Эпителиальные клетки, в свою очередь, покрыты микроворсинками, обращѐнными в просвет кишечника. Эти клетки вместе с ворсинками образуют щѐточную каѐмку, благодаря которой увеличивается поверхность контакта гидролитических ферментов и их субстратов в содержимом кишечника. На 1 мм2 поверхности тонкой кишки у человека приходится 80-140 млн ворсинок.
Ферменты, расщепляющие гликозидные связи в дисахаридах (дисахаридазы), образуют ферментативные комплексы, локализованные на наружной поверхности цитоплазматической мембраны энтероцитов.
Сахаразо-изомальтазный комплекс
Этот ферментативный комплекс состоит из двух полипептидных цепей и имеет доменное строение. Сахаразо-изомальтазный комплекс прикрепляется к мембране микроворсинок кишечника с помощью гидрофобного (трансмембранного) домена, образованного N-концевой частью полипептида. Каталитический центр выступает в просвет кишечника (рис. 7-12). Связь этого пищеварительного фермента с мембраной способствует эффективному поглощению продуктов гидролиза клеткой.
Сахаразо-изомальтазный комплекс гидролизует сахарозу и изомальтозу, расщепляя α-1,2- и α-1,6- гликозидные связи. Кроме того, оба ферментных домена имеют мальтазную и мальтотриазную активности, гидролизуя α-1,4-гликозидные связи в мальтозе и мальтотриозе (трисахарид, образующийся из крахмала). На долю сахаразо-изомальтазного комплекса приходится 80% от всей мальтазной активности кишечника. Но несмотря на присущую ему высокую мальтазную активность, этот ферментативный комплекс назван в соответствии с основной специфичностью. К тому же сахаразная субъединица - единственный фермент в
кишечнике, гадролизующий сахарозу. Изомальтазная субъединица с большей скоростью гидролизует гликозидные связи в изомальтозе, чем в мальтозе и мальтотриозе
В тощей кишке содержание сахаразо-изомальтазного ферментативного комплекса достаточно высокое, но оно снижается в проксимальной и дистальной частях кишечника.
Гликоамилазный комплекс
Этот ферментативный комплекс катализирует гидролиз α-1,4-связи между глюкозными остатками в олигосахаридах, действуя с восстанавливающего конца. По механизму действия этот фермент относят к экзогликозидазам. Комплекс расщепляет также связи в мальтозе, действуя как мальтаза. В гликоамилазный комплекс входят две разные каталитические субъединицы, имеющие небольшие различия в субстратной специфичности. Гликоамилазная активность комплекса наибольшая в нижних отделах тонкого кишечника.
β-Гликозидазный комплекс (лактаза)
Лактаза расщепляет β-1,4-гликозидные связи между галактозой и глюкозой в лактозе .
Этот ферментативный комплекс по химической природе является гликопротеином. Лактоза, как и другие гликозидазные комплексы, связана с щѐточной каемкой и распределена неравномерно по всему тонкому кишечнику. Активность лактазы колеблется в зависимости от возраста. Так, активность лактазы у плода особенно повышена в поздние сроки беременности и сохраняется на высоком уровне до 5-7-летнего возраста. Затем активность фермента снижается, составляя у взрослых 10% от уровня активности, характерного для детей.
Трегалаза - также гликозидазный комплекс, гидролизующий связи между мономерами в трегалозе - дисахариде, содержащемся в грибах. Трегалоза состоит из двух глюкозных остатков, связанных гликозидной связью между первыми аномерными атомами углерода .
Совместное действие всех перечисленных ферментов завершает переваривание пищевых олиго- и полисахаридов с образованием моносахаридов, основной из которых - глюкоза. Кроме глюкозы, из углеводов пищи также образуются фруктоза и галактоза, в меньшем количестве - манноза, ксилоза, арабиноза..
Моносахариды, образовавшиеся в результате переваривания, всасываются эпителиальными клетками тощей и подвздошной кишок с помощью специальных механизмов транспорта через мембраны этих клеток.
А. Всасывание моносахаридов в кишечнике
Транспорт моносахаридов в клетки слизистой оболочки кишечника может осуществляться разными способами: путѐм облегчѐнной диффузии и активного транспорта. В случае активного транспорта глюкоза и Na+ проходят через мембраны с люминальной стороны, связываясь с разными участками белка-переносчика. При этом Na+ поступает в клетку по градиенту концентрации, и одновременно глюкоза транспортируется против градиента концентрации (вторично-активный транспорт, см. раздел 5). Следовательно, чем больше градиент Na+, тем больше поступление глюкозы в энтероциты. Если концентрация Na+ во внеклеточной жидкости уменьшается, транспорт глюкозы снижается. Градиент концентрации Na+, являющийся движущей силой активного сим-порта, создаѐтся работой Nа+,К+-АТФ-азы. Перенос в клетки слизистой оболочки кишечника по механизму вторично-активного транспорта характерен также для галактозы.
При разной концентрации глюкозы в просвете кишечника "работают" различные механизмы транспорта. Благодаря активному транспорту эпителиальные клетки кишечника могут поглощать глюкозу при еѐ очень низкой концентрации в просвете кишечника. Если же концентрация глюкозы в просвете кишечника велика, то она может транспортироваться в клетку путѐм облегчѐнной диффузии. Таким же способом может всасываться и фруктоза. Следует отметить, что скорость всасывания глюкозы и галактозы гораздо выше, чем других моносахаридов. Способы транспорта моносахаридов через мембрану эпителиальных клеток кишечника представлены на рис. 7-18.
После всасывания моносахариды (главным образом, глюкоза) покидают клетки слизистой оболочки кишечника через мембрану, обращѐнную к кровеносному капилляру, с помощью облегчѐнной диффузии.
