
биохимия (Восстановлен)
.pdf1. Конкурентное ингибирование
К конкурентному ингибированию относят обратимое снижение скорости ферментативной реакции, вызванное ингибитором, связывающимся с активным центром фермента и препятствующим образованию фермент-субстратного комплекса. Такой тип ингибирования наблюдают, когда ингибитор - структурный аналог субстрата, в результате возникает конкуренция молекул субстрата и ингибитора за место в активном центре фермента. В этом случае с ферментом взаимодействует либо субстрат, либо ингибитор, образуя комплексы фермент-субстрат (ES) или фермент-ингибитор (EI). При формировании комплекса фермента и ингибитора (EI) продукт реакции не образуется
Для конкурентного типа ингибирования справедливы следующие уравнения:
Е + S ES → E + P,
E + I EI.
Кинетические зависимости
Конкурентные ингибиторы уменьшают скорость химической реакции. Конкурентный ингибитор повышает Кm для данного субстрата (уменьшает сродство субстрата к ферменту). Это означает, что в присутствии конкурентного ингибитора необходима большая концентрация субстрата для достижения 1/2
Vmax.
Увеличение соотношения концентрации субстрата и ингибитора снижает степень ингибирования. При значительно более высоких концентрациях субстрата ингибирование полностью
В качестве лекарственных препаратов используют следующие антиметаболиты: сульфаниламидные препараты (аналоги парааминобензойной кислоты), применяемые для лечения инфекционных заболеваний , аналоги нуклеотидов для лечения онкологических заболеваний .
2. Неконкурентное ингибирование
Неконкурентным называют такое ингибирование ферментативной реакции, при котором ингибитор взаимодействует с ферментом в участке, отличном от активного центра. Неконкурентные ингибиторы не являются структурными аналогами субстрата.
Неконкурентный ингибитор может связываться либо с ферментом, либо с фермент-субстратным комплексом, образуя неактивный комплекс. Присоединение неконкурентного ингибитора вызывает изменение конформации молекулы фермента таким образом, что нарушается взаимодействие субстрата с активным центром фермента, что приводит к снижению скорости ферментативной реакции.
Кинетические зависимости
Этот тип ингибирования характеризуется снижением Vmax ферментативной реакции и уменьшением сродства субстрата к ферменту, т.е. увеличением Кm.
Б. Необратимое ингибирование
Необратимое ингибирование наблюдают в случае образования ковалентных стабильных связей между молекулой ингибитора и фермента. Чаще всего модификации подвергается активный центр фермента, В результате фермент не может выполнять каталитическую функцию.
К необратимым ингибиторам относят ионы тяжѐлых металлов, например ртути (Hg2+), серебра (Ag+) и мышьяка (As3+), которые в малых концентрациях блокируют сульфгидрильные группы активного центра. Субстрат при этом не может подвергаться химическому превращению . При наличии реактиваторов ферментативная функция восстанавливается. В больших концентрациях ионы тяжѐлых металлов вызывают денатурацию белковой молекулы фермента, т.е. приводят к полной инактивации фермента.
1. Специфические и неспецифические ингибиторы
Использование необратимых ингибиторов представляет большой интерес для выяснения механизма действия ферментов. С этой целью применяют вещества, блокирующие определѐнные группы активного центра ферментов. Такие ингибиторы называют специфическими. Ряд соединений легко вступает в реакции с определенными химическими группами. Если эти группы участвуют в катализе, то происходит полная инактивация фермента .
2. Необратимые ингибиторы ферментов как лекарственные препараты
Пример лекарственного препарата, действие которого основано на необратимом ингибировании ферментов, - широко используемый препарат аспирин. Противовоспалительный нестероидный препарат аспирин обеспечивает фармакологическое действие за счѐт ингибирования фермента циклооксигеназы, катализирующего реакцию образования простагландинов из арахидоновой кислоты. В результате химической реакции ацетильный остаток аспирина присоединяется к свободной концевой NH2-группе одной из субъединиц циклооксигеназы .
Это вызывает снижение образования продуктов реакции простагландинов , которые обладают широким спектром биологических функций, в том числе являются медиаторами воспаления.
18. Аллостерическая регуляция активности ферментов. Роль аллостерических ферментов в метаболизме клетки. Аллостерические эффекторы и ингибиторы. Особенности строения и функционирования аллостерических ферментов и их локализация в метаболических путях. Регуляция активности ферментов по принципу отрицательной обратной связи. Привести примеры.
Наиболее тонким и широко распространенным способом регуляции активности ферментов является аллостерическая регуляция. В этом случае регуляторный фактор связывается не с каталитическим центром фермента, а с другим его участком (регуляторным центром), что приводит к изменению активности фермента. Ферменты, регулируемые таким образом, называются аллостерическими , они часто занимают ключевую позицию в метаболизме. Вещество, связывающееся с регуляторным центром называется эффектором, эффектор может быть ингибитором, а может быть активатором. Обычно эффекторами бывают либо конечные продукты биосинтетических путей (ингибирование по принципу обратной связи), либо вещества, концентрация которых отражает состояние клеточного метаболизма (АТФ, АМФ, НАД+ и др.). Как правило, аллостерические ферменты катализируют одну из реакций, с которой начинается процесс образования какого-то метаболита. Обычно эта стадия лимитирует скорость всего процесса в целом. В катаболических процессах, сопровождающихся синтезом АТФ из АДФ, в роли аллостерического ингибитора одной из ранних стадий катаболизма часто выступает сам конечный продукт – АТФ. Аллостерическим ингибитором одной из ранних стадий анаболизма нередко служит конечный продукт биосинтеза, например какая-нибудь аминокислота.
Активность некоторых аллостерических ферментов стимулируется специфическими активаторами. Аллостерический фермент, регулирующий одну из катаболических последовательностей реакций, может, например, подчиняться стимулирующему влиянию положительных эффекторов – АДР или АМР и ингибирующему действию отрицательного эффектора – АТР. Известны также случаи, когда аллостерический фермент какого-нибудь метаболического пути специфическим образом реагирует на промежуточные или конечные продукты других метаболических путей. Благодаря этому оказывается возможной координация скорости действия различных ферментных систем.
19. Регуляция каталитической активности ферментов ковалентной модификацией путем фосфорилирования и дефосфорилирования (на примере ферментов синтеза и распада гликогена).
В биологических системах часто встречается механизм регуляции активности ферментов с помощью ковалентной модификации аминокислотных остатков. Быстрый и широко распространѐнный способ химической модификации ферментов - фосфорилирование/дефосфорилирование. Модификации подвергаются ОН-группы фермента. Фосфорилирование осуществляется ферментами протеинкиназами, а дефосфорилирование - фосфопротеинфосфатазами. Присоединение остатка фосфорной кислоты приводит к изменению конформации активного центра и его каталитической активности. При этом результат может быть двояким: одни ферменты при фосфорилировании активируются, другие, напротив, становятся менее активными .
Изменение активности фермента, вызванное фосфорилированием, обратимо. Отщепление остатка фосфорной кислоты осуществляется ферментами фосфопротеинфосфатазами. Активность протеинкиназ и фосфопротеинфосфатаз регулируется гормонами, что позволяет быстро изменять активность ключевых ферментов метаболических путей в зависимости от условий внешней среды. Антагонистичные по функции гормоны противоположным образом влияют на фосфорилирование/дефосфорилирование ферментов, вызывая противоположные эффекты изменения метаболизма клетки.
Например, под действием глюкагона (в период между приѐмами пищи) в клетках происходит уменьшение синтеза энергетического материала - жира, гликогена и усиление его распада (мобилизация), вызванного фосфо-рилированием ключевых ферментов этих процессов. А под действием инсулина (во время пищеварения), наоборот, активируется синтез гликогена и ингибируется его распад, так как взаимодействие инсулина с рецептором активирует сигнальный путь, приводящий к дефосфорилированию тех же ключевых ферментов.
20. Ассоциация и диссоциация протомеров на примере протеинкиназы А и ограниченный протеолиз при активации протеолитических ферментов как способы регуляции каталитической активности ферментов.
В качестве примера регуляции каталитической активности ферментов ассоциацией или диссоциацией протомеров можно привести регуляцию активности фермента протеинкиназы А. Протеинкиназа А (цАМФзависимая) состоит из 4 субъединиц 2 типов: 2 регуля-торных (R) и 2 каталитических (С). Такой тетрамер не обладает каталитической активностью. Регуляторные субъединицы имеют участки связывания для циклического 3',5'-АМФ (цАМФ), по 2 на каждую субъединицу. Присоединение 4 молекул цАМФ к 2 регуляторным субъединицам приводит к изменению конформации регуляторных протомеров и к диссоциации тетрамерного комплекса, при этом высвобождаются 2 активные каталитические субъединицы . Такой механизм регуляции обратим. Отщепление молекул цАМФ от регуляторных
субъединиц приведѐт к ассоциации регуляторных и каталитических субъединиц протеинкиназы А с образованием неактивного комплекса.
Некоторые ферменты, функционирующие вне клеток (в ЖКТ или в плазме крови), синтезируются в виде неактивных предшественников и активируются только в результате гидролиза одной или нескольких определѐнных пептидных связей, что приводит к отщеплению части белковой молекулы предшественника. В результате в оставшейся части белковой молекулы происходит конформационная перестройка и формируется активный центр фермента.
Частичный протеолиз - пример регуляции, когда активность фермента изменяется необратимо. Такие ферменты функционируют, как правило, в течение короткого времени, определяемого временем жизни белковой молекулы. Частичный протеолиз лежит в основе активации протеолитических ферментов, белков свѐртывающей системы крови и фибринолиза, белков системы комплемента, а также пептидных гормонов.
21. Изоферменты, их происхождение, биологическое значение, привести примеры. Определение ферментов и изоферментного спектра плазмы крови с целью диагностики болезней.
Изоферменты. Часть ферментов состоят не из одной белковой цепочки, а из нескольких субъединиц. Изоферменты – это семейство ферментов, которые катализируют одну и ту же реакцию, но отличаются по строению и физико-химическим свойствам.
Например: лактатдегидрогеназа (ЛДГ) состоит их 4 субъединиц 2хтипов: субъединица Н, выделенная из сер дечной мышцы (heart – сердце), субъединица М, выделенная из скелетных мышц (musculus – мышца). Эти субъединицы кодируются разными генами. В разных органах имеются различные формы ЛДГ с различным набором субъединиц. Известно 5 изоферментов ЛДГ:
ЛДГ1: ЛДГ2: ЛДГ3: ЛДГ4: ЛДГ5: (Н4) (Н3М) (Н2М2) (НМ3) (М4)
ЛДГ1 экспрессируется в сердечной мышце и мозге, а ЛДГ5 – в скелетных мышцах и печени. Остальные формы в других органах. Появление ЛДГ в крови свидетельствует о повреждении органов (фермент из разрушенных клеток поступает в кровь – гиперферментемия) Повышение активности фракции ЛДГ1 в крови наблюдается при повреждении сердечной мышцы (инфаркт миокарда), а повышение активности ЛДГ5 в крови наблюдается при гепатитах и повреждении скелетных мышц. То есть благодаря изоферментам
можно определить локализацию поврежденного органа. Наиболее чувствительным тестом на инфаркт миокарда является повышение в крови сердечного изофермента креатинкиназы.
22. Энзимопатии наследственные (фенилкетонурия) и приобретенные (цинга). Применение ферментов для лечения болезней.
В основе многих заболеваний лежат нарушения функционирования ферментов в клетке - энзимопатии. Различают первичные (наследственные) и вторичные (приобретѐнные) энзимопатии. Приобретѐнные энзимопатии, как и вообще протеинопатии, по-видимому, наблюдают при всех болезнях.
При первичных энзимопатиях дефектные ферменты наследуются, в основном, по аутосомнорецессивному типу. Гетерозиготы, чаще всего, не имеют фенотипических отклонений. Первичные энзимопатии обычно относят к метаболическим болезням, так как происходит нарушение определѐнных метаболических путей. При этом развитие заболевания может протекать по одному из ниже перечисленных "сценариев". Рассмотрим условную схему метаболического пути:
Вещество А в результате последовательных ферментативных реакций превращается в продукт Р. При наследственной недостаточности какого-либо фермента, например фермента Е3, возможны разные нарушения метаболических путей:
Нарушение образования конечных продуктов. Недостаток конечного продукта этого метаболического пути (Р) (при отсутствии альтернативных путей синтеза) может приводить к развитию клинических симптомов, характерных для данного заболевания:
Накопление субстратов-предшественников. При недостаточности фермента Е3 будут накапливаться вещество С, а также во многих случаях и предшествующие соединения. Увеличение субстратовпредшественников дефектного фермента - ведущее звено развития многих заболеваний:
Нарушение образования конечных продуктов и накопление субстратов предшественников.Отмечают заболевания, когда одновременно недостаток продукта и накопление исходного субстрата вызывают клинические проявления.
Ферментные препараты широко используют в медицине. Ферменты в медицинской практике находят применение в качестве диагностических (энзимодиагностика) и терапевтических (энзимотерапия) средств. Кроме того, ферменты используют в качестве специфических реактивов для определения ряда веществ. Так, глюкозооксидазу применяют для количественного определения глюкозы в моче и крови. Фермент уреазу используют для определения содержания количества мочевины в крови и моче. С помощью различных дегидрогеназ обнаруживают соответствующие субстраты, например пируват, лактат, этиловый спирт и др.
А. Энзимодиагностика
Энзимодиагностика заключается в постановке диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях человека. Принципы энзимодиагностики основаны на следующих позициях:
при повреждении клеток в крови или других биологических жидкостях (например, в моче) увеличивается концентрация внутриклеточных ферментов повреждѐнных клеток;
количество высвобождаемого фермента достаточно для его обнаружения;
активность ферментов в биологических жидкостях, обнаруживаемых при повреждении клеток, стабильна в течение достаточно длительного времени И отличается от нормальных значений;
ряд ферментов имеет преимущественную или абсолютную локализацию в определѐнных органах (органоспецифичность);
существуют различия во внутриклеточной локализации ряда ферментов.
Б. Применение ферментов в качестве лекарственных средств
Использование ферментов в качестве терапевтических средств имеет много ограничений вследствие их высокой иммуногениости. Тем не менее энзимотерапию активно развивают в следующих направлениях:
заместительная терапия - использование ферментов в случае их недостаточности;
элементы комплексной терапии - применение ферментов в сочетании с другой терапией.
Заместительная энзимотерапия эффективна при желудочно-кишечных заболеваниях, связанных с недостаточностью секреции пищеварительных соков. Например, пепсин используют при ахилии, гипо- и анацидных гастритах. Дефицит панкреатических ферментов также в значительной степени может быть компенсирован приѐмом внутрь препаратов, содержащих основные ферменты поджелудочной железы (фестал, энзистал, мезим-форте и др.).
В качестве дополнительных терапевтических средств ферменты используют при ряде заболеваний. Протеолитические ферменты (трипсин, химотрипсин) применяют при местном воздействии для обработки гнойных ран с целью расщепления белков погибших клеток, для удаления сгустков крови или вязких секретов при воспалительных заболеваниях дыхательных путей. Ферментные препараты рибонуклеазу и дезоксирибонуклеазу используют в качестве противовирусных препаратов при лечении аденовирусных конъюнктивитов, герпетических кератитов.
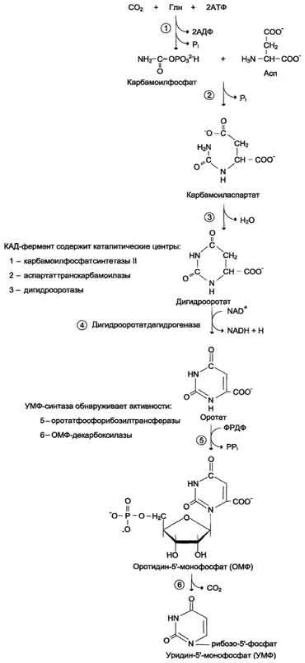
23. Общая схема синтеза и распада пиримидиновых нуклеотидов. Регуляция. Оротацидурия.
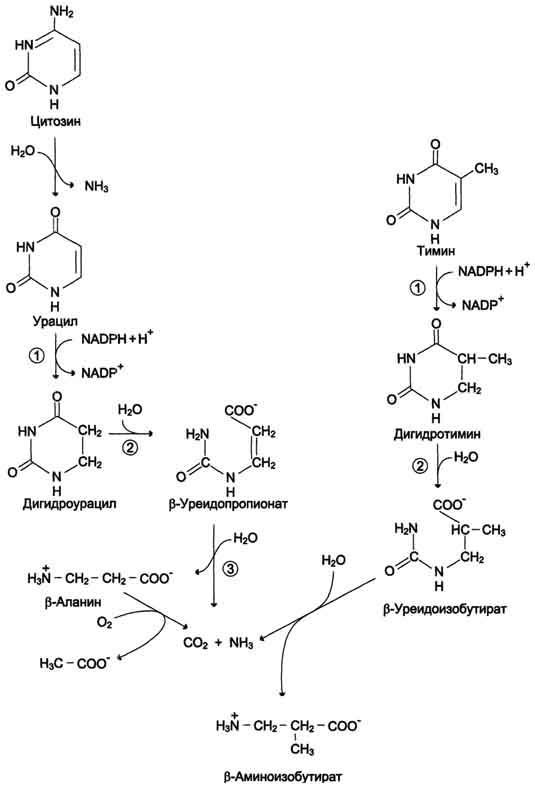
Рис. 10-16. Катаболизм пиримидиновых оснований. 1 - дигидропиримидиндегидрогеназа; 2 -
дигидропиримидинциклогидролаза; 3 - уреидопропионаза.

Оротацидурия
Это единственное нарушение синтеза пиримидинов de novo. Оно вызвано снижением активности УМФ-синтазы, которая катализирует образование и декарбоксилирование ОМФ. Поскольку в эмбриогенезе от образования пиримидинов de novo зависит обеспечение синтеза ДНК субстратами, то жизнь плода невозможна при полном отсутствии активности этого фермента. Действительно, у всех пациентов с оротацидурией отмечают заметную, хотя и очень низкую активность УМФ-синтазы. Установлено, что содержание оротовои кислоты в моче пациентов (1 г/сут и более) значительно превосходит количество оротата, которое ежедневно синтезируется в норме (около 600 мг/сут). Снижение синтеза пиримидиновых нуклеотидов, наблюдающееся при этой патологии, нарушает регуляцию КАД-фермента по механизму ретроингибирования, из-за чего возникает гиперпродукция оротата.
Клинически наиболее характерное следствие оротацидурии - мегалобластная анемия, вызванная неспособностью организма обеспечить нормальную скорость деления клеток эритроцитарного ряда. Еѐ диагностируют у детей на том основании, что она не поддаѐтся лечению препаратами фолиевой кислоты.
Недостаточность синтеза пиримидиновых нуклеотидов сказывается на интеллектуальном развитии, двигательной способности и сопровождается нарушениями работы сердца и ЖКТ. Нарушается формирование иммунной системы, и наблюдается повышенная чувствительность к различным инфекциям.
Гиперэкскреция оротовои кислоты сопровождается нарушениями со стороны мочевыводящей системы и образованием камней. При отсутствии лечения больные обычно погибают в первые годы жизни. При этом оротовая кислота не оказывает токсического эффекта. Многочисленные нарушения в работе разных систем организма вызваны "пиримидиновым голодом".
Для лечения этой болезни применяют уридин (от 0,5 до 1 г/сут), который по "запасному" пути превращается в УМФ.
Уридин + АТФ → УМФ + АДФ.
Нагрузка уридином устраняет "пиримидиновый голод", а поскольку из УМФ могут синтезироваться все остальные нуклеотиды пиримидинового ряда, то снижается выделение оротовои кислоты из-за восстановления механизма ретроингибирования КАД-фермента. Для больных оротацидурией лечение уридином продолжается в течение всей жизни, и этот нуклеозид становится для них незаменимым пищевым фактором.
Кроме генетически обусловленных причин, оротацидурия может наблюдаться:
при гипераммониемии, вызванной дефектом любого из ферментов орнитинового цикла,

за исключением карбамоилфосфатсинтетазы I. В этом случае карбамоилфосфат, синтезированный в митохондриях, выходит в цитозоль клеток и начинает использоваться на образование пиримидиновых нуклеотидов. Концентрация всех метаболитов, в том числе и оротовой кислоты, повышается. Наиболее значительная экскреция оротата отмечается при недостаточности орнитинкарбамоилтрансферазы (второго фермента орнитинового цикла);
в процессе лечения подагры аллопуринолом, который превращается в оксипуринолмононуклеотид и становится сильным ингибитором УМФ-синтазы. Это приводит к накоплению оротовой кислоты в тканях и крови.
24. Общая схема синтеза и распада пуриновых нуклеотидов. Регуляция. Подагра.

Гиперурикемия подагры
Когда в плазме крови концентрация мочевой кислоты превышает норму, то возникает гиперурикемия. Вследствие гиперурикемии может развиться подагра - заболевание, при котором кристаллы мочевой кислоты и уратов откладываются в суставных хрящах, синовиальной оболочке, подкожной клетчатке с образованием подагрических узлов, или тофусов. К характерным признакам подагры относят повторяющиеся приступы острого воспаления суставов (чаще всего мелких) - так называемого острого подагрического артрита. Заболевание может прогрессировать в хронический подагрический артрит.
Поскольку лейкоциты фагоцитируют кристаллы уратов, то причиной воспаления является разрушение лизосомальных мембран лейкоцитов кристаллами мочевой кислоты. Освободившиеся лизосомальные ферменты выходят в цитозоль и разрушают клетки, а продукты клеточного катаболизма вызывают воспаление.
Общий фонд сывороточных уратов в норме составляет ~ 1,2 г у мужчин и 0,6 г у женщин. При подагре без образования тофусов (т.е. подагрических узлов, в которых накапливаются ураты натрия и мочевая кислота) количество уратов возрастает до 2-4 г, а у пациентов с тяжѐлой формой болезни, сопровождающейся ростом тофусов, может достигать 30 г.
Подагра - распространѐнное заболевание, в разных странах ею страдают от 0,3 до 1,7% населения. А поскольку сывороточный фонд уратов у мужчин в 2 раза больше, чем у женщин, то они и болеют в 20 раз чаще, чем женщины.
Как правило, подагра генетически детерминирована и носит семейный характер. Она вызвана нарушениями в работе ФРДФ синтетазы или ферментов "запасного" пути: гипоксантин-гуанин- или аденинфосфорибозилтрансфераз.
К другим характерным проявлениям подагры относят нефропатию, при которой наблюдают
образование уратных камней в мочевыводящих путях. |
|
|
|||
25. |
Синтез |
дезоксирибонуклеотидов. |
Рибонуклеотидредуктазный |
комплекс. |
Биосинтез |
тимидиловых |
нуклеотидов, роль фолиевой кислоты и фолатредуктазы. |
Регуляция. |
|||

Противоопухолевые, антивирусные и антибактериальные препараты как ингибиторы синтеза рибо- и дезоксирибонуклеотидов.
Реакцию восстановления НДФ в дезоксипроизводные катализирует рибонуклеотидредуктазный комплекс, в состав которого входят: собственно рибонуклеотидредуктаза (РНР), белок тиоредоксин и фермент тиоредоксинредуктаза, обеспечивающий регенерацию восстановленной формы тиоредоксина .
Рибонуклеотидредуктаза - олигомерный белок, состоящий из двух В1- и двух В2-субъединиц, и содержит негеминовое железо в качестве кофактора.
Непосредственным донором водорода в реакции восстановления рибозы служит низкомолекулярный белок тиоредоксин. В рабочую часть этого белка входят 2 SH-группы, которые, отдавая водород, окисляются с образованием дисульфидного мостика. Второй фермент комплекса - тиоредоксинредуктаза - катализирует гидрирование окисленного тиоредоксина с использованием NADPH.
При участии комплекса РНР образуются: dАДФ, dГДФ, dУДФ и dЦДФ, которые с помощью НДФкиназ превращаются в дНТФ, 3 из которых (кроме дУДФ) непосредственно используются в синтезе ДНК.
дНДФ + АТФ → дНТФ + АДФ.
Тимидин-5'-монофосфат (дТМФ) образуется из дУМФ в реакции, катализируемой тимидилатсинтазой. Донором метильной группы, появляющейся в 5-положении пиримидинового кольца в молекуле дТМФ, служит кофермент тимидилатсинтазы - N5,N10-метилен-Н4-фолат. С помощью этого кофермента в молекулу дУМФ включается метиленовая группа и восстанавливается в метальную, используя 2 атома водорода от Н4-фолата.
Образование субстрата тимидилатсинтазной реакции - дУМФ осуществляется двумя путями
