
биохимия (Восстановлен)
.pdf
Схема
Оксидаза L-аминокислот
В печени и почках обнаружен фермент оксидаза L-аминокислот, способный дезаминировать некоторые L-аминокислоты (см. схему в конце стр.).
Коферментом в данной реакции выступает FMN. Однако вклад оксидазы L-аминокислот в дезаминирование, очевидно, незначителен, так как оптимум еѐ действия лежит в щелочной среде (рН 10,0). В клетках, где рН среды близок к нейтральному, активность фермента очень низка.
Оксидаза D-аминокислот также обнаружена в почках и печени. Это FAD-зависимый фермент. Оптимум рН этой оксидазы лежит в нейтральной среде, поэтому фермент более активен, чем оксидаза L- аминокислот. Роль оксидазы D-аминокислот невелика, так как количество D-изомеров в организме крайне мало, потому что в белки пищи и белки тканей человека и животных входят только природные L- аминокислоты. Вероятно, оксидаза D-аминокислот способствует их превращению в соответствующие L- изомеры (рис. 9-8).
74. Непрямое дезаминирование аминокислот. Схема процесса, субстраты, ферменты, кофакторы.
Большинство аминокислот не способно дезаминироваться в одну стадию, подобно Глу. Аминогруппы таких аминокислот в результате трансаминирования переносятся на α-кетоглутарат с образованием глутаминовой кислоты, которая затем подвергается прямому окислительному дезаминированию. Такой механизм дезаминирования аминокислот в 2 стадии получил название трансдезаминирования, или непрямого дезаминирования:
Непрямое дезаминирование аминокислот происходит при участии 2 ферментов: аминотрансферазы (кофермент ПФ) и глутаматдегидрогеназы (кофермент NAD+).
Значение этих реакций в обмене аминокислот очень велико, так как непрямое дезаминирование -
основной способ дезаминирования большинства аминокислот. Обе стадии непрямого дезаминирования обратимы , что обеспечивает как катаболизм аминокислот , так и возможность образования практически любой аминокислоты из соответствующей α-кетокислоты .
В мышечной ткани активность глутаматдегидрогеназы низка, поэтому в этих клетках при интенсивной физической нагрузке функционирует ещѐ один путь непрямого дезаминирования с участием цикла ИМФАМФ. Вначале происходит перенос аминогруппы аминокислот на аспартат, затем на инозиновую кислоту (ИМФ) и в завершение - дезаминирование АМФ. Представленная схема отражает последовательность реакций непрямого неокислительного дезаминирования:

Можно выделить 4 стадии процесса:
трансаминирование с α-кетоглутаратом, образование глутамата;
трансаминирование глутамата с оксалоацета-том (фермент ACT), образование аспартата;
реакция переноса аминогруппы от аспартата на ИМФ (инозинмонофосфат), образование АМФ и фумарата;
гидролитическое дезаминирование АМФ.
Перенос аминогруппы от аспартата и синтез АМФ происходят следующим образом .
Реакция дезаминирования адениловой кислоты происходит под действием фермента АМФ дезаминазы
.
Рис. 9-9. Биологическая роль непрямого дезаминирования. А - при катаболизме почти все природные аминокислоты сначала передают аминогруппу на а-кетоглутарат в реакции трансаминирования с образованием глутамата и соответствующей кетокислоты. Затем глутамат подвергается прямому окислительному дезаминированию под действием глутаматдегидрогена-зы, в результате чего получаются а- кетоглутарат и аммиак; Б - при необходимости синтеза аминокислот и наличии необходимых а-кетокислот обе стадии непрямого дезаминирования протекают в обратном направлении. В результате восстановительного аминирования а-кетоглутарата образуется глутамат, который вступает в трансаминирование с соответствующей а-кетокислотой, что приводит к синтезу новой аминокислоты.
Этот путь дезаминирования преобладает в мышцах при интенсивной работе, в результате которой накапливается молочная кислота. Выделяющийся аммиак предотвращает закисление среды в клетках, вызванное образованием лактата.
3. Неокислительное дезамитровате
В печени человека присутствуют специфические ферменты, катализирующие реакции дезаминирования аминокислот серина, треонина и гистидина неокислительным путѐм.
Неокислительное дезаминирование серина катализирует сериндегидратаза .

Реакция начинается с отщепления молекулы воды и образования метиленовой группы, затем происходит неферментативная перестройка молекулы, в результате которой образуется иминогруппа, слабо связанная с а-углеродным атомом. Далее в результате неферментативного гидролиза отщепляется молекула аммиака и образуется пируват.
Неокислительное дезаминирование треонина катализирует фермент треониндегидратаза. Механизм реакции аналогичен дезаминированию серина .Эти ферменты пиридоксальфосфатзависимые.
Неокислительное дезаминирование гистидина под действием фермента гистидазы (гистидин-
аммиаклиазы) является внутримолекулярным, так как образование молекулы аммиака происходит из атомов самой аминокислоты без участия молекулы воды. Эта реакция происходит только в печени и коже
75. Основные источники аммиака в организме человека. Токсичность аммиака. Роль глутамина и аспарагина в обезвреживании аммиака. Глутаминаза почек, образование и выведение солей аммония.
Основные источники аммиака
Источник |
Процесс |
Ферменты |
Локализация |
|
процесса |
||||
|
|
|
||
|
|
|
|
|
Аминокислоты |
Непрямое дезаминирование |
Аминотрансферазы, ПФ |
Все ткани |
|
|
(основной путь дезаминирования |
Глутаматдегидрогеназа, NAD+ |
|
|
|
аминокислот) |
|
|
|
|
|
|
|
|
|
Окислительное дезаминирование |
Глутаматдегидрогеназа, NAD+ |
Все ткани |
|
|
глутамата |
|
|
|
|
|
|
|
|
|
Неокислительное |
Гистидаза-Серин, |
Преимущественно |
|
|
дезаминирование Гис, Сер, Тре |
треониндегидратазы, ПФ |
печень |
|
|
|
|
|
|
|
Окислительное дезаминирование |
Оксидаза L-аминокислот, FMN |
Печень и почки |
|
|
аминокислот (малозначимый |
|
|
|
|
путь дезаминирования) |
|
|
|
|
|
|
|
|
Биогенные |
Окислительное дезаминирование |
Аминооксидазы, FAD |
Все ткани |
|
амины |
(путь инактивации биогенных |
|
|
|
|
аминов) |
|
|
|
|
|
|
|
|
АМФ |
Гидролитическое |
АМФ-дезаминаза |
Интенсивно |
|
|
дезаминирование |
|
работающая мышца |
|
|
|
|
|
Аммиак - токсичное соединение. Даже небольшое повышение его концентрации оказывает неблагоприятное действие на организм, и прежде всего на ЦНС. Так, повышение концентрации аммиака в мозге до 0,6 ммоль вызывает судороги. К симптомам гипераммониемии относят тремор, нечленораздельную речь, тошноту, рвоту, головокружение, судорожные припадки, потерю сознания. В тяжѐлых случаях развивается кома с летальным исходом.
Механизм токсического действия аммиака на мозг и организм в целом, очевидно, связан с действием его на несколько функциональных систем.
Аммиак легко проникает через мембраны в клетки и в митохондриях сдвигает реакцию, катализируемую глутаматдегидрогеназой, в сторону образования глугамата:
α-Кетоглутарат + NADH + Н+ + NH3 → Глутамат + NAD+.
Уменьшение концентрации α-кетоглутарата вызывает:
угнетение обмена аминокислот (реакции транса-минирования) и, следовательно, синтеза из них нейромедиаторов (ацетилхолина, дофамина и др.);

гипоэнергетическое состояние в результате снижения скорости ЦТК.
Недостаточность α-кетоглутарата приводит к снижению концентрации метаболитов ЦТК, что вызывает ускорение реакции синтеза оксалоа-цетата из пирувата, сопровождающейся интенсивным потреблением СО2. Усиленное образование и потребление диоксида углерода при гипераммониемии особенно характерны для клеток головного мозга.
Повышение концентрации аммиака в крови сдвигает рН в щелочную сторону (вызываеталкалоз). Это, в свою очередь, увеличивает сродство гемоглобина к кислороду, что приводит к гипоксии
тканей, накоплению СО2 и гипоэнергетическому состоянию, от которого главным образом страдает головной мозг.
Высокие концентрации аммиака стимулируют синтез глутамина из глутамата в нервной ткани (при участии глутаминсинтетазы):
Глутамат + NH3 + АТФ → Глутамин + АДФ + Н3Р04.
Накопление глутамина в клетках нейроглии приводит к повышению осмотического давления в них, набуханию астроцитов и в больших концентрациях может вызвать отѐк мозга. Снижение концентрации глутамата нарушает обмен аминокислот и нейромедиаторов, в частности синтез у- аминомасляной кислоты (ГАМК), основного тормозного медиатора. При недостатке ГАМК и других медиаторов нарушается проведение нервного импульса, возникают судороги.
Ион NH4+ практически не проникает через цитоплазматические и митохондриальные мембраны. Избыток иона аммония в крови способен нарушать трансмембранный перенос одновалентных катионов Na+ и К+, конкурируя с ними за ионные каналы, что также влияет на проведение нервных импульсов.
Связывание (обезвреживание) аммиака
Высокая интенсивность процессов дезаминирования аминокислот в тканях и очень низкий уровень аммиака в крови свидетельствуют о том, что в клетках активно происходит связывание аммиака с образованием нетоксичных соединений, которые выводятся из организма с мочой. Эти реакции можно считать реакциями обезвреживания аммиака. В разных тканях и органах обнаружено несколько типов таких реакций.
Основной реакцией связывания аммиака, протекающей во всех тканях организма, является синтез глутамина под действием глутамин-синтетазы:
Глутаминсинтетаза локализована в митохондриях клеток, для работы фермента необходим кофактор - ионы Mg2+. Глутаминсинтетаза - один из основных регуляторных ферментов обмена аминокислот и аллостерически ингибируется АМФ, глюкозо-6-фосфатом, а также Гли, Ала и Гис.
Глутамин легко транспортируется через клеточные мембраны путѐм облегчѐнной диффузии (для глутамата возможен только активный транспорт) и поступает из тканей в кровь. Основными тканями-поставщикам:и глутамина служат мышцы, мозг и печень. С током крови глутамин транспортируется в кишечник и почки.
В клетках кишечника под действием фермента глутаминазы происходит гидролитическое освобождение амидного азота в виде аммиака:
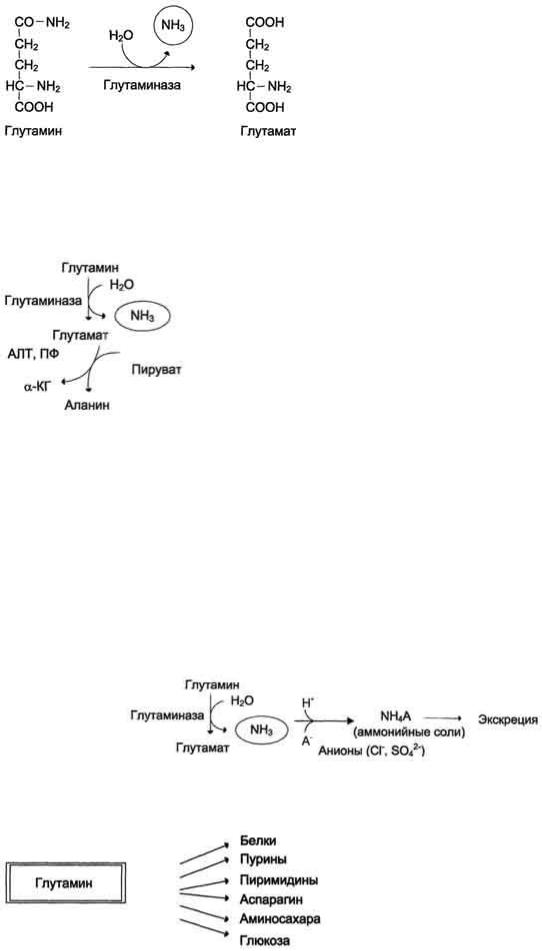
Образовавшийся в реакции глутамат подвергается трансаминированию с пируватом. ос-Аминогруппа глутаминовой кислоты переносится в состав аланина . Большие количества аланина поступают из кишечника в кровь воротной вены и поглощаются печенью. Около 5% образовавшегося аммиака удаляется в составе фекалий, небольшая часть через воротную вену попадает в печень, остальные ~90% выводятся почками.
Рис. 9-10. Метаболизм азота глутамина в кишечнике.
Впочках также происходит гидролиз глутамина под действием глутаминазы с образованием аммиака. Этот процесс является одним из механизмов регуляции кислотно щелочного равновесия в организме и сохранения важнейших катионов для поддержания осмотического давления. Глутаминаза почек значительно индуцируется при ацидозе, образующийся аммиак нейтрализует кислые продукты обмена и в
виде аммонийных солей экскретируется с мочой (рис. 9-11). Эта реакция защищает организм от излишней потери ионов Na+ и К+, которые также могут использоваться для выведения анионов и утрачиваться. При алкалозе количество глутаминазы в почках снижается.
Впочках образуется и выводится около 0,5 г солей аммония в сутки.
Высокий уровень глутамина в крови и лѐгкость его поступления в клетки обусловливают использование глутамина во многих анаболических процессах. Глутамин - основной донор азота в организме. Амидный азот глутамина используется для синтеза пуриновых и пиримидиновых
Рис. 9-11. Метаболизм амидного азота глутамина в почках.
нуклеотидов, аспарагина, аминосахаров и других соединений (рис. 9-12).
Рис. 9-12. Пути использования глутамина в организме.

Ещѐ одной реакцией обезвреживания аммиака в тканях можно считать синтез аспарагина под действием аспарагинсинтетазы.
Существуют 2 изоформы этого фермента - глутаминзависимая и аммиакзависимая, которые используют разные доноры амидных групп. Первая функционирует в животных клетках, вторая преобладает в бактериальных клетках, но присутствует и у животных. Однако такой путь обезвреживания аммиака в клетках человека используется редко и к тому же требует больших энергетических затрат (энергию двух макроэргических связей), чем синтез глутамина.
Наиболее значительные количества аммиака обезвреживаются в печени путѐм синтеза мочевины. В первой реакции процесса аммиак связывается с диоксидом углерода с образованием карбамоилфосфата, при этом затрачиваются 2 молекулы АТФ. Реакция происходит в митохондриях гепатоцитов под действием фермента карбамоилфос-фатсинтетазы I. Карбамоилфосфатсинтетаза II локализована в цитозоле клеток всех тканей и участвует в синтезе гшримидиновых нуклеотидов (см. раздел 10). Карбамоилфосфат затем включается в орнитиновый цикл и используется для синтеза мочевины.
В мозге и некоторых других органах может протекать восстановительное аминирование α- кетоглутарата под действием глутаматдегидрогеназы, катализирующей обратимую реакцию. Однако этот путь обезвреживания аммиака в тканях используется слабо, так как глутаматдегидрогеназа катализирует преимущественно реакцию дезаминирования глутамата. Хотя, если учитывать последующее образование глутамина, реакция выгодна для клеток, так как способствует связыванию сразу 2 молекул NH3.
Из мышц и кишечника избыток аммиака выводится преимущественно в виде аланина. Этот механизм необходим, так как активность глутаматдегидрогеназы в мышцах невелика и непрямое дезаминирование аминокислот малоэффективно. Поэтому в мышцах существует ещѐ один путь выведения азота. Образование аланина в этих органах можно представить следующей схемой (см. схему ниже).
Аминогруппы разных аминокислот посредством реакций трансаминирования переносятся на пируват, основным источником которого служит процесс окисления глюкозы.
Мышцы выделяют особенно много аланина в силу их большой массы, активного потребления
глюкозы при физической работе, а также потому, что часть энергии они получают за счѐт распада аминокислот. Образовавшийся аланин поступает в печень, где подвергается непрямому дезаминированию.

Выделившийся аммиак обезвреживается, а пируват включается в глюконеогенез. Глюкоза из печени поступает в ткани и там, в процессе гликолиза, опять окисляется до пирувата (рис. 9-13).
Образование аланина в мышцах, его перенос в печень и перенос глюкозы, синтезированной в печени, обратно в мышцы составляют глюкозо-аланиновый цикл, работа которого сопряжена с работой глюкозолактатного цикла .
76. Оринитиновый цикл мочевинообразования. Химизм, место протекания процесса. Энергетический эффект процесса, его регуляция. Количественное определение мочевины сыворотки крови, клиническое значение.
Мочевина - основной конечный продукт азотистого обмена, в составе которого из организма выделяется до 90% всего выводимого азота . Экскреция мочевины в норме составляет 25 г/сут.
При повышении количества потребляемых с пищей белков экскреция мочевины увеличивается. Мочевина синтезируется только в печени, что было установлено ещѐ в опытах И.Д. Павлова. Поражение печени и нарушение синтеза мочевины приводят к повышению содержания в крови и тканях аммиака и аминокислот (в первую очередь, глутамина и аланина).
В 40-х годах XX века немецкие биохимики Г. Кребс и К. Гензелейт установили, что синтез мочевины представляет собой циклический процесс, состоящий из нескольких стадий, ключевым соединением которого, замыкающим цикл, является орнитин. Поэтому процесс синтеза мочевины получил название "орнитиновый цикл", или "цикл Кребса-Гензелейта"

Первые две реакции процесса происходят в митохондриях гепатоцитов. Затем цитруллин, являющийся продуктом этих реакций, транспортируется в цитозоль, где и осуществляются дальнейшие превращения
Энергетический баланс процесса
В реакциях орнитинового цикла расходуются четыре макроэргических связи трѐх молекул АТФ на каждый оборот цикла. Однако процесс превращения аминокислот в безазотистые остатки и мочевину имеет пути компенсации энергозатрат:
при включении фумарата в ЦТК на стадии дегидрирования малата образуется NADH, который обеспечивает синтез 3 молекул АТФ (рис. 9-18);
при окислительном дезаминировании глутамата в разных органах также образуется NADH, соответственно - ещѐ 3 молекулы АТФ.
Затраты энергии происходят также и при трансмембранном переносе веществ, связанном с синтезом и экскрецией мочевины. Первые две реакции орнитинового цикла происходят в митохондриях, а последующие три - в цитозоле. Цитруллин, образующийся в митохондрии, должен быть перенесѐн в цитозоль, а орнитин, образующийся в цитозоле, необходимо транспортировать в митохондрию. Кроме того, в почках перенос мочевины из крови в мочу происходит путѐм активного транспорта за счѐт градиента ионов натрия, создаваемого К+,Nа+-АТФ-азой, что тоже сопряжено с энергозатратами.
Орнитиновый цикл в печени выполняет 2 функции:
превращение азота аминокислот в мочевину, которая экскретируется и предотвращает накопление токсичных продуктов, главным образом аммиака;
синтез аргинина и пополнение его фонда в организме.
Регуляторные стадии процесса - синтез карбамоилфосфата, синтез цитруллина и заключительная стадия, катализируемая аргиназой. Эффективность работы орнитинового цикла при нормальном питании человека и умеренных физических нагрузках составляет примерно 60% его мощности. Запас мощности необходим для избежания гипераммониемии при изменениях количества белка в пище. Увеличение скорости синтеза мочевины происходит при длительной физической работе или длительном голодании, которое сопровождается распадом тканевых белков. Некоторые патологические состояния, характеризующиеся интенсивным распадом белков тканей (сахарный диабет и др.), также сопровождаются активацией орнитинового цикла. При избыточном белковом питании количество ферментов орнитинового цикла в печени увеличивается, что приводит к интенсификации синтеза мочевины.
Определение концентрации мочевины в крови широко используется в диагностике, применяется для оценки тяжести патологического процесса, для наблюдения за течением заболевания и оценки эффективности проводимого лечения. Однако не следует забывать, что на уровень мочевины в крови могут влиять не только патологические, но и физиологические факторы (характер питания, физическая нагрузка и т. д.), а также прием лекарственных препаратов. Уровень мочевины может изменяться как в сторону повышения, так и снижения. При физиологических процессах степень отклонения уровня мочевины от нормы, как правило, незначительна, в то время как при патологии наблюдаются значительные сдвиги, причем степень изменения уровня мочевины зависит от тяжести патологического процесса.
Концентрация мочевины в сыворотке крови здоровых взрослых людей составляет 2,5 — 8,3 ммоль/л (660 мг/л). У женщин, по сравнению со взрослыми мужчинами, концентрация мочевины в сыворотке крови обычно ниже. У пожилых людей (старше 60 лет) наблюдается некоторое увеличение

концентрации мочевины в сыворотке крови (примерно на 1 ммоль/л по сравнению с нормой здоровых взрослых людей), что обусловлено снижением у пожилых способности почек концентрировать мочу.
77. Декарбоксилирование аминокислот. Биогенные амины: гистамин, серотонин, ГАМК, , путресцин. Реакции их образования , ферменты , кофактор. Биороль биогенных аминов. Дезаминирование и метилирование аминов как пути их обезвреживания.
Некоторые аминокислоты и их производные могут подвергаться декарбоксилированию - отщеплению ос-карбоксильной группы. В тканях млекопитающих декарбоксилированию может подвергаться целый ряд аминокислот или их производных: Три, Тир, Вал, Гис, Глу, Цис, Apr, Орнитин, SAM, ДОФА, 5- окситриптофан и др. Продуктами реакции являются СО2 и амины, которые оказывают выраженное биологическое действие на организм (биогенные амины):
Реакции декарбоксилирования необратимы и катализируются ферментами декарбоксилазами. Простетическая группа декарбоксилаз в клетках животных - пиридоксальфосфат. Некоторые декарбоксилазы микроорганизмов могут содержать вместо ПФ остаток пирувата - гистидиндекарбоксилаза Micrococcus и Lactobacilus, SAM-декарбоксилаза Е. coli и др. Механизм реакции напоминает реакцию трансаминирования с участием пиридоксальфосфата и также осуществляется путѐм формирования шиффова основания ПФ и аминокислоты на первой стадии.
Амины, образовавшиеся при декарбоксилировании аминокислот, часто являются биологически активными веществами. Они выполняют функцию нейромедиаторов (серотонин, дофамин, ГАМК и др.), гормонов (норадреналин, адреналин), регуляторных факторов местного действия (гистамин, карнозин, спермин и др.).

В. Роль аргинина и орнитина в синтезе биологически активных молекул
Обмен аминокислоты аргинина связан с реакциями орнитинового цикла, которые можно рассматривать как путь синтеза аргинина. Под действием аргиназы в цикле происходит и распад аргинина на орнитин и мочевину.
Аргинин выполняет в организме важные функции:
используется в синтезе креатина, который в виде креатинфосфата способен служить источником энергии для работы мышц человека и млекопитающих. В мышцах беспозвоночных аналогичную энергетическую функцию способен выполнять аргининфосфат.
служит источником NO в организме;
служит предшественником орнитина, из которого синтезируются полиамины.
1.Аргинин - источник NO в организме
2. Образование спермидина и спермина, их биологическая роль
Аргинин под действием аргиназы превращается в аминокислоту орнитин, которая не входит в состав белков организма. Из орнитина синтезируются полиамины спермидин и спермин (см. схему А на с. 518).
Спермидин, спермин и путресцин обнаружены в ядрах клеток всех органов человека. Они имеют большой положительный заряд, легко связываются с отрицательно заряженными молекулами ДНК и РНК, входят в состав хроматина и участвуют в репликации ДНК, стимулируют транскрипцию и трансляцию. Их концентрация сильно возрастает при интенсивной пролиферации тканей.
Фермент орнитиндекарбоксилаза - регулируемый. Он отличается очень коротким Т1/2 - всего 10 мин. Гормон роста, кортикостероиды, тестостерон быстро увеличивают его количество в 10-200 раз.
Катаболизм полиаминов до СО2 и Н2О происходит под действием полиаминоксидазы в печени. Часть их в ацетилированном виде экскретируется почками.
