
биохимия (Восстановлен)
.pdfповышению АД. Не последнюю роль нарушение функционирования Са2+-АТФ-азы играет в развитии атеросклероза, рака, иммунных патологий.
2. Вторично-активный транспорт
Перенос некоторых растворимых веществ против градиента концентрации зависит от одновременного или последовательного переноса другого вещества по градиенту концентрации в том же направлении (активный симпорт) или в противоположном (активный антипорт). В клетках человека ионом, перенос которого происходит по градиенту концентрации, чаще всего служит Na+.
Примером такого типа транспорта может служить Na+,Са2+-обменник плазматической мембраны (активный антипорт), ионы натрия по градиенту концентрации переносятся в клетку, а ионы Са2+против градиента концентрации выходят из клетки (рис. 5-21).
По механизму активного симпорта происходят всасывание глюкозы клетками кишечника и реабсорбция из первичной мочи глюкозы, аминокислот клетками почек (рис. 5-22).
Г. Перенос через мембрану макромолекул и частиц: эндоцитоз и экзоцитоз
Траспортные белки обеспечивают перемещение через клеточную мембрану полярных молекул небольшого размера, но они не могут транспортировать макромолекулы, например белки, нуклеиновые кислоты, полисахариды или ещѐ более крупные частицы. Механизмы, с помощью которых клетки могут усваивать такие вещества или удалять их из клетки, отличаются от механизмов транспорта ионов и полярных соединений.
Эндоцитоз
Перенос вещества из среды в клетку вместе с частью плазматической мембраны называют"эндоцитоз". Путем эндоцитоза (фагоцитоза) клетки могут поглощать большие частицы, такие как вирусы, бактерии или обломки клеток. Захват больших частиц осуществляется в основном специализированными клетками - фагоцитами.
Поглощение жидкости и растворѐнных в ней веществ с помощью небольших пузырьков называют "пиноцитоз". Усвоение веществ механизмом эндоцитоза (пиноцитоза) характерно для всех клеток.
Цикл эндоцитоза начинается в определѐнных участках плазматической мембраны, называемых"окаймлѐнные ямки". На долю окаймлѐнных ямок приходится всего 1-2% общей площади мембраны. Белок клатрин образует решѐтчатые структуры, связанные с углублениями на поверхности плазматической мембраны.
Окаймлѐнные ямки втягиваются в клетку, сужаются у основания, отделяются от мембраны, образуя окаймлѐнные пузырьки (пиноцитозные пузырьки). Время жизни окаймлѐнных ямок невелико, они формируются в течение минуты, затем совершают цикл эндоцитоза.
Вещества в составе пиноцитозных пузырьков не смешиваются с другими макромолекулами клетки. Они заканчивают свой путь в лизосомах, а мембранные компоненты пузырьков, содержащие клатрин, возвращаются в плазматическую мембрану.
Эндоцитоз, происходящий с участием рецепторов, встроенных в окаймлѐнные ямки, позволяет клеткам поглощать специфические вещества. Макромолекулы или частицы связываются рецепторами и накапливаются в окаймлѐнной ямке. Затем следует погружение в клетку и отделение эндоцитозного пузырька, в составе которого находится поглощѐнное вещество, мембранные компоненты окаймлѐнной ямки и рецептор. В разные окаймлѐнные ямки могут быть встроены разные рецепторы.
Экзоцитоз
Макромолекулы, например белки плазмы крови, пептидные гормоны, пищеварительные ферменты, белки внеклеточного матрикса, липопротеиновые комплексы, синтезируются в клетках и затем секретируются в межклеточное пространство или кровь. Но мембрана непроницаема для таких макромолекул или комплексов, их секреция происходит путѐм экзоцитоза. Особенность экзоцитоза в том,
что секретируемые вещества локализуются в пузырьках и не смешиваются с другими макромолекулами или органеллами клетки. В ходе экзоцитоза содержимое секреторных пузырьков выделяется во внеклеточное пространство, когда они сливаются с плазматической мембраной.
В организме имеются как регулируемый, так и нерегулируемый пути экзоцитоза. Нерегулируемая секреция характеризуется непрерывным синтезом секретируемых белков, упаковкой их в транспортные пузырьки в аппарате Гольджи и переносом к плазматической мембране для секреции. Примером может служить синтез и секреция коллагена фибробластами для формирования межклеточного матрикса.
Для регулируемой секреции характерны хранение приготовленных на экспорт молекул в транспортных пузырьках и их слияние с плазматической мембраной только при воздействии на клетку специфического стимула.
Мембранные рецепторы
Очень часто у белков есть гидрофобные участки, которые взаимодействуют с липидами, и гидрофильные участки, которые находятся на поверхности мембраны клетки, соприкасаясь с водным
содержимым клетки. Большинство мембранных рецепторов — именно такие трансмембранные белки.
Многие из мембранных белков-рецепторов связаны с углеводными цепями, то есть представляют собой гликопротеиды. На их свободных поверхностях находятся олигосахаридные цепи (гликозильные
группы), похожие на антенны. Такие цепочки, состоящие из нескольких моносахаридных остатков, имеют самые различные формы, что объясняется разнообразием связей между моносахаридными остатками и существованием α- и β-изомеров.
Функция «антенн» — это распознавание внешних сигналов. Распознающие участки двух соседних клеток могут обеспечивать сцепление клеток, связываясь друг с другом. Благодаря этому клетки ориентируются и создают ткани в процессе дифференцировки. Распознающие участки присутствуют и в некоторых молекулах, которые находятся в растворе, благодаря чему они избирательно поглощаются клетками, имеющими комплементарные распознающие участки (так, например, поглощаются ЛПНП с помощью рецепторов ЛПНП).
Два основных класса мембранных рецепторов — это метаботропные рецепторы и ионотропные рецепторы.
Ионотропные рецепторы представляют собой мембранные каналы, открываемые или закрываемые при связывании с лигандом. Возникающие при этом ионные токи вызывают изменения трансмембранной разности потенциалов и, вследствие этого, возбудимости клетки, а также меняют внутриклеточные концентрации ионов, что может вторично приводитъ к активации систем внутриклеточных посредников. Одним из наиболее полно изученных ионотропных рецепторов является н-холинорецептор.
Метаботропные рецепторы связаны с системами внутриклеточных посредников. Изменения их конформации при связывании с лигандом приводит к запуску каскада биохимических реакций, и, в конечном счете, изменению функционального состояния клетки. Основные типы мембранных рецепторов:
1.Рецепторы, связанные с гетеротримерными G-белками (например, рецептор вазопрессина).
2.Рецепторы, обладающие внутренней тирозинкиназной активностью (например, рецептор инсулина или рецептор эпидермального фактора роста).
Рецепторы, связанные с G-белками, представляют собой трансмембранные белки, имеющие 7 трансмембранных доменов, внеклеточный N-конец и внутриклеточный C-конец. Сайт связывания с лигандом находится на внеклеточных петлях, домен связывания с G-белком — вблизи C-конца в цитоплазме.
Активация рецептора приводит к тому, что его α-субъединица диссоциирует от βγ-субъединичного комплекса и таким образом активируется. После этого она либо активирует, либо наоборот инактивирует фермент, продуцирующий вторичные посредники.
Рецепторы с тирозинкиназной активностью фосфорилируют последующие внутриклеточные белки, часто тоже являющиеся протеинкиназами, и таким образом передают сигнал внутрь клетки. По структуре это —
трансмембранные белки с одним мембранным доменом. Как правило, гомодимеры, субъединицы которых связаны дисульфидными мостиками
46. Эндэргонические и экзэргонические реакции в живой клетке. Макроэргические соединения. Дегидрирование субстратов и окисление водорода как основной источник энергии для синтеза АТФ.
3.Эндергонические и экзергонические реакции
Направление химической реакции определяется значением ΔG. Если эта величина отрицательна, то реакция протекает самопроизвольно и сопровождается уменьшением свободной энергии. Такие реакции называют экзергоническими. Если при этом абсолютное значение ΔG велико, то реакция идѐт практически до конца, и еѐ можно рассматривать как необратимую.
Если ΔG положительно, то реакция будет протекать только при поступлении свободной энергии извне; такие реакции называют эндергоническими.
Если абсолютное значение ΔG велико, то система устойчива, и реакция в таком случае практически не осуществляется. При ΔG, равном нулю, система находится в равновесии .
4. Сопряжение экзергонических и эндергонических процессов в организме
В биологических системах термодинамически невыгодные (эндергонические) реакции могут протекать лишь за счѐт энергии экзергонических реакций. Такие реакции называют энергетически сопряжѐнными. Многие из этих реакций происходят при участии аденозинтрифосфата (АТФ), играющего роль сопрягающего фактора.
Б. Характеристика высокоэнергетических фосфатов. Цикл АТФ-АДФ
В живых организмах существует целая группа органических фосфатов, гидролиз которых приводит к освобождению большого количества свободной энергии. Такие соединения называют высокоэнергетическими фосфатами .
Разные фосфорилированные соединения обладают разным запасом свободной энергии. К группе высокоэнергетических фосфатов, помимо АТФ, относят енолфосфаты, ангидриды и фосфогуанидины.
АТФ - молекула, богатая энергией, поскольку она содержит две фосфоангидридные связи (β, γ). При гидролизе концевой фосфоангидридной связи АТФ превращается в АДФ и ортофосфат Рi При этом изменение свободной энергии составляет -7,3 ккал/моль. При условиях, существующих в клетке в норме (рН 7,0, температура 37 °С), фактическое значение ΔG0' для процесса гидролиза составляет около -12 ккал/моль. Величина свободной энергии гидролиза АТФ делает возможным его образование из АДФ за счѐт переноса фосфатного остатка от таких высокоэнергетических фосфатов, как, например, фосфоенолпируват или 1,3- бисфосфоглицерат; в свою очередь, АТФ может участвовать в таких эндергонических реакциях, как фосфорилирование глюкозы или глицерина. АТФ выступает в роли донора энергии в эндергонических реакциях многих анаболических процессов. Некоторые биосинтетические реакции в организме могут протекать при участии других нуклеозидтрифосфатов, аналогов АТФ; к ним относят гуанозинтрифосфат (ГТФ), уридинтрифосфат (УТФ) и цитидинтрифосфат (ЦТФ). Все эти нуклеотиды, в свою очередь, образуются при использовании свободной энергии концевой фосфатной группы АТФ. Наконец, за счѐт свободной энергии АТФ совершаются различные виды работы, лежащие в основе жизнедеятельности организма, например, такие как мышечное сокращение или активный транспорт веществ.
Таким образом, АТФ - главный, непосредственно используемый донор свободной энергии в биологических системах. В клетке молекула АТФ расходуется в течение одной минуты после еѐ образования. У человека количество АТФ, равное массе тела, образуется и разрушается каждые 24 ч.
Использование АТФ как источника энергии возможно только при условии непрерывного синтеза АТФ из АДФ за счѐт энергии окисления органических соединений . Цикл АТФ-АДФ - основной механизм обмена энергии в биологических системах, а АТФ - универсальная "энергетическая валюта".
Г. Основные этапы трансформации энергии катаболических процессов

Энергия освобождается в процессе ферментативного окисления метаболитов специфическими дегидрогеназами. В реакциях дегидрирования электроны и протоны переходят от органических субстратов на коферменты NAD- и FAD-зависимых дегидрогеназ. Электроны, обладающие высоким энергетическим потенциалом, передаются от восстановленных коферментов NADH и FADH2 к кислороду через цепь переносчиков, локализованных во внутренней мембране митохондрий. Восстановление молекулы О2 происходит в результате переноса 4 электронов. При каждом присоединении к кислороду 2 электронов, поступающих к нему по цепи переносчиков, из матрикса поглощаются 2 протона, в результате чего образуется молекула Н2О.
Окисление органических веществ в клетках, сопровождающееся потреблением кислорода и синтезом воды, называют тканевым дыханием, а цепь переноса электронов (ЦПЭ) - дыхательной цепью.
Электроны, поступающие в ЦПЭ, по мере их продвижения от одного переносчика к другому теряют свободную энергию. Значительная часть этой энергии запасается в форме АТФ, а часть энергии рассеивается в вице тепла. Кроме того, электроны с высоким энергетическим потенциалом, возникающие при окислении различных субстратов, могут быть использованы в реакциях биосинтеза, для которых помимо АТФ требуются восстановительные эквиваленты, например NADPH.
47. Строение митохондрий и структурная организация дыхательной цепи. НАД-зависимые и флавиновые дегидрогеназы. Комплексы дыхательной цепи: НАДН-дегидрогеназа, убихинолдегидрогеназа (цитохром C редуктаза), цитохром C оксидаза.
Рис. 6-13. Сопряжение дыхания и синтеза АТФ в митохондриях. I - NADH-дегидрогеназа; II - сукцинат дегидрогеназа; III - QН2-дегидрогеназа; IV - цитохромоксидаза; V - АТФ-синтаза. Энергия протонного потенциала (электрохимического потенциала ΔμН+ используется для синтеза АТФ, если протоны возвращаются в матрикс через ионные каналы АТФ-синтазы.
Сопряжение переноса электронов через дыхательный комплекс III с транспортом Н+ через мембрану. Восстановленный убихинон (QH2) взаимодействует с Fе3+ гема b1 и, восстанавливая его, освобождает протон в водную фазу, превращаясь в семихинон (НQ•). Электрон от тема b1 переносится на Fe3+ тема b2. HQ• отдаѐт второй электрон на FeS-центр, расположенный ближе к наружной поверхности мембраны; при этом второй протон оказывается в межмембранном пространстве; электрон передаѐтся на

цитохром с1, а далее на цитохром с. Окисленный Q диффундирует к внутренней стороне мембраны, где получает электрон от тема b2 и протон из матрикса, превращаясь в НQ•. НQ• получает электрон от комплекса I и протон из матрикса; в мембране образуется QН2, и весь процесс повторяется сначала.
Таблица 6-4. Компоненты митохондриальной цепи переноса электронов
Название компонента |
Простетическая группа |
Донор e |
Акцептор е |
|
|
|
|
NADH-дегидрогеназа, |
FMN, FeS |
NADH |
KoQ |
комплекс I |
|
|
|
|
|
|
|
Коэнзим Q, убихинон |
|
NADH |
Комплекс III (bc1) |
|
|
|
|
QН2-дегидрогеназа, комплекс |
FeS, гем b1 (562), гемb2(566),гемм |
QH2 |
Цитохром с |
III |
с1 |
|
|
Цитохром с |
Гем с |
Комплекс III |
Комплекс IV |
|
|
|
|
Цитохромоксидаза, комплекс |
Гем А |
Цитохром с |
O2 |
IV |
Сu2+ |
|
|
Сукцинатдегидрогеназа, |
FAD, FeS |
Сукцинат |
KoQ |
комплекс II |
|
|
|
|
|
|
|
48. Окислительное фосфорилирование, сущность процесса, схема, субстраты, коэффициент Р/О. Трансмембранный электрохимический потенциал как промежуточная форма энергии при окислительном фосфорилировании. Теория Митчелла. Н+-АТФ-синтаза: роль, локализация, строение, механизм синтеза АТФ.
Синтез АТФ из АДФ и Н3РО4 за счѐт энергии переноса электронов по ЦПЭ называют окислительным фосфорилированием.
А. Механизм сопряжения окисления и фосфорилирования
Каким же образом осуществляется сопряжение этих двух процессов? Наиболее обоснованный ответ на этот вопрос даѐт хемиосмотическая теория Митчелла, предложенная им в 1961 г. Основные положения были подтверждены и разработаны детально совместными усилиями многих исследователей в последующие годы.
Перенос электронов по дыхательной цепи от NADH к кислороду сопровождается выкачиванием протонов из матрикса митохондрий через внутреннюю мембрану в межмембранное пространство. На эту работу затрачивается часть энергии электронов, переносимых по ЦПЭ.
Протоны, перенесѐнные из матрикса в межмембранное пространство, не могут вернуться обратно в матрикс, так как внутренняя мембрана непроницаема для протонов. Таким образом, создаѐтся протонный градиент, при котором концентрация протонов в межмембранном пространстве больше, а рН меньше, чем в матриксе. Кроме того, каждый протон несѐт положительный заряд, и вследствие этого появляется разность потенциалов по обе стороны мембраны: отрицательный заряд на внутренней стороне и положительный - на внешней. В совокупности электрический и концентрационный градиенты составляют электрохимический потенциал ΔμН+ - источник энергии для синтеза АТФ. Так как наиболее активный транспорт протонов в межмембранное пространство, необходимый для образования ΔμН+, происходит на участках ЦПЭ, соответствующих расположению комплексов I, III и IV, эти участки называют пунктами сопряжения дыхания и фосфорилирования (рис. 6-11, 6-13).
Механизм транспорта протонов через мито-хондриальную мембрану в пунктах сопряжения недостаточно ясен. Однако установлено, что важную роль в этом процессе играет KoQ. Наиболее детально механизм переноса протонов при участии KoQ изучен на уровне комплекса III (рис. 6-14).
KoQ переносит электроны от комплекса I к комплексу III и протоны из матрикса в межмембранное пространство, совершая своеобразные циклические превращения, называемые Q-циклами. Донором электронов для комплекса III служит восстановленный убихинон (QH2), а акцептором - цитохром с.
Цитохром с находится с внешней стороны внутренней мембраны митохондрий; там же располагается активный центр цитохрома с1 с которого электроны переносятся на цитохром с.
В мембране существует стационарный общий фонд Q/QH2, из которого каждая молекула QH2 в одном цикле обеспечивает перенос протонов из матрикса в межмембранное пространство и электронов, которые в конечном итоге поступают на кислород. На работу, совершаемую при выкачивании протонов, расходуется часть свободной энергии, которая освобождается при переносе электронов по градиенту редокс-потенциала. Энергия электрохимического потенциала (∆μH+) используется для синтеза АТФ, если протоны возвращаются в матрикс через ионные каналы АТФ-синтазы.
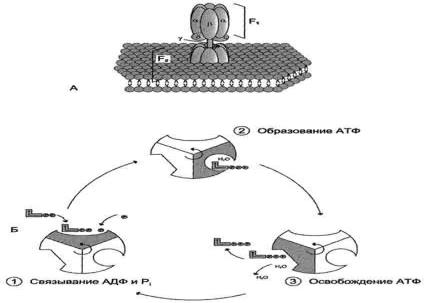
2. Строение АТФ-синтазы и синтез АТФ
АТФ-синтаза (Н+-АТФ-аза) - интегральный белок внутренней мембраны митохондрий. Он расположен в непосредственной близости к дыхательной цепи. АТФ-синтаза состоит из 2 белковых комплексов, обозначаемых как F0 и F1 (рис. 6-15).
Рис. 6-15. Строение и механизм действия АТФ-синтазы. А - F0 и F1 - комплексы АТФ-синтазы, В состав
F0входят полипептидные цепи, которые образуют канал, пронизывающий мембрану насквозь. По этому каналу протоны возвращаются в матрикс из межмембранного пространства; белок F1 выступает в матрикс с внутренней стороны мембраны и содержит 9 субъединиц, 6 из которых образуют 3 пары α и β ("головка"), прикрывающие стержневую часть, которая состоит из 3 субъединиц γ, δ и ε. γ и ε подвижны и образуют стержень, вращающийся внутри неподвижной головки и связанный с комплексом F0. В активных центрах, образованных парами субъединиц α и β, происходит связывание АДФ, неорганического фосфата (Рi) и АТФ. Б - Каталитический цикл синтеза АТФ включает 3 фазы, каждая из которых проходит поочерѐдно в 3 активных центрах: 1 - связывание АДФ и Н3РО4; 2 - образование фосфоангидридной связи АТФ; 3 - освобождение конечного продукта. При каждом переносе протонов через канал F0 в матрикс все 3 активных центра катализируют очередную фазу цикла. Энергия электрохимического потенциала расходуется на поворот стержня, в результате которого циклически изменяется конформация α- и β-субъединиц и происходит синтез АТФ.
3.Коэффициент окислительного фосфорилирования
Окисление молекулы NADH в ЦПЭ сопровождается образованием 3 молекул АТФ; электроны от FADзависимых дегидрогеназ поступают в ЦПЭ на KoQ, минуя первый пункт сопряжения. Поэтому образуются только 2 молекулы АТФ. Отношение количества фосфорной кислоты (Р), использованной на фосфорилирование АДФ, к атому кислорода (О), поглощѐнного в процессе дыхания, называют коэффициентом окислительного фосфорилирования и обозначают Р/О. Следовательно, для NADH Р/О = 3, для сукцината Р/О - 2. Эти величины отражают теоретический максимум синтеза АТФ, фактически эта величина меньше.
49.Регуляция цепи переноса электронов (дыхательный контроль). Разобщение тканевого дыхания и окислительного фосфорилирования. Терморегуляторная функция тканевого дыхания. Термогенная функция энергетического обмена в бурой жировой ткани.
4.Дыхательный контроль
Окисление субстратов и фосфорилирование АДФ в митохондриях прочно сопряжены. Скорость использования АТФ регулирует скорость потока электронов в ЦПЭ. Если АТФ не используется и его концентрация в клетках возрастает, то прекращается и поток электронов к кислороду. С другой стороны, расход АТФ и превращение его в АДФ увеличивает окисление субстратов и поглощение кислорода. Зависимость интенсивности дыхания митохондрий от концентрации АДФ называют дыхательным контролем. Механизм дыхательного контроля характеризуется высокой точностью и имеет важное значение, так как в результате его действия скорость синтеза АТФ соответствует потребностям клетки в энергии. Запасов АТФ в клетке не существует. Относительные концентрации АТФ/АДФ в тканях изменяются в узких пределах, в то время как потребление энергии клеткой, т.е. частота оборотов цикла АТФ и АДФ, может меняться в десятки раз.
Общее содержание АТФ в организме 30-50 г, но каждая молекула АТФ в клетке "живѐт" меньше минуты. В сутки у человека синтезируется 40-60 кг АТФ и столько же распадается. Увеличение концентрации АДФ немедленно приводит к ускорению дыхания и фосфорилирования.
Б. Транспорт АТФ и АДФ через мембраны митохондрий
Вбольшинстве эукариотических клеток синтез основного количества АТФ происходит внутри митохондрии, а основные потребители АТФ расположены вне еѐ. С другой стороны, в матриксе митохондрий должна поддерживаться достаточная концентрация АДФ. Эти заряженные молекулы не могут самостоятельно пройти через липидный слой мембран. Внутренняя мембрана непроницаема для заряженных и гидрофильных веществ, но в ней содержится определѐнное количество транспортѐров, избирательно переносящих подобные молекулы из цитозоля в матрикс и из матрикса в цитозоль.
Вмембране есть белок АТФ/АДФ-антипортер, осуществляющий перенос этих метаболитов через мембрану (рис. 6-16). Молекула АДФ поступает в митоходриальный матрикс только при условии выхода молекулы АТФ из матрикса.
Движущая сила такого обмена - мембранный потенциал переноса электронов по ЦПЭ. Расчѐты показывают, что на транспорт АТФ и АДФ расходуется около четверти свободной энергии протонного потенциала. Другие транспортѐры тоже могут использовать энергию электрохимического градиента. Так переносится внутрь митохондрии неорганический фосфат, необходимый для синтеза АТФ. Непосредственным источником свободной энергии для транспорта Са2+ в матрикс также служит протонный потенциал, а не энергия АТФ.
В. Разобщение дыхания и фосфорилирования
Некоторые химические вещества (протонофоры) могут переносить протоны или другие ионы (ионофоры) из межмембранного пространства через мембрану в матрикс, минуя протонные каналы АТФсинтазы. В результате этого исчезает электрохимический потенциал и прекращается синтез АТФ. Это явление называют разобщением дыхания и фосфорилирования. В результате разобщения количество АТФ снижается, а АДФ увеличивается. В этом случае скорость окисления NADH и FADH2возрастает, возрастает и количество поглощѐнного кислорода, но энергия выделяется в виде теплоты, и коэффициент Р/О резко снижается. Как правило, разобщители - липофильные вещества, легко проходящие через липидный слой мембраны. Одно из таких веществ - 2,4-динитрофенол, легко переходящий из ионизированной формы в неионизированную, присоединяя протон в межмембранном пространстве и перенося его в матрикс.
Примерами разобщителей могут быть также некоторые лекарства, например дикумарол - антикоагулянт или метаболиты, которые образуются в организме, билирубин - продукт катаболизма тема, тироксин - гормон щитовидной железы . Все эти вещества проявляют разобщающее действие только при их высокой концентрации.
Г. Терморегуляторная функция ЦПЭ
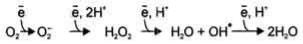
На синтез молекул АТФ расходуется примерно 40-45% всей энергии электронов, переносимых по ЦПЭ, приблизительно 25% тратится на работу по переносу веществ через мембрану. Остальная часть энергии рассеивается в виде теплоты и используется теплокровными животными на поддержание температуры тела. Кроме того, дополнительное образование теплоты может происходить при разобщении дыхания и фосфорилирования. Разобщение окислительного фосфорилирования может быть биологически полезным. Оно позволяет генерировать тепло для поддержания температуры тела у новорождѐнных, у зимнеспящих животных и у всех млекопитающих в процессе адаптации к холоду. У новорождѐнных, а также зимнеспящих животных существует особая ткань, специализирующаяся на теплопродукции посредством разобщения дыхания и фосфорилирования - бурый жир. Бурый жир содержит много митохондрий. В мембране митохондрий имеется большой избыток дыхательных ферментов по сравнению с АТФ-синтазой. Около 10% всех белков приходится на так называемый разобщающий белок (РБ-1) - термогенин. Бурый жир имеется у новорождѐнных, но его практически нет у взрослого человека. В последние годы появились факты, свидетельствующие о существовании в митохондриях разных органов и тканей млекопитающих разобщающих белков, похожих по своей структуре на РБ-1 бурой жировой ткани. По своей структуре термогенин близок к АТФ/АДФ-антипортеру, но не способен к транспорту нуклеотидов, хотя сохранил способность переносить анионы жирных кислот, служащих разобщителями .
На внешней стороне мембраны анион жирной кислоты присоединяет протон и в таком виде пересекает мембрану; на внутренней стороне мембраны диссоциирует, отдавая протон в матрикс и тем самым снижает протонный градиент. Образующийся анион возвращается на наружную сторону мембраны с помощью АТФ/ АДФ-антипортера.
При охлаждении стимулируется освобождение норадреналина из окончаний симпатических нервов. В результате происходят активация липазы в жировой ткани и мобилизация жира из жировых депо. Образующиеся свободные жирные кислоты служат не только "топливом", но и важнейшим регулятором разобщения дыхания и фосфорилирования.
50. Образование активных форм кислорода (синглетный кислород, пероксид водорода, гидроксильный радикал, пероксинитрил). Место образования, схемы реакций, их физиологическая роль.
В ЦПЭ поглощается около 90% поступающего в клетки О2. Остальная часть О2 используется в других окислительно-восстановительных реакциях. Ферменты, участвующие в окислительно-восстановительных реакциях с использованием Кислорода, делятся на 2 группы: оксидазы и оксигеназы.
Оксидазы используют молекулярный кислород только в качестве акцептора электронов, восстанавливая его до Н2О или Н2О2.
Оксигеназы включают один (монооксигеназы) или два (диоксигеназы) атома кислорода в образующийся продукт реакции.
Хотя эти реакции не сопровождаются синтезом АТФ, они необходимы для многих специфических реакций в обмене аминокислот, синтезе жѐлчных кислот и стероидов, в реакциях обезвреживания чужеродных веществ в печени .
Вбольшинстве реакций с участием молекулярного кислорода его восстановление происходит поэтапно с переносом одного электрона на каждом этапе. При одноэлектронном переносе происходит образование промежуточных высокореактивных форм кислорода.
Вневозбуждѐнном состоянии кислород нетоксичен. Образование токсических форм кислорода связано
сособенностями его молекулярной структуры. О2 содержит 2 неспаренных электрона с параллельными спинами, которые не могут образовывать термодинамически стабильную пару и располагаются на разных орбиталях. Каждая из этих орбиталей может принять ещѐ один электрон.
Полное восстановление О2 происходит в результате 4 одноэлектронных переходов:

Супероксид, пероксид и гидроксильный радикал - активные окислители, что представляет серьѐзную опасность для многих структурных компонентов клетки .
Рис. 6-31. Образование супероксида в ЦПЭ. "Утечка" электронов в ЦПЭ может происходить при переносе электронов с участием коэнзима Q. При восстановлении убихинон превращается в анион-радикал семихинона. Этот радикал нефермента-тивно взаимодействует с О2 с образованием супероксидного радикала. Комплекс II на рисунке не указан.
Большая часть активных форм кислорода образуется при переносе электронов в ЦПЭ, прежде всего, при функционировании QH2-дегидрогеназного комплекса. Это происходит в результате неферментативного переноса ("утечки") электронов с QH2 на кислород .
Вотличие от рассмотренного механизма на этапе переноса электронов при участии цитохромоксидазы (комплекс IV) "утечка" электронов не происходит благодаря наличию в ферменте специальных активных
центров, содержащих Fe и Сu и восстанавливающих О2 без освобождения промежуточных свободных радикалов.
Вфагоцитирующих лейкоцитах (гранулоцитах, макрофагах и эозинофилах) в процессе фагоцитоза усиливаются поглощение кислорода и образование активных радикалов. Активные формы кислорода образуются в результате активации NADPH-оксидазы, преимущественно локализованной на наружной стороне плазматической мембраны, инициируя так называемый "респираторный взрыв" с образованием активных форм кислорода.
Физиологическая роль АФК
1. Активные формы кислорода принимают участие в клеточной системе иммунитета, обеспечивая функцию всех фагоцитов в борьбе с инфекцией
2.Регуляция синтеза простагландинов, тромбоксанов и лейкотриенов.
3.Окислительное разрушение ксенобиотиков (чужеродных для организма экзогенных веществ), деструкция собственных поврежденных или аномальных клеток.
4.Регуляция роста, пролиферации и дифференцировки клеток.
5.Участие в обновлении и модификации клеточных мембран.
6.Регуляция апоптоза.
51. . Механизм повреждающего действия активных форм кислорода на клетки (ПОЛ, окисление белков и нуклеиновых кислот). Примеры реакций.
Реакции перекисного окисления липидов (ПОЛ) являются свободнорадикальными и постоянно происходят в организме. Свободнорадикальное окисление нарушает структуру многих молекул. В белках окисляются некоторые аминокислоты. В результате разрушается структура белков, между ними образуются ковалентные "сшивки", всѐ это активирует протеолитические ферменты в клетке, гидролизующие повреждѐнные белки. Активные формы кислорода легко нарушают и структуру ДНК. Неспецифическое связывание Fe2+ молекулой ДНК облегчает образование гидроксильных радикалов, которые разрушают структуру азотистых оснований. Но наиболее подвержены действию активных форм кислорода жирные кислоты, содержащие двойные связи, расположенные через СН2-группу. Именно от этой СН2-группы свободный радикал (инициатор окисления) легко отнимает электрон, превращая липид, содержащий эту кислоту, в свободный радикал.
ПОЛ - цепные реакции, обеспечивающие расширенное воспроизводство свободных радикалов, частиц, имеющих неспаренный электрон, которые инициируют дальнейшее распространение перекисного окисления.

Стадии перекисного окисления липидов
1) Инициация: образование свободного радикала (L•)
Инициирует реакцию чаще всего гидроксильный радикал, отнимающий водород от СН2-групп полиеновой кислоты, что приводит к образованию липидного радикала.
2) Развитие цепи:
L • + О2 → LOO •
LOO• + LH → LOOM + LR•
Развитие цепи происходит при присоединении О2, в результате чего образуется липопероксирадикал LOO• или пероксид липида LOOH.
ПОЛ представляет собой свободнорадикальные цепные реакции, т.е. каждый образовавшийся радикал инициирует образование нескольких других.
3) Разрушение структуры липидов
Конечные продукты перекисного окисления полиеновых кислот - малоновый диальдегид и гидропероксид кислоты.
4) Обрыв цепи - взаимодействие радикалов между собой:
LOO• |
|
+ |
L• |
→ |
LOOH |
|
+ |
LH |
L• |
+ |
vit |
E |
→ |
LH |
+ |
vit |
E• |
vit E• + L• → LH + vit Еокисл. |
|
|
|
|
|
|
||
Развитие цепи может останавливаться при взаимодействии свободных радикалов между собой или при взаимодействии с различными антиоксидантами, например, витамином Е, который отдаѐт электроны, превращаясь при этом в стабильную окисленную форму.
52. Катаболизм основных пищевых веществ в клетке - углеводов, жиров, аминокислот. Понятие о специфических и общих путях катаболизма. Окислительное декарбоксилирование пировиноградной кислоты, характеристика процесса. Пируватдегидрогеназный комплекс. Регуляция.
Углеводы, жирные кислоты и большинство аминокислот окисляются в конечном счѐте через цикл лимонной кислоты до СО2 и Н2О. Прежде, чем эти вещества вовлекаются в заключительный этап катаболизма, их углеродный скелет превращается в двухуглеродный фрагмент в форме ацетил-КоА. Именно в этой форме большая часть "топливных" молекул включается в цикл лимонной кислоты.
Ацетил-КоА образуется в специфических реакциях катаболизма жирных кислот и некоторых аминокислот . Однако главным источником ацетил-КоА служит пировиноградная кислота, образующаяся в реакциях катаболизма глюкозы и некоторых аминокислот .
