
- •Міністерство освіти і науки, молоді та спорту україни
- •Видання подається в авторський редакції вступ
- •Лабораторна робота № 1 Визначення інтегральної теплоти розчинення солі
- •Теоретичні відомості
- •Завдання на виконання роботи
- •Опрацювання результатів
- •Лабораторна робота № 1.2
- •Визначення інтегральної теплоти розчинення
- •Невідомої солі
- •Порядок виконання роботи
- •Опрацювання результатів
- •Питання для самоперевірки
- •Лабораторна робота № 2 побудова та аналіз діаграм стану обмежено розчинних рідин
- •Теоретичні відомості
- •Завдання на виконання роботи
- •Прилади, лабораторний посуд та реактиви
- •Порядок виконання роботи
- •Опрацювання результатів
- •Питання для самоперевірки
- •Лабораторна робота № 3 кріометричне визначення молярної маси речовини
- •Теоретичні відомості
- •Кріоскопічні сталі деяких розчинників
- •Визначення температури замерзання чистого розчинника
- •Визначення температури замерзання розчину
- •Завдання на виконання роботи
- •Установки, прилади, лабораторний посуд, реактиви
- •Порядок виконання роботи
- •Опрацювання результатів
- •Питання для самоперевірки
- •Лабораторна робота №4 електропровідність розчинів електролітів
- •Теоретичні відомості
- •Електрична провідність розчинів слабких електролітів
- •Електрична провідність розчинів сильних електролітів
- •Методика виміру електричної провідності
- •Завдання на виконання роботи
- •Опрацювання результатів
- •Лабораторна робота № 4.2 визначення електропровідності розчинів сильних електролітів Порядок виконання роботи
- •Опрацювання результатів
- •Оцінка похибки вимірювань
- •Аналіз одержаних результатів, висновки
- •Питання для самоперевірки
- •Лабораторна робота № 5 електрорушійні сили
- •Теоретичні відомості
- •Завдання на виконання роботи
- •Прилади, лабораторний посуд та реактиви
- •Порядок виконання роботи
- •Питання для самоперевірки
- •Лабораторна робота №6 хімічна кінетика
- •Теоретичні відомості
- •Лабораторна робота № 6.1
- •Аналіз одержаних результатів, висновки
- •Лабораторна робота №6.2
- •Опрацювання результатів
- •Питання для самоперевірки
- •Лабораторна робота № 7 визначення поверхневого натягу розчинів та розрахунок адсорбції на межі поділу розчин – повітря
- •Теоретичні відомості
- •Завдання на виконання роботи
- •Прилади, лабораторний посуд та реактиви
- •Порядок виконання лабораторної роботи
- •Характеристики пар
- •Опрацювання результатів
- •Поверхневий натяг розчинів оцтової кислоти
- •Питання для самоперевірки
- •Лабораторна робота № 8 адсорбція на межі поділу тверде тіло – рідина. Обчислення питомої поверхні адсорбенту
- •Теоретичні відомості
- •Завдання на виконання роботи
- •Прилади, лабораторний посуд та реактиви
- •Порядок виконання роботи
- •Опрацювання результатів
- •Результати розрахунку адсорбції на межі поділу тверде тіло – рідина
- •Питання для самоперевірки
- •Лабораторна робота № 9 методи одержання колоїдних систем
- •Теоретичні відомості
- •Будова колоїдної частинки
- •Прилади, лабораторний посуд, реактиви
- •Порядок виконання роботи № 9.4
- •Опрацювання результатів
- •Швидкість електрофоретичного перенесення визначають за рівнянням:
- •Опрацювання результатів
- •Питання для самоперевірки
- •Лабораторна робота № 11 визначення порогу коагуляції золю гідроксиду заліза та перевірка правила шульце-гарді
- •Теоретичні відомості
- •Завдання на виконання роботи
- •Прилади, лабораторний посуд та реактиви
- •Порядок виконання роботи
- •Результати дослідження коагуляції золю гідроксиду заліза
- •Опрацювання результатів
- •Результати визначення порогу коагуляції та коагулюючої дії іонів різної валентності
- •Оцінка похибки вимірювань
- •Питання для самоперевірки
- •Лабораторна робота № 12 вивчення кінетики та визначення ступеня набухання желатини
- •Теоретичні відомості
- •Лабораторна робота № 12.1 вагове вИвчення кінетики набухання желатину у водно– спиртових сумішах
- •Завдання на виконання роботи
- •Прилади, лабораторний посуд, реактиви
- •Порядок виконання роботи
- •Опрацювання результатів
- •Результати дослідження кінетики набухання желатину ваговим методом
- •Лабораторна робота № 12.2 вплив рН на ступінь набухання желатини та визначення ізоелектричної точки методом набухання
- •Завдання на виконання роботи
- •Прилади, лабораторний посуд та реактиви
- •Порядок виконання роботи
- •Опрацювання результатів
- •Результати дослідження кінетики набухання желатину в розчинах з різним значенням рН ваговим методом
- •Залежність граничного набухання желатину від рН розчину
- •Порядок виконання роботи
- •Опрацювання результатів
- •Залежність граничного ступеня набухання желатину від рН розчину
- •Питання для самоперевірки
- •Лабораторна робота № 13 визначеня зв`язаної води індикаторним рефрактометричним методом
- •Теоретичні відомості
- •Завдання на виконання роботи
- •Прилади, лабораторний посуд та реактиви
- •Порядок виконання роботи
- •Опрацювання результатів
- •Оцінка похибки вимірювань
- •Питання для самоперевірки
- •Література
- •Фізична та колоїдна хімія методичні рекомендації до виконання лабораторних робіт
- •Видання подається в авторський редакції
Завдання на виконання роботи
Визначити сталу калориметра за азотнокислим калієм.
Визначити інтегральну теплоту розчинення невідомої солі.
Прилади, лабораторний посуд та реактиви
|
Р |
Калориметрична установка, терези, дистильована вода, сіль, термометр. Калориметр (рис. 1.1) складається з кожуха та склянки, яку розміщують в кожух. Для зменшення теплообміну з навколишнім середовищем калориметр закривають кришкою, у яку вставляють мішалку, термометр і пробірку з сіллю.
|
Лабораторна робота № 1.1
ВИЗНАЧЕННЯ сталої КАЛОРИМЕТРА
Порядок виконання роботи
В склянку заливають 200 г дистильованої води.
Розраховують кількість KNO3, що припадає на 200 г води, для одержання розчину концентрацією 0,2 0,3 Μ.
Для визначення маси наважки зважують порожню пробірку, а потім пробірку разом із сіллю з точністю до 0,01 г.
Збирають калориметричну установку як показано на рис.1.1.
Проводять вимірювання зміни температури у калориметричній системі, яка відбувається внаслідок розчинення солі. При безперервному перемішуванні розчину фіксують зміну температури з точністю до 0,1 °С через кожні 30 с і заносять у робочий зошит. Для визначення точної зміни температури під час досліду процес розчинення умовно поділяють на три періоди :
а) Попередній, який триває до 5 хв.
б) Головний – процес розчинення солі.
в) Заключний – до 5 хвилин.
|
Рис. 1.2. Графічне визначення температурного перепаду в калориметрі |
У попередньому періоді визначають інтенсивність теплообміну калориметра з навколишнім середовищем. Для цього при безперервному перемішуванні води вимірюють її температуру через кожні 30 с. Після встановлення сталої температури, тобто зміна температури через кожні 30 с буде майже однакова (через 5 хв вимірювань), у склянку з водою вносять сіль.
|
В головному періоді не припиняють перемішування розчину до повного розчинення солі, фіксуючи зміну температури кожні 30 с.
Заключний період прийнято вважати з моменту досягнення рівноваги розчинення солі, тобто з моменту припинення зниження температури (тривалість не менше 5 хв).
Зміну температури в системі, яка відбувається внаслідок розчинення солі визначають графічно. Для цього на міліметровому папері, будують графік, де на вісі абсцис відкладають час, а на вісі ординат – температуру. На рис. 1.2 показано одну з можливих діаграм, де FА – попередній період, AD – головний і DС – заключний. Для визначення зміни температури ΔΤ продовжують (пунктиром) лінію попереднього періоду вправо (ділянка АВ), а лінію заключного періоду вліво (ділянка ОD). Через середину головного періоду (точка К) проводять пряму, паралельну вісі ординат, до перетину з пунктирними лініями. Відстань ОВ дорівнює зміні температури Τ при розчиненні солі з урахуванням теплообміну між калориметром і навколишнім середовищем.
Після розчинення солі за зміною температури розчину в калориметрі визначають кількість теплоти, наданої системі (калориметричний тепловий ефект).

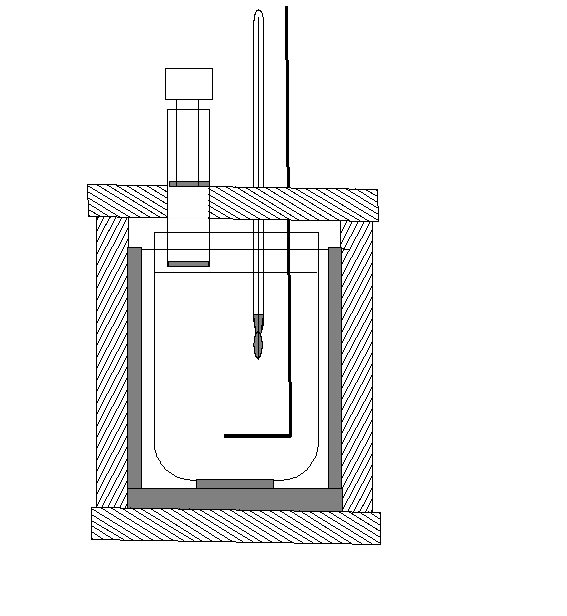 ис.
1.1. Калориметр
ис.
1.1. Калориметр