
61.05 ЗХТ
.pdfхвилин для завершення реакції. Через 20 хвилин вимірюють оптичну густину розчинів при = 550 нм по відношенню до розчину порівняння в кюветі товщиною 10 мм. Результати вимірювань заносять в таблицю:
Таблиця 8.1. Дані для градуювального графіка
№ |
Об’єм стандартного |
Концентрація фенолу, С |
Оптична |
проби |
розчину, V1 мл |
мг/мл |
густина, А |
|
|
|
|
|
|
|
|
Концентрацію фенолу у вимірюваному розчині розраховують за рівнянням:
С=(0,02*V1)/V2 мг/мл, |
(8.1) |
де V1 - об'єм аліквоти стандартного розчину, мл. V2 - об'єм мірної колби,
мл.
За результатами вимірювань будують градуювальний графік в координатах А – С.
Визначення концентрації фенолу в досліджуваному розчині
У мірну колбу на 50 мл вносять 10 мл розчину пара-нітроаніліну і додають при перемішуванні 1 - 3 краплі насиченого розчину NaNO2 до знебарвлення. У стаканчик ємністю 50 мл поміщають 5 мл аналізованого розчину (піпеткою), доливають 15 мл 1 н розчину Na2CO3 і перемішують. Розчин із стаканчика кількісно переносять у мірну колбу, стаканчик обполіскують водою і зливають туди ж, додають в мірну колбу води до мітки, закривають, перемішують і залишають на 20 хвилин.
Паралельно готують другу таку ж пробу. Через 20 хвилин оптичну густину обох розчинів вимірюють при 550 нм в кюветах l = 10 мм по відношенню до холостого розчину. Потім за градуювальним графіком знаходять значення концентрації фенолу в обох пробах С1 і С2 і визначають середню концентрацію.
Якщо величина оптичної густини виходить за межі калібрувального графіка, визначення повторюють з попередніми розведенням. Для цього 10 мл аналізованої води поміщають в мірну колбу на 200 мл і доливають дистильованою водою до мітки. Перемішують, в стакан на 50 мл відбирають 5 мл розведеного розчину і визначення повторюють, як описано вище.
5. Контрольні питання
1.Який граничний допустимий вміст фенолу у воді.
2.Який хімізм кількісного визначення фенолу у воді.
3.Якісні реакції на вміст фенолу у воді.
4.Функціональна схема отримання фенолу в промисловості.
41

Лабораторна робота № 9
ЕМУЛЬСІЙНА ПОЛІМЕРИЗАЦІЯ СТИРОЛУ
1. Мета роботи
Провести полімеризацію стиролу емульсивним способом, побудувати залежність виходу полістиролу від часу, визначити молекулярну масу полімеру віскозиметричним методом.
2. Теоретична частина
Полімеризація - процес утворення високомолекулярних сполук в результаті з'єднання великої кількості молекул мономеру в одну макромолекулу. При цьому молекули мономера і полімеру мають один і той же елементарний склад. У загальному випадку реакцію полімеризації можна представити таким чином:
-CH2-CH- n(CH2=CHX)

X
n ,
де X - замісник. При цьому не виділяються які-небудь побічні продукти. У реакцію полімеризації можуть вступати сполуки, що містять подвійні або потрійні зв'язки, а також карбо-і гетероцикли.
Більшість процесів полімеризації має ланцюговий характер і протікає через стадії ініціювання, росту і обриву ланцюга. Ініціювання ланцюга відбувається шляхом приєднання активного центру до молекули мономера, в результаті чого відбувається гемолітичний або гетеролітичний розрив його реакційно здатних зв'язків. Знову утворений активний центр являє собою активний радикал або іон:
+ |
|
+ |
|
|
|
* |
||||||
R + CH2=CH |
|
R-CH2- |
CHR*;+ CH2=CH |
|
|
|
R-CH2- |
CH ; |
||||
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|||
X |
|
X |
X |
|
|
X |
||||||
|
|
|
|
|
- |
|
|
- |
||||
|
|
|
|
|
R + CH2=CH |
|
|
R-CH2- |
CH . |
|||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
X |
||||
Залежно від типу активних центрів, що ініціюють ланцюгової процес, розрізняють радикальну і іонну полімеризацію. Зростання ланцюга являє собою багаторазове повторення актів приєднання молекул мономеру до активного центру на кінці ланцюга, в результаті чого утворюється активний полімер.
Обрив ланцюга відбувається зазвичай або в результаті взаємодії двох зростаючих ланцюгів (рекомбінація), або в результаті взаємодії зростаючої макромолекули з молекулами домішок або розчинника (передача ланцюга).
42

2.1. Радикальна полімеризація При радикальної полімеризації активним центром є вільний радикал. Залежно
від способу утворення радикалів (ініціювання) можна виділити термічну полімеризацію, фотохімічну, радіаційну (під дією гамма-променів, рентгенівських променів, прискорених електронів), а також хімічно ініційовану полімеризацію, що протікає в присутності хімічних ініціаторів - сполук, що легко розпадаються в умовах реакції з утворенням вільних радикалів. Хімічно ініційована полімеризація є одним з найбільш поширених методів радикальної полімеризації. В якості ініціаторів застосовуються пероксиди, гідропероксиди, азо- і діазосполуки, окислювально-відновні системи та ін Наприклад, розпад пероксиду бензоїлу протікає з утворенням двох радикалів:
(С6 H5COO)2−2С6 H5COO→С6 H5COO+ С6 H5+CO2 .
Динітрил азобісізомасляной кислоти розпадається з виділенням азоту, а також утворює два радикала:
Cl |
CH3 |
CH |
||||
|
|
|
|
|
3 |
|
NC-C-N=N-C-CN |
2 NC- |
|
C* + N2 |
|||
|
|
|
|
|
CH3 . |
|
Cl |
CH3 |
|
|
|||
Енергія активації розпаду більшості ініціаторів становить понад 120 КДж/моль. При полімеризації часто використовують окислювально-відновне ініціювання. Особливістю такого ініціювання є низька енергія активації, що дозволять проводити процес при низьких температурах. Прикладом такого ініціювання може служити взаємодія пероксиду водню з солями двовалентного заліза, в результаті чого утворюються вільні радикали:
H2O+Fe2+→HO +HO +Fe3+ .
Енергія активації в окисно-відновних системах складає в середньому близько 40 КДж/моль.
Реакція полімеризації починається зі стадії приєднання вільних радикалів до молекул мономера, що призводить до виникнення реакційної ланцюга:
|
|
* |
||
R* + CH2=CH |
|
R-CH2- |
CH |
|
|
||||
|
|
|
X . |
|
X |
|
|||
Отримана сполука так само є вільним радикалом і далі вступає в реакцію з великим числом молекул мономера, тобто відбувається зростання ланцюга:
43

* |
|
|
|
|
|
|
|
* |
|||
RCH2- |
CH+nCH2=CH |
|
R- |
-CH2-CH |
-CH2- |
CH |
|||||
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
X |
X |
|
|
|
X |
|
n X . |
||||
Таким чином, стадія росту ланцюга складається з послідовного ряду актів взаємодії вільного радикала з молекулами мономеру. Швидкість радикальної полімеризації визначається рівнянням:
V = kp |
|
k I |
|
M , |
(9.1) |
|
|||||
|
|
ko |
|
||
де kр - константа швидкості росту; k - константа швидкості ініціювання; ko - константа швидкості обриву ланцюга; [I]-концентрація ініціатора; [М] - концентрація мономеру.
Припинення росту ланцюга або обрив ланцюга, як правило, є результатом взаємодії двох радикалів і відбувається шляхом або рекомбінації макрорадикалів, або диспропорціонування. При рекомбінації макрорадикалів утворюється одна полімерна молекула, не здатна брати участь у подальшому зростанні:
* |
* |
|
|
|
|
|
|
||
RCH2-CH + HC-CH2R |
|
RCH2-CH-C=CHR |
|||||||
|
|||||||||
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|||||
X |
X |
|
X X |
||||||
При диспропорціонуванні |
|
число |
|
макромолекул не змінюється. |
|||||
Обрив ланцюга також може відбуватися в результаті реакції передачі ланцюга. Передача ланцюга здійснюється при взаємодії зростаючих макрорадикалів з молекулами мономеру, полімеру, а також з домішками або розчинниками:
* |
|
|
* |
|
|||
RCH2-CH + RH |
|
RCH2-CH2 + R |
. |
||||
|
|||||||
|
|
|
|
|
|
|
|
X |
X |
|
X |
||||
Утворений активний радикал R, реагуючи з молекулами мономеру, дає початок нового ланцюга:
* |
* |
|
R + CH2=CH |
|
RCH2-CH |
|
||
XX .
Уразі утворення неактивного радикала, не здатного продовжити реакційний ланцюг, відбувається припинення полімеризації.
2.2.Іонна полімеризація
Активними центрами іонної полімеризації є іони, що утворюють у неполярних розчинниках іонні пари. У полярних розчинниках виникають сольватно-розділені іонні пари і вільні іони.
44

Залежно від природи каталізаторів і заряду утворених іонів розрізняють катіонну і аніонну полімеризацію.
2.2.1. Катіонна полімеризація Катіонна полімеризація протікає під дією кислот і каталізаторів Фіделя-Крафтса
(АlCl3, ВF3, SnCl4, FеСl3 і т.п.), тобто електронакцепторних речовин. У присутності води, кислот, ефірів та інших речовин, що відіграють роль співкаталізатора, утворюється активний каталітичний комплекс, який ініціює реакцію:
BF3+HOH →(BF3OH )− H+ .
При взаємодії цього комплексу з молекулою мономеру утворюється активний карбенієвий центр:
+ |
- |
+ |
- |
|||
CH2=CH + H (BF3OH) |
|
H3C- |
CH(BF3OH) |
|||
|
||||||
|
|
|
|
|
|
. |
|
|
X |
||||
X |
|
|
||||
Реакція зростання полягає в приєднанні молекул мономера до активного карбенієвого центру з регенерацією цього активного центру на кінці ланцюга:
+ |
- |
|
|
|
|
|
|
|
|
|
+ |
- |
|||
|
|
|
|
|
|
|
|
||||||||
H3C- |
CH(BF3OH) + nCH2=CH |
|
|
H- |
-CH2-CH- |
-CH2-CH(BF3OH) |
|||||||||
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
X |
X |
|
|
|
|
|
|
X |
|
n X |
. |
||||
Швидкість росту описується рівнянням |
|
|
|
|
|
|
|||||||||
|
|
|
r = |
kр kин |
C M 2 , |
|
|
|
|
|
(9.2) |
||||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
kо |
|
|
|
|
|
|
||||
де [С] - концентрація каталізатора.
Катіонна полімеризація протікає, як правило, з дуже високою швидкістю, що дозволяє проводити процес при низьких температурах. Наприклад, полімеризацію ізобутілену проводять при t = -100 °С в середовищі рідкого етилену. Обрив ланцюга відбувається як молекулярна реакція з відщепленням протона від сусіднього з карбенієвим іоном атома вуглецю і дисоціації каталітичного комплексу:
|
|
|
|
|
+ |
- |
-H2O |
H- |
|
|
|
|
|
|
|
|
|
|
|
-CH -CH- |
-CH=CH |
||||||||
|
|
|
|
|
||||||||||
H- |
-CH -CH- |
-CH -CH(BF OH) |
|
|
2 |
|
|
|
2 |
|||||
|
2 |
|
|
2 |
3 |
-BF3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
X |
|
n |
|
||
|
|
X |
|
n |
|
|
|
|
. |
|||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
||||||||
45

2.2.2. Аніонна полімеризація
Аніонна полімеризація протікає в присутності лужних металів, металоорганічних сполук, аміду натрію, алкоголятів лужних металів та інших електронодонорних сполук. Найбільше практичне значення має полімеризація, що протікає під дією лужних металів або їх алкинів.
Полімеризація акрилонітрилу під дією аміду калію в рідкому аміаку викликається вільними іонами, внаслідок дисоціації аміду:
KNH2↔K++NH−2
Утворення карбоаніона відбувається при взаємодії амідного іона з молекулою мономеру:
- |
|
|
|
|
H |
|
|
|
H N-CH -C - |
||
NH +CH =CH |
|
||||
|
|||||
2 |
2 |
|
2 |
2 |
|
|
|||||
|
|
|
|
|
CN. |
|
CN |
|
|
||
Зростання ланцюга відбувається в результаті взаємодії утвореного карбаніони з молекулою мономеру з утворенням нового аніону. Обрив ланцюга відбувається шляхом взаємодії карбаніона з молекулою аміаку з регенерацією амідного іона, тобто протікає реакція передачі ланцюга.
2.2.3. Іонно-координаційна полімеризація Іонно-координаційна полімеризація викликається комплексними
каталізаторами Циглера-Натта. Найчастіше в якості каталізаторів використовують металоорганічні сполуки алюмінію і хлориди титану.
Активні центри при іонно-координаційної полімеризації являють собою металоорганічні сполуки перехідного металу. Вони виникають у присутності співкаталізатора або при взаємодії вихідних мономерів з металгідридними центрами на поверхні каталізатора.
Утворення активного металографічного з'єднання відбувається наступним чином:
TiCl3 +Al(C2 H5)3→Cl3Ti−C2 H5+Al(C2 H5)Cl .
Зростання полімерного ланцюга здійснюється шляхом впровадження молекули мономера по зв'язку в перехідний зв'язок метал-вуглець:
Cl Ti-C H +CH =CH |
|
Cl Ti-C H |
|
nCH2=CHX |
|
Cl Ti- |
|
|
|
|
||||||||||
|
|
-CH -CH- |
-C H |
|||||||||||||||||
|
|
|
|
|||||||||||||||||
3 |
2 |
5 |
2 |
|
|
2 |
|
2 |
5 |
|
|
3 |
2 |
|
|
2 |
5 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 -CH |
|
|
|
|
|
|
X |
|
n |
. |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
|
|
||
Стадії введення молекули мономера передує її координація на металі з утворенням нестійкого π - компонента. Тому комплексні каталізатори отримали
46

назву іонно-координаційних. Обрив ланцюга відбувається в результаті міграції атома водню від атома вуглецю до металу з утворенням гідриду перехідного металу і полімерної молекули.
Використання для полімеризації комплексних металоорганічних каталізаторів призводить до утворення стереорегулярних полімерів. Ці каталізатори мають високу стереоспеціфічность.
2.3.Способи проведення полімеризації
Упромисловості полімеризація здійснюється наступними основними способами: в газовій фазі, блоці (масі), розчині, емульсії і суспензії.
2.3.1. Газова полімеризація ГазофазнІй полімеризації підлягають газоподібні мономери (етилен,
пропілен). Процес ініціюється киснем, який додається в мономер в невеликих кількостях (0,002 ÷ 0,008% об.) і проводиться під великим тиском. При взаємодії етилену з киснем утворюються пероксидні або гідропероксіидні сполуки етилену:
CH2=CH2 + O2 |
|
H2C-CH2 |
CH2=CH |
|
. |
||||
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
O O або |
|
OOH |
|||||
Нестійкий пероксидний зв’язок- О - О під дією температури розривається з утворенням ди- і монорадикалів: ОСН2-СН2О· и СН2=СНО·. Вільні радикали ініціюють полімеризацію етилену.
2.3.2. Блокова полімеризація
Блокову полімеризацію або полімеризацію в масі проводять у конденсованої фазі у відсутності розчинника. У результаті полімеризації утворюється концентрований розчин (або розплав) полімеру в мономері або монолітна тверда маса (блок).
Зазвичай блокову полімеризацію проводять у присутності ініціаторів або при термічному ініціюванні. У міру збільшення ступеня полімеризації мономера збільшується молекулярна маса середовища і її в'язкість, що утрудняє відведення тепла із зони реакції. У результаті цього можуть виникати місцеві перегріви реакційної маси, внаслідок чого полімер виходить неоднорідним за молекулярною масою. Тому блокову полімеризацію проводять з малою швидкістю.
2.3.3. Полімеризація в розчині
Можливі два способи проведення полімеризації в розчині. За першим способом застосовується розчинник, який розчиняє і мономер, і полімер. Одержуваний розчин полімеру (лак) використовують як такий або полімер
47
виділяють. За другим способом застосовують розчинник, який розчиняє мономер, але не розчиняє полімер. Утворений полімер випадає в осад.
При полімеризації в розчині значно поліпшується відвід тепла, яке виділяється в ході реакції, але в результаті протікання реакцій передачі ланцюга через розчинник одержувані полімери мають більш низьку молекулярну масу.
2.3.4. Полімеризація в емульсії
При емульсійній полімеризації в якості дисперсійного середовища зазвичай використовують воду. Для стабілізації емульсії застосовують різні емульгатори (олеат, пальмітат, і інші солі жирних кислот). Емульсійну полімеризацію проводять
уприсутності водорозчинних ініціаторів (персульфат калію, пірофосфати,
бікарбонати). Для зменшення розгалуженості ланцюга додають меркаптани. Для створення тонкої емульсії реакційну суміш енергійно перемішують, в результаті чого мономер розбивається на дрібні краплі, вкриті шаром емульгатора.
Полімеризація протікає в адсорбційних шарах емульгатора на поверхні полімерно-мономерних частинок. Зростаюча макромолекула є центром, навколо якого утворюється частинка латексу. Отриманий латекс коагулюють, вводячи в
систему розчин електроліту, а осад полімеру відокремлюють. В результаті емульсійної полімеризації виходить полімер з великою молекулярною масою і низьким ступенем полідисперсності.
Можливість застосування емульсійного способу в ряді випадків обмежує утворення великої кількості стічних вод, що вимагають очищення від токсичних мономерів, а також трудомісткість стадії сушіння тонкодисперсного полімеру. Крім того, недоліком способу є забруднення полімеру залишками емульгатора та інших добавок, що погіршує його електричні властивості.
2.3.5. Полімеризація в суспензії Полімеризація в суспензії проводиться також у воді. Для підвищення стійкості
утвореної більш грубою емульсії використовують слабкі емульгатори - полівініловий спирт, водорозчинні ефіри целюлози, желатин, глину, оксид алюмінію і т. п. Застосовувані ініціатори розчиняються у мономері.
Полімеризація відбувається в краплях, що представляють, по суті, невеликі блоки, тому таку полімеризацію іноді називають крапельної (гранульною) полімеризацією.
На відміну від емульсійної полімеризації в даному випадку відпадає необхідність у проведенні коагуляції, тому що утворені гранули полімеру вільно виділяються з водної фази.
3.Завдання на виконання роботи
1.Провести полімеризацію стиролу емульсивним способом,
2.Побудувати залежність виходу полістиролу від часу.
48

3.1. Властивості вихідної сировини і продукту
Початковою сировиною для отримання полістиролу є стирол. Стирол - безбарвна рідина при нормальних умовах з характерним запахом. Температура кипіння стиролу 145,2 ° С, густина 906 кг/м3. У промисловості стирол отримують дегідруванням етилбензолу у присутності каталізаторів:
CH2-CH3 |
|
|
|
CH=CH2 |
|
|
|
||
|
+ H2 .
Полістирол являє собою твердий продукт, що має густину 1050 - 1080 кг/м3. Молекулярна маса промислових марок залежить від способу виробництва і коливається в межах від 50000 до 300000. Виняток становить емульсійний полістирол, молекулярна маса якого може бути значно вища. Полістирол є гарним діелектриком. Його діелектричні властивості не залежать від вологості навколишнього середовища і практично не змінюються при температурах від - 80 до 90 ° С.
Полістирол має високу кислото - і лугостійкість, він стійкий до дії неорганічних кислот, а також до спиртів і солей. Однак полістирол розчиняється в тетрахлориді вуглецю, бензолі, нестійкий до дії простих і складних етерів, ароматичних, аліфатичних і хлорованих вуглеводнів. Він легко окислюється, нітрується, галогенується, сульфується.
Недоліками полістиролу є низькі теплостійкість і ударна міцність, схильність до старіння.
4. Експериментальна частина
Хімічні реактиви, посуд, обладнання
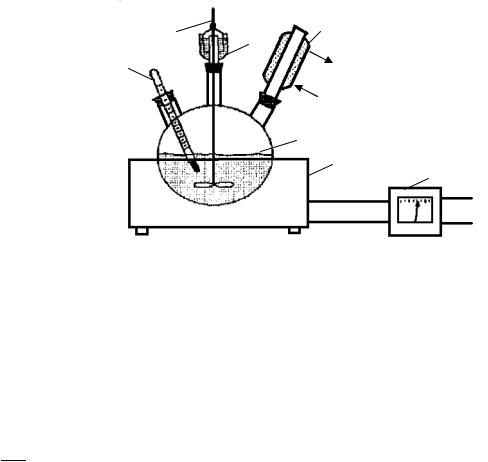
Полімеризація стиролу емульсивним способом проводиться на лабораторній установці, схема якої наведена на малюнку 9.1.
Полімеризація стиролу проводиться за рецептом, наведеним нижче (у
вагових частинах). |
|
|
Стирол |
50 |
г. |
Вода дистильована |
90 |
мл |
Персульфат аммонію |
0,35 г |
|
Стеарат калію |
2,3 г |
|
Порядок виконання роботи
У реакційній колбі готують розчин емульгатора у воді при 70 °С. По краплях при хорошому перемішуванні додають стирол і через 10-15 хвилин вводять
49
ініціатор, розчинений у 10 мл води. Через 30, 60 і 90 хвилин після введення ініціатора піпеткою відбирають проби реакційної маси точно по 10 мл. Емульсію в пробах руйнують додаванням 10 - 15 мл розчину NаСl і 2 краплями 1N азотної кислоти.
Осад полімеру, що утворюється при руйнуванні емульсії, відфільтровують на попередньо зваженому фільтрі і промивають водою. Полімер сушать на повітрі до постійної маси.
5 |
3 |
|
4 |
6
H2O
2
1
7
~ 222 В
Рис. 9.1 - Схема лабораторної установки: 1 - колбонагрівач; 2 — трьохгорла колба; 3 — зворотній холодильник; 4 - гідрозатвор; 5 - мішалка; 6 - термометр;
7 - ЛАТР
Вихід полімеру в кожній пробі визначають за формулою
GП |
|
|
В=GМ |
100% , |
(9.3) |
де Gп - маса полимеру в пробе;
Gм - маса мономеру в пробі перед початком досліду.
За отриманими даними будують залежність виходу полімеру від часу.
|
6. Контрольні питання |
|
|
1 |
Полімеризація; види полімеризації; особливості радикальної полімеризації. |
||
2 |
Способи ініціювання радикальної полімеризації; ініціатори, які використовуються |
||
у виробництві полімерів. |
|
|
|
3 |
Способи проведення полімеризації; особливості блокової полімеризації. |
||
4 |
Полімеризація в розчині, емульсії і суспензії. Їх |
переваги |
і недоліки. |
5 |
Основні характеристики полімерів. Властивості і |
область |
застосування |
полістиролу.
50
