
61.05 ЗХТ
.pdfМІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ ХАРЧОВИХ ТЕХНОЛОГІЙ
ЗАТВЕРДЖУЮ
Ректор _______________С.В. Іванов
(підпис)
«____»____________________ 2013 р.
ЗАГАЛЬНА ХІМІЧНА ТЕХНОЛОГІЯ
ЛАБОРАТОРНИЙ ПРАКТИКУМ
для студентів напряму 6.051301 "Хімічна технологія"
денної форми навчання
Всі цитати, цифровий та фактичний |
СХВАЛЕНО |
Матеріал, бібліографічні відомості |
на засіданні кафедри |
перевірені. Написання одиниць |
фізичної і колоїдної хімії |
відповідає стандартам. |
Протокол № 16 |
Підписи авторів _______________ |
від 22.04.2013 р. |
27 червня 2013 р. |
|
Реєстраційний номер електронного
лабораторного практикуму в НМВ 61.05 - 01.07.2013
КИЇВ НУХТ 2013
Загальна хімічна технологія: Лабораторний практикум для студ. напряму 6.051301 "Хімічна технологія" ден. форми навч. / Уклад.: О.Г. Макаренко – К.: НУХТ, 2013. – 53 с.
Рецензент О.М. Мірошников, канд. хім. наук, проф.
Укладач: О.Г. Макаренко, канд. хім. наук
Відповідальна за випуск канд. тех. наук, доц. О.В. Подобій
ВСТУП
Хімічна промисловість є однією з основних галузей народного
господарства. |
Асортимент |
продукції, |
що |
виробляється |
|
хімічною |
|||||||
промисловістю, надзвичайно широкий і різноманітний: вона випускає |
близько |
||||||||||||
50 тис. найменувань хімічних товарів, найважливішими з яких |
є |
добрива, |
|||||||||||
отрутохімікати, кислоти і луги, лаки і фарби, |
цемент, скло, керамічні вироби, |
||||||||||||
синтетичні волокна, пластичні маси, |
синтетичний каучук та інші продукти. |
||||||||||||
Величезне значення для |
народного господарства має хімічна переробка нафти, |
||||||||||||
природного |
газу, |
вугілля, деревини |
та інших |
видів |
вуглецевої |
сировини. |
|||||||
Швидке |
зростання виробництва хімічної промисловості та її проникнення в |
||||||||||||
усі сфери народного господарства відіграли важливу роль |
у |
вирішенні |
|||||||||||
найважливіших |
|
соціально-економічних |
завдань: |
|
інтенсифікації |
||||||||
сільськогосподарського виробництва, прискоренні |
науково-технічного прогресу |
||||||||||||
важкої |
промисловості, |
розвитку |
індустріальних |
методів |
будівництва, |
||||||||
розширенні |
сировинної |
бази |
легкої |
промисловості і виробництва товарів |
|||||||||
народного споживання. |
|
|
|
|
|
|
|
|
|
||||
Дисципліна |
“Загальна |
хімічна |
технологія” |
включає |
теоретичний |
||||||||
(лекційний) курс, практичні завдання та лабораторний практикум. |
|
|
|||||||||||
Метою курсу є ознайомлення студентів із загальними принципами та |
|||||||||||||
особливостями |
використання |
закономірностей |
протікання |
хімічних та |
|||||||||
фізико-хімічних процесів для вирішення завдань хімічної технології в плані організації масового промислового виробництва.
Методичною основою вивчення і викладення дисциплін є всебічний і, в тому числі, критичний розгляд і аналіз існуючих і перспективних вітчизняних і зарубіжних технологічних систем базових виробництв, їх апаратурного оформлення з чітким виділенням завдань і обов'язків, що покладаються на фахівців з освітньо-кваліфікаційним рівнем бакалавра з хімічної технології або виникають при їх професійній діяльності.
Основними завданнями дисципліни «Загальна хімічна технологія» є засвоєння студентами загальних закономірностей хімічної технології та найбільш типових хіміко-технологічних процесів і реакторів, принципів створення і функціонування хіміко-технологічних систем та підготовка студентів до вивчення спеціальних технологічних дисциплін, які лежать в основі технологій виробництва харчових добавок та косметичних засобів.
Лабораторний практикум призначений для розвитку вмінь та навик студентів в практичній щоденній роботі від вихідного контролю якості сировини, яка використовується в хіміко-технологічному процесі, до інженерно-дослідницької роботи та контролю кінцевих продуктів і екологічного контролю на хімічному підприємстві.
Різноманітність наведених в практикумі робіт узгоджується з програмою курсу дисципліни “Загальна хімічна технологія” та значно розширює можливості підготовки кваліфікованих спеціалістів.
3
Лабораторна робота №1
ВИЗНАЧЕННЯ ПОКАЗНИКІВ ЯКОСТІ ВОДИ
1. Мета роботи
Визначення показників якості води: загальної кислотності і загальної лужності, загальної твердості.
2. Теоретична частина
Вода в промисловості використовується в якості універсального розчинника і теплоносія, є сировиною для виробництва багатьох хімічних продуктів (кисень, водень, сірчана та азотна кислоти, луги та ін.), а також використовується і для побутових потреб. В світі щорічно безповоротно витрачається в рік близько 170 км3 води. Вимоги до якості промислових вод встановлюються у відповідності до мети їх використання. Відповідно вимагається жорсткий контроль за якістю вхідної води а також, в багатьох випадках і контроль води на виході із технологічного процесу. В даній лабораторній роботі визначаються деякі показники якості промислової води.
Кислотність промислових вод обумовлена наявністю вугільної кислоти та солей, які утворені взаємодією слабкої основи та сильної кислоти. Такі солі в процесі гідролізу утворюють кислоту. Кислотність визначають методом нейтралізації, основаній на взаємодії кислоти з лугом (реакція нейтралізації).
При визначенні кислотності в якості робочого розчину використовують гідроксид натрію і титрують проби в присутності фенолфталеїну.
Загальна лужність води обумовлена наявністю вільних гідроксидів, а також солей сильної основи та слабкої кислоти. Такі солі під час гідролізу збільшують концентрацію гідроксид-іонів. Лужність також визначають методом нейтралізації.
Твердість води – це один із найбільш важливих показників якості води, які контролюють в промислових водах. Твердість води – це міра вмісту у воді розчинених солей Ca і Mg, яка чисельно рівна кількості міліеквівалентів Ca і Mg в 1 л води (мекв/л).
Розрізняють три типи твердості: тимчасову, постійну і загальну. Тимчасова (карбонатна) твердість води обумовлена наявністю у воді гідрогенкарбонатів кальцію і магнію Ca(HCO3)2 і Mg(HCO3)2, які при кип’ятінні переходять в нерозчинні солі і випадають у вигляді осаду (накип):
Ca(HCO3)2 → CaCO3↓ + H2O + CO2↑
2Mg(HCO3)2 → MgCO3∙Mg(OH)2↓ + H2O + 3CO2↑
Постійна (не карбонатна) твердість води обумовлена наявністю у воді сульфатів, хлоридів, нітратів кальцію і магнію, які залишаються при кип’ятінні в розчиненому стані. Сума постійної і тимчасової твердості називається загальною твердістю.
4
По кількості присутніх солей воду поділяють на дуже м’яку, м’яку, помірно тверду, тверду і дуже тверду.
Таблиця 1.1. Показники якості води.
Дуже м’яка |
До 1,5 |
|
|
М’яка |
1,5-3 мекв/л |
|
|
Помірно тверда |
3-6 мекв /л |
|
|
Тверда |
6-9 мекв /л |
|
|
Дуже тверда |
Понад 9 мекв /л |
|
|
Для визначення загальної твердості води використовують комплексометричний метод аналізу, який базується на утворенні комплексних сполук іонів кальцію і магнію з комлексонами, зокрема комплексоном Б (трилоном Б).
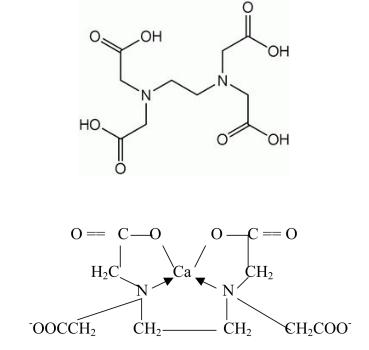
Трилон Б – це динатрієва сіль етилендиамінтетраоцтової кислоти (скорочено можна записати Nа2Н2Y, де Y - етилендиамінтетраацетат). Дана назва була введена фірмою BASF як торгова назва вказаної речовини, але дуже швидко ввійшла в ужиток та стала використовуватись іншими фірмами для її назви.
Рис. 1.1. Формула етилендиамінтетраоцтової кислоти
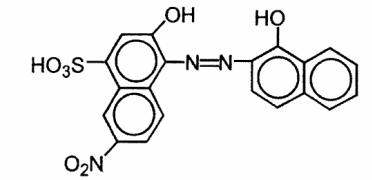
Рис 1.2. Формула комплексної сполуки трилона Б з кальцієм.
Визначенню загальної твердості заважають мідь, цинк, марганець та високий вміст солей карбонатів та гідрогенкарбонатів. Вплив цих речовин знімається під час проведення аналізу. Точність визначення під час титрування 100,0 мл проби складає ±0,005 мекв/л.
5

3.Завдання на виконання роботи
1.Визначити загальну кислотність води.
2.Визначити загальну лужність води
3.Визначити загальну твердість води
4.Визначити стандартне відхилення результатів вимірювань та зробити висновок про якість зразка досліджуваної води.
4.Експериментальна частина
Хімічні реактиви, посуд, обладнання
0,1 Н розчин NaOH
Фенолфталеїн (1 % розчин в 60 % водно-спиртовому розчині)
0,1 Н розчин HCl
Метиловий-оранжевий (0,05% розчин)
0,05 Н розчин трилону Б
Аміачний буферний розчин (рН 9,0 – 10,0 NH4Cl/NH4OH)
Хромоген чорний (0,5 % розчин в буферно-спиртовій суміші).
Порядок виконання роботи
Визначення загальної кислотності води
У конічну колбу об’ємом 250 мл відміряють піпеткою 100,0 мл досліджуваної води, додають 2-3 краплі фенолфталеїну. Пробу титрують розчином 0,1Н NaOH до появи слабо-рожевого забарвлення, яке не зникає протягом 1-2 хвилин. Титрування проводять тричі. Результати оформляють в таблицю:
Таблиця 1.2. Результати визначення загальної кислотності води.
№ |
Об’єм води для |
Об’єм 0,1Н NaOH, |
Кислотність |
Середнє значення |
|
титрування, мл |
мл |
|
|
|
|
|
|
|
Визначення загальної лужності води
У конічну колбу об’ємом 250 мл відміряють піпеткою 100,0 мл досліджуваної води. Додають 2-3 краплі метилоранжа і титрують розчином 0,1Н HCl до переходу жовтого забарвлення в помаранчеве. Результати оформляють в таблицю:
Таблиця 1.3. Результати визначення загальної лужності води
№ Об’єм води для Об’єм 0,1Н HCl, мл Лужність Середнє значення титрування, мл
Визначення загальної твердості води
У конічну колбу наливають 50,0 мл випробуваної води або менший об’єм, розводять до 100 мл дистильованою водою. При цьому сумарний вміст іонів кальцію та магнію у взятому об'ємі води не повинен перевищувати 0,5 ммоль. Потім додають 5 мл буферного розчину, 5-7 крапель індикатора хромогена
6
чорного і відразу ж титрують при сильному збовтуванні 0,05 н. розчином трилону Б до зміни забарвлення в еквівалентній точці (забарвлення повинно бути синім із зеленуватим відтінком).
Поява синьо-зеленого забарвлення свідчить про відсутність іонів Ca і Mg в розчині, тобто про повне зв'язуванні їх з Трилоном Б.
Результати оформляють в таблицю:
Таблиця 1.4. Результати визначення загальної твердості води
№ |
Об’єм води для |
Об’єм |
0,05 |
н. |
Загальна |
Середнє значення |
|
титрування, мл |
розчином |
трилону |
твердість, |
|
|
|
|
Б, мл |
|
|
мекв/л |
|
|
|
|
|
|
|
|
Рівняння реакцій :
а) Додавання індикатора до розчину солі :
МgСІ2 + Н2Іnd → Мg Іnd + НСІ |
Червоний |
б) Титрування |
|
Мg Іnd + Nа2Н2Y → Nа2Мg Y + Н2Іnd |
Синій |
Рис. 1.3. Хромоген чорний.
Якщо на титрування було витрачено більше 10 мл 0,05 н. розчину трилону Б, то це вказує, що в відміряному об'ємі води сумарний вміст іонів кальцію і магнію перевищує 0,5 ммоль. У таких випадках слід визначення повторити, взявши менший об'єм води і розбавивши його до 100 мл дистильованою водою. Нечітка зміна забарвлення в еквівалентній точці вказує на присутність міді і цинку. Для усунення впливу заважаючих речовин до відміряної для титрування проби води додають 1-2 мл розчину сульфіду натрію, після чого повторюють аналіз, як зазначено раніше.
Якщо після додавання до відміряного об’єму води буферного розчину і індикатора розчин для титрування поступово знебарвлюється, набуваючи сірого кольору, що вказує на наявність марганцю, то в цьому випадку до проби води, відібраної для титрування, до внесення реактивів слід додати 5 крапель 1 %-го розчину сірчанокислого гідроксиламіну і далі визначати твердість. Якщо титрування набуває вкрай затяжного характеру з нестійким і нечітким забарвленням в еквівалентній точці, що спостерігається при високій лужності
7

води, її вплив усувається додаванням до проби води 0,1 н. розчину соляної кислоти в кількості, необхідній для нейтралізації лужності води, з подальшим кип'ятінням або продуванням розчину повітрям протягом 5 хвилин. Після цього додають буферний розчин, індикатор і далі визначають твердість, як зазначено на початку проведення аналізу.
5. Обробка результатів експерименту
Загальну кислотність води розраховують за рівнянням:
Кзаг |
=V1×Н×1000 |
, |
(1.1) |
|
V2 |
|
|
де V1 – об’єм лугу, витраченого на титрування проби, мл; Н - нормальна концентрація робочого розчину лугу; V2 - об'єм води, взятої для дослідження, мл.
Загальну лужність води розраховують за рівнянням:
Лзаг |
=V1×Н×1000 |
, |
(1.2) |
|
V 2 |
|
|
де V1 – об’єм кислоти, витраченої на титрування проби, мл; Н - нормальна концентрація робочого розчину кислоти; V2 - об'єм води, взятої для дослідження, мл.
Загальну твердість води розраховують за формулою:
Т заг |
=V1×0,05×К×1000 |
, |
(1.3) |
|
V2 |
|
|
де V1 - кількість трилону Б, витраченого на титрування, мл; К - поправочний коефіцієнт до нормальної концентрації розчину трилону Б; V2 - об'єм води, взятої для визначення загальної твердості, мл.
Відносна похибка у визначенні загальної твердості для паралельних аналізів не повинна перевищувати 2%.
Для всіх вимірювань розраховують стандартне відхилення за формулою:
|
√ |
|
|
|
|
n |
|
|
|
s(x)= |
∑(xi |
−̄x)2 |
(1.4) |
|
i=1 |
|
, |
||
|
|
n−1 |
|
|
де xi - значення одного із вимірювань в серії х1, х2, …хі; ̄x - середнє значення в серії вимірювань; n - кількість вимірювань.
6.Контрольні питання
1.Чим обумовлена кислотність і лужність природних вод?
2.Чим обумовлена твердість води та типи твердості?
3.Поясніть природу тимчасової твердості води?
4.Що таке трилон Б?
5.На які групи поділяють воду за змістом в ній солей?
6.Які речовини заважають визначенню твердості води при комплексонометричному титруванні?
7.Як усувається вплив речовин, які заважають визначенню твердості води при комплексометричному титруванні?
8.До якого виду твердості води відносяться випробовувані проби?
8
Лабораторна робота № 2
ПОМ’ЯКШЕННЯ ВОДИ
1. Мета роботи
Вивчення пом’якшення води хімічним методом та методом іонного обміну. Визначити тимчасову та загальну твердість різних проб води, включаючи водопровідну. Пом’якшити води методом іонного обміну та хімічним методом. Оцінити ефективність різних способів пом’якшення води.
2. Теоретична частина
Промислова вода не повинна містити великої кількості розчинних солей та механічних домішок. Перед використанням води проводять попередню промислову водопідготовку, яка являє собою комплекс операцій, які забезпечують очистку води від механічних домішок, розчинених солей та газів.
Основні операції водопідготовки: очистка від механічних домішок відстоюванням, коагуляція з фільтрацією, пом’якшення та знесолювання води (часткове або повне), дегазація та знезаражування.
Пом’якшення води - повне або часткове видалення з розчину солей Ca2+ та Mg2+. Способи пом’якшення поділяють на фізичні, хімічні та фізико-хімічні.
Фізичні способи - це дистиляція, кип’ятіння, виморожування. Фізикохімічні способи - це електрохімічні (електродіаліз, електрокоагуляції, електроосмос) і іонообмінні процеси, при яких іони Ca2+ та Mg2+, які присутні у воді, обмінюються на інші іони, які містяться в іонообмінних смолах (іонітах).
Метод іонного обміну застосовується для зм'якшення або повного знесолення води. Його суть полягає в тому, що тверда речовина - іоніт - поглинає з розчину електроліту позитивні або негативні іони в обмін на еквівалентну кількість інших, однойменно заряджених іонів. У відповідності зі знаком заряду іонів, що обмінюються, розрізняють катіоніти (Na-катіоніти, H- катіоніти) і аніоніти (OH-аніоніти). Катіоніти - практично нерозчинні у воді речовини, що обмінюють іони натрію і водню на іони Са2+ і Мg2+. Іонний обмін між водою для пом'якшення і іонітом має характер гетерогенної хімічної реакції:
Na2[Kat] + Mg(HCO3)2 «Mg[Kat] + 2NaHCO3; Na2[Kat] + CaCl2 « Ca[Kat] + 2NaCl.
Основною технологічною характеристикою іонітів є їх обмінна ємність, яка характеризує здатність іоніту поглинати певну кількість іонів в даних умовах. При досягненні межі обмінної ємності іоніту проводять його регенерацію - Na-катіоніти регенерують 5-10%-м розчином NaCl:
Mg[Kat] + 2NaCl = MgCl2 + Na2[Kat].
Хімічні способи пом'якшення води - вплив хімічних сполук, що переводять іони Са2+ і Мg2+ в малорозчинні сполуки, які легко видаляються. Для усунення тимчасової твердості використовують вапняний спосіб (гашене вапно) і натронний (їдкий натр), для усунення постійної твердості - содовий (кальцинована сода). Для одночасного усунення і тимчасової і постійної
9
твердості використовують методи: вапняно-содовий (гашене вапно і кальцинована сода).
Ca(HCO3)2 + Ca(ОН)2 = 2CaCO3 + 2H2O
Mg(HCO3)2 + 2Ca(ОН)2 = 2CaCO3 + Mg(OH)2 + 2H2O вапняний
MgCl2 + Na2CO3 = MgCO3 + 2NaCl
CaSO4 + Na2CO3 = CaCO3 + Na2SO4 содовий
і фосфатний (тринатрійфосфат):
Ca(HCO3)2 + 2Na3PO4 = Ca3(PO4)2 + 6NaHCO3 3MgCl2 + 2Na3PO4 = Mg3(PO4)2 + 6NaCl фосфатний
Найбільш ефективним хімічним способом пом'якшення води є вапняносодовий у поєднанні з фосфатним.
3.Завдання на виконання роботи
1.Визначити тимчасову та загальну твердість різних проб води, включаючи водопровідну.
2.Пом’якшити води методом іонного обміну та хімічним методом.
3.Оцінити ефективність різних способів пом’якшення води.
4. Експериментальна частина
Хімічні реактиви, посуд, обладнання
Іонообмінна колонка.
Бюретки об'ємом 25 мл.
Піпетки об'ємом 50 мл.
Циліндр об'ємом 5мл.
Колби об'ємом 250 мл.
Речовини і реактиви: тринатрійфосфат; 0,1 N розчин соляної кислоти; 0,05 N і 0,005 N розчини трилону Б, 20%-й розчин хлористого амонію, 20%-й розчин аміаку, хромоген чорний, метиловий оранжевий, етиловий спирт (для приготування індикаторів).
Порядок виконання роботи
Карбонатну (тимчасову) твердість води визначають титруванням проби досліджуваної води розчином соляної кислоти (працювати з обережністю!) в присутності індикатора метилового оранжевого. При цьому протікають реакції:
Ca(HCO3)2 + 2HCl = CaCl2 + 2H2O + 2CO2;
Mg(HCO3)2 + 2HCl = MgCl2 + 2H2O + 2CO2.
У конічну колбу об'ємом 250 мл за допомогою піпетки переносять 100 мл води для аналізу і титрують 0,1 М розчином соляної кислоти в присутності метилового оранжевого до появи помаранчевого забарвлення.
Результати оформляють в таблицю:
10
