
МельникБуляндра.Теплотехніка_ДРУК
.pdfМІНІСТЕРСТВО ОСВІТИ І НАУКИ, МОЛОДІ ТА СПОРТУ УКРАЇНИ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ ХАРЧОВИХ ТЕХНОЛОГІЙ
ТЕПЛОТЕХНІКА (ТЕОРЕТИЧНІ ОСНОВИ ТЕПЛОТЕХНІКИ)
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ
до вивчення дисципліни, проведення практичних занять та виконання контрольної роботи
для студентів за напрямами: 6.051701 “Харчові технології та інженерія”, 6.050502 “Інженерна механіка”, 6.050503 “Машинобудування” денної та заочної форм навчання
Всі цитати, цифровий та фактичний |
СХВАЛЕНО |
матеріал, бібліографічні відомості |
на засіданні кафедри |
перевірені. Написання одиниць |
теплотехніки |
відповідає стандартам |
Протокол № 2 |
|
від 28.09.2011р. |
Підписи авторів_________________ З.П.Мельник
_________________О.Ф.Буляндра “28 “ вересня 2011 p.
Київ НУХТ 2011
2
Теплотехніка (Теоретичні основи теплотехніки): Метод. рекомендації до вивчення дисципл., провед. практ. занять та викон. контр. роботи для студ. за напрямами: 6.051701 “Харчові технології та інженерія” , 6.050502 “Інженерна механіка”, 6.050503 “Машинобудування” ден. та заочн. форм навч. / Уклад.: З.П.Мельник, О.Ф.Буляндра – К.: НУХТ, 2011.–64 с.
Рецензент: Д.Є.Сінат-Радченко, канд..техн.наук, професор
Укладачі: З.П.Мельник, канд..техн.наук
О.Ф.Буляндра, д-р техн..наук
Відповідальний за випуск: О.Ф.Буляндра, д-р техн..наук, професор
3
1.Загальні відомості.
Харчова промисловість – галузь, насичена тепломасообмінними процесами, від досконалості яких значною мірою залежать якість і вартість готової продукції. Харчові підприємства споживають значну кількість теплоти та електричної енергії. Зростання цін на енергоносії ставить жорсткі вимоги до зниження витрат енергії на технологічні потреби і на виробництво продукції в цілому. Вартість енерговитрат у харчових виробництв перевищує 50% вартості загальних виробничих витрат. Основний шлях ліквідації дефіциту енергії в Україні – енергозбереження, в першу чергу за рахунок використання передових енергоощадних технологій та обладнання.
Інженер-технолог чи інженер-механік у своїй практичній діяльності має справу з різними тепломасообмінними процесами та обладнанням, які тісно пов’язані з основним технологічним процесами. Тому, він повинен уміти вибирати та грамотно експлуатувати різноманітне обладнання, ефективно використовувати паливно-енергетичні ресурси, вартість яких невпинно зростає, виявляти і якомога повніше використовувати вторинні енергоресурси. Необхідну підготовку з цих питань інженеру-технологу та інженеру-механіку має дати курс теплотехніки.
Предмет, мета і завдання дисципліни
Предмет дисципліни – вивчення способів отримання, перетворення, передачі та використання теплоти, а також принципи дії та конструктивні особливості різних теплоенергетичних установок і теплообмінних апаратів.
Мета вивчення дисципліни – засвоєння основних положень теоретичних основ теплотехніки та їх застосування.
У результаті вивчення дисципліни студенти повинні:
знати теплотехнічну термінологію, термодинамічні властивості робочих тіл, які використовують у теплових двигунах, теплових машинах і в теплообмінних апаратах різних галузей промисловості, основні газові закони, перший і другий закони термодинаміки, основні термодинамічні процеси та цикли; процеси переносу теплоти, закономірності цих процесів, способи визначення кількості теплоти, що переноситься, та необхідну для цього поверхню теплоперенесення, основні положення теплового розрахунку теплообмінних апаратів; призначення, будову та принцип дії обладнання теплоенергетичних установок;
уміти за допомогою таблиць, діаграм і формул визначати термодинамічні властивості робочих тіл, використовувати вивчені закони для розв′язання
4
інженерних задач, досліджувати термодинамічні цикли, визначати їх ефективність та оцінювати вплив різних факторів на економічність цих циклів; визначати вид і режим руху теплоносія, вид теплоперенесення, кількість теплоти, що передається, і необхідну поверхню теплоперенесення, виконувати проектно-конструкторські та перевірні розрахунки теплообмінних апаратів, аналізувати роботу діючих теплообмінних апаратів, знаходити причини незадовільної їх роботи та вживати заходи щодо їх усунення, аналізувати фактори, що впливають на економічність використання теплоти палива.
Базовими для вивчення дисципліни „Теплотехніка” («Теоретичні основи теплотехніки») є вища математика і фізика. В свою чергуі вона забезпечує вивчення таких дисциплін як „Технологічні комплекси харчових виробництв”, „Процеси і апарати харчових виробництв”, „Моделювання масо- і теплообмінних процесів”, „Типові технологічні об′єкти і процеси виробництв”, „Основи проектування систем автоматизації”, “Технологічні вимірювання та прилади”, „Автоматизація неперервних і періодичних процесів”, „ Ідентифікація та моделювання технологічних об′єктів “ і т.п., виконання курсових і дипломних проектів та ін. Розподіл годин за формами навчання і видами занять наведено у табл.1.
Форма
навча Курс
н
ня
Денна |
І |
6.051701 |
І |
6.050502 |
|
6.050503 |
|
Заочна |
ІІ |
6.051701 |
|
6.050502 |
|
6.050503 |
|
Скороч |
IV |
6.051701 |
|
6.050502 |
|
6.050503 |
|
навчання) |
|
Чверть (для денної форми |
або семестр |
2(3)
4
8
|
|
|
|
|
|
|
|
|
|
Таблиця 1. |
||||
|
|
|
|
Кількість годин |
|
|
|
|
|
Контроль |
|
|||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
навчальної |
||
|
|
|
|
|
|
самостійної роботи |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
роботи |
|
|
Всього |
аудиторних |
Індивідуальні завдання |
|
|
|
стулентів |
|
|||||||
(кількість завдань і |
|
|
|
|
||||||||||
|
занять |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
загальна кількість |
|
|
кількістьМодульний( |
четвертіукожніймодулів) |
|
четвертьПідсумковий( контролюформа)або |
||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
годин) |
|
Підго |
|
|
||||
|
|
|
|
|
|
|
|
|
тов- |
|
|
|
|
|
|
|
|
Пра |
|
Лабо |
Реферат |
Кур |
Конт- |
|
|
|
|
|
|
|
Л |
|
кти |
|
ратор |
и |
со |
роль- |
ка до |
|
|
|
|
|
|
е |
|
чні |
|
ні |
розрахун |
ві |
ні робо |
аудит |
|
|
|
|
|
|
к |
|
|
|
|
кові, |
прое |
ти |
орних |
|
|
|
|
|
|
ц |
|
|
|
|
графічні, |
кти |
|
за |
|
|
|
|
|
|
і |
|
|
|
|
розра- |
(ро- |
|
нять |
|
|
|
|
|
|
ї |
|
|
|
|
хунково- |
боти) |
|
|
|
|
|
|
|
|
|
|
|
|
|
графічні |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
роботи |
|
|
|
|
|
|
|
|
108 |
16 |
|
- |
|
16 |
-- |
- |
--- |
76 |
|
|
2 |
|
І |
135 |
32 |
|
16 |
|
16 |
71 |
|
|
2 |
|
З |
|||
135 |
32 |
|
16 |
|
16 |
|
- |
|
71 |
|
|
2 |
|
З |
108 |
6 |
|
6 |
|
- |
-- |
- |
1/20 |
79 |
|
|
-- |
|
З |
135 |
8 |
|
2 |
|
4 |
1/20 |
101 |
|
|
|
З |
|||
135 |
8 |
|
2 |
|
4 |
|
- |
1/20 |
101 |
|
|
|
|
З |
108 |
6 |
|
6 |
|
- |
-- |
- |
1/20 |
76 |
|
|
_ |
|
З |
135 |
4 |
|
4 |
|
4 |
1/20 |
103 |
|
|
|
|
З |
||
4 |
|
4 |
|
4 |
|
- |
1/20 |
103 |
|
|
|
|
З |
|
135 |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
2. Зміст дисципліни 2.1.Лекційні заняття
Лекції дають студентам загальне уявлення про дисципліну та її науковий метод, знайомлять їх з останніми досягненнями науки і практики, формують світогляд майбутніх спеціалістів. Назва тем лекційних занять, їх зміст наведено у табл.2.
Таблиця 2.
№ |
|
|
Тема та зміст лекції |
|
|
||
п/п |
|
|
|
|
|
|
|
1 |
|
|
2 |
|
|
|
|
1. |
Вступна лекція |
|
|
|
|
|
|
|
Енергетика та її значення у народному господарстві |
||||||
|
України. |
Енергопостачання |
підприємств |
харчової |
|||
|
промисловості. Основні завдання і поcлідовність вивчення |
||||||
|
курсу. |
|
|
|
|
|
|
2. |
Технічна термодинаміка |
|
|
|
|
||
2.1 |
Основні поняття термодинаміки. Параметри стану |
||||||
|
робочого тіла. Основні закони |
ідеальних |
газів, |
рівняння |
|||
|
стану. |
|
|
|
|
|
|
2.2 |
Внутрішня енергія, робота, теплота. Ентальпія, ентропія. |
||||||
|
Теплоємність газів. |
|
|
|
|
|
|
2.3 |
І закон термодинаміки. Основні термодинамічні процеси |
||||||
|
ідеальних газів, їх дослідження. |
|
|
|
|
||
2.4 |
Колові процеси або цикли. Прямі та зворотні цикли. Цикл |
||||||
|
Карно. ІІ закон термодинаміки. |
|
|
|
|
||
2.5 |
Реальні |
гази, їх |
рівняння стану. |
Водяна |
пара, |
основні |
|
|
поняття та визначення. р-ν,T-s |
i |
h-s - діаграми водяної |
||||
|
пари. |
|
|
|
|
|
|
2.6 |
Визначення термодинамічних параметрів води і водяної |
||||||
|
пари. Таблиці термодинамічних властивостей води і |
||||||
|
водяної пари. Основні термодинамічні процеси водяної |
||||||
|
пари, їх дослідження. |
|
|
|
|
||
2.8 |
Газові суміші. Вологе повітря, його основні параметри і |
||||||
|
характеристики. Діаграма ентальпія - вологовміст вологого |
||||||
|
повітря та її використання. |
|
|
|
|
||
3. |
Теплопередача |
|
|
|
|
|
|
3.1 |
Основні |
види |
процесів |
|
переносу |
теплоти: |
|
|
теплопровідність, конвекція, теплове випромінювання. |
||||||
|
Теплопровідність однота багатошарових плоских і |
||||||
|
циліндричних стінок у стаціонарному режимі, теплова |
||||||
|
ізоляція. |
|
|
|
|
|
|

6
1 |
|
|
2 |
|
|
3.2 |
Конвективне теплоперенесення. Основи теорії подібності |
||||
|
процесів. Критерії подібності і критеріальні рівняння. |
||||
|
Тепловіддача при вільній і вимушеній конвекції. |
||||
3.3 |
Тепловіддача при кипінні рідини. Тепловіддача при |
||||
|
плівковій конденсації пари, характеристика процесів. |
||||
|
Основні |
рівняння |
для |
визначення |
коефіцієнтів |
|
тепловіддачі. |
|
|
|
|
3.4 |
Теплопередача крізь однота багатошарову плоску і |
||||
|
циліндричну стінки. Теплообмінні апарати та їх |
||||
|
розрахунок. Променистий теплообмін. |
|
|||
4. |
Теплоенергетичні установки. Теплопостачання |
4.1 |
Котельні установки. Основні та допоміжні елементи |
|
котельної установки. Види і характеристика палива. |
|
Теплота згоряння палива. Умовне паливо. |
4.2 |
Розрахунки процесів горіння палива. Тепловий баланс і |
|
К.К.Д. котельного агрегату. Визначення витрати палива. |
4.3 |
Сучасні конструкції котельних агрегатів. Вертикально - |
|
водотрубні котли типів ДКВР, КЕ, ДЕ. Екранні котли . |
4.4 |
Топкове обладнання. Пароперегрівники, економайзери, |
|
повітропідігрівники, їх устрій і призначення. |
|
Водопідготовка. |
4.5 |
Загальні відомості про системи теплопостачання |
|
промислових підприємств. Теплові підстанції. Теплові |
|
мережі. Визначення витрат теплоти на технологічні |
|
потреби, гаряче водопостачання, вентиляцію. |
4.6Використання вторинних енергоресурсів та відновлюванних джерел енергії. Нові напрямки в розвитку енергетики та енергозбереженні.
2.2.Практичні заняття
Під час практичних занять студенти глибше опановують теоретичний матеріал дисципліни, набувають практичного досвіду використання його для розв′язання задач, уміння використання довідників, таблиць, діаграм та ПК. Для закріплення пройденого матеріалу та самоперевірки студент виконує самостійно розв’язання типових задач приведених у відповідних розділах рекомендаціяй
Назва тем практичних занять та їх обсяг у годинах подані в таблиці 3.
7
|
|
Таблиця 3. |
№ |
|
Кількість годин |
п/п |
|
за денною/ |
|
Тема практичного заняття |
заочною |
|
|
формою |
|
|
навчання |
|
|
|
1. |
Термічні параметри стану. Рівняння стану ідеальних |
2/1 |
|
газів. Теплоємність газів. Суміші газів. 1 закон |
|
|
термодинаміки. |
|
2. |
Основні термодинамічні процеси ідеальних газів. |
2/0,5 |
|
Поняття про роботу та теплоту. 2 закон |
|
|
термодинаміки. Цикл Карно. |
|
3. |
Водяна пара. Визначення параметрів води та водяної |
2/1 |
|
пари за допомогою таблиць. h-s діаграмма водяної |
|
|
пари. Термодинамічні процеси водяної пари. |
|
4. |
Цикли паросилових установок. Вологе повітря |
2/0,5 |
5. |
Теплопровідність крізь однота багатошарові стінки |
2/0,5 |
|
при граничних умовах першого та третього роду |
|
6. |
Тепловіддача при вільному і вимушеному русі |
2/0,5 |
|
теплоносія. Тепловіддача при конденсації пари і |
|
|
кипінні рідини |
|
7. |
Основи теплового розрахунку теплообмінних |
2/1 |
|
апаратів. |
|
8. |
Основи розрахунку процесів горіння |
2/1 |
|
|
|
|
Разом |
16/6 |
На заняттях студент зобов’язаний мати інженерний калькулятор, конспект лекцій, підручник по дисципліні, олівець, лінійку, витирачку, загальний зошит. На окремі заняття необхідно мати з собою додаткову літературу (відповідні таблиці,діаграми чи методичні вказівки – про це додатково, напередодні занять, їх попереджає лектор).Без виконання цих
умов студент до занять не допускається!!!
Студенти, які пропустили практичні заняття, повинні з дозволу деканату їх відпрацювати з іншою групою. У разі, коли такої можливості немає (в інших групах ці заняття уже пройшли), студенти, по узгодженню з викладачем, самостійно виконують контрольні роботи по пропущеним темам і захищають їх у призначений викладачем час. Студенти виконують контрольні завдання самостійно на окремих листах формату А4 в рукописному вигляді на одній стороні. Вони мають бути виконані охайно, розбірливим почерком. На
8
титульній сторінці треба вказати прізвище та ініціали студента, номер групи і номер шифру, який відповідає останнім цифрам його номеру залікової книжки. Вихідні данні вибираються за передостанньою та останньою цифрами шифру (номера залікової книжки) студента: наприклад, для шифру 990253.
Остання цифра |
Задані |
Передостання |
Задані величини |
||||
шифру |
величини |
цифра шифру |
|
|
|
||
3 |
|
|
|
5 |
|
|
|
Студенти заочної форми навчання виконують самостійно контрольну роботу, складену з контрольних завдань цих рекомендацій.. Завдання по кожній спеціальності формує викладач.
Роботи, виконані не за власним шифром, або неохайно та нерозбірливим почерком не розглядаються і не рецензуються.
Всі розрахунки слід виконувати в міжнародній системі вимірювань фізичних величин ( система СІ ). Розрахунки приводити у повній формі, записуючи пояснення, що підраховуються, розрахункові формули, замість відповідних умовних позначень – їх числові значення, результати обчислень і одиниці вимірювання отриманих величин.
Пояснювальний текст має бути лаконічним, при цьому допустимі лише загальноприйняті скорочення. У разі потреби розрахункові формули нумеруються для кожної окремої задачі. Переписувати умови задач потрібно у повному вигляді.
Студенти, які мають пропуски практичних занять і які їх не відпрацювали, до сесії не допускаються!!!.
За пропущені та невідпрацьовані практичні заняття студенти виконують і захищають наступні контрольні завдання:
1). Практичне заняття №1 - Задача №1 (КР №1, методичка №6624); 2). Практичне заняття №2 – Усі завдання згідно методички №6940;
3). Практичне заняття №3 – Розрахункова робота – задача №2 (КР №1, методичка №6624); 4). Практичне заняття №4 – Контрольне завдання по цій темі (табл. 4.7, с.34 даної методички);
5). Практичне заняття №5 - Контрольне завдання по цій темі (табл. 5.1, с.42 даної методички); 6). Практичне заняття №6 – Задача №3 (КР №1, методичка №6624);
7). Практичне заняття №7 - Задача №4 (КР №1, методичка №6624). 8). Практичне заняття №8 – Задача №2.3 (КР №2, методичка №7251).
Розділ “ТЕХНІЧНА ТЕРМОДИНАМІКА”
ЗАНЯТТЯ 1. “Термічні параметри стану. Рівняння стану ідеальних газів. Суміші газів. Теплоємність газів.”
Стан будь якої термодинамічної системи характеризують за допомогою макроскопічних фізичних величин, які називають – термічними змінними або параметрами стану. Як показує досвід, газ даної маси однозначно можна
9
охарактеризувати всього за допомогою трьох параметрів: питомого об’єму –
é |
м |
3 |
ù |
, абсолютного |
тиску – |
р[Па] , абсолютної температури –Т [К ]. |
υ ë |
|
кгû |
||||
Сукупність цих трьох |
параметрів |
називають – основними термічними |
||||
параметрами стану і вони повністю характеризують тепловий стан системи. Крім термічних параметрів стану існують так звані калоричні параметри стану (допоміжні), які раніше вимірювали у калоріях, звідки і отримали свою назву. До них відносять внутрішню енергію – U [ Дж], ентальпію – H [ Дж] і ентропію
S [ Дж К ]. Параметри стану системи, які не залежать від маси системи або
К ]. Параметри стану системи, які не залежать від маси системи або
числа мікрочастинок у системі, називають інтенсивними (абсолютний тиск, абсолютна температура, питомий об’єм) і вони не залежать від розмірів системи (тобто, в усіх частинах гомогенної системи вони залишаються незмінними). Параметри стану які залежать від маси системи або числа мікрочастинок у системі називають екстенсивними (внутрішня енергія,
ентропія, ентальпія). (Екстенсивні параметри характеризують систему як ціле , у той час як інтенсивні можуть приймати визначені значення в кожній точці системи) .
Формули для розрахунків:
Рівняння стану:
Однією з характерних закономірностей у поведінці макроскопічних тіл є те, що стан будь якого однорідного тіла, яке знаходиться в рівновазі характеризується (визначається) тільки двома незалежними параметрами ( p і
υ , p і T , T і υ ). Усі інші параметри можуть бути знайдені як функції цих двох параметрів. Досвід і теорія показують, що в загальному вигляді стан
системи характеризується рівнянням типу ϕ( p,T,υ) = 0 |
. Це |
рівняння і |
називають термічним рівнянням стану. Вигляд функції ϕ |
різний і залежить |
|
від природи тіла. Найбільш простим рівнянням стану |
тіла |
є рівняння |
Клапейрона-Менделеєва для ідеальних газів, яке ми подамо у чотирьох видах: pV = mRT , pυ = RT , pVμ = RμT , pV = γ RμT (1.1) , де Vμ - молярний об’єм
газу, м3 кмоль ;γ − кількість молів газу; Rμ = 8314 Дж
кмоль ;γ − кількість молів газу; Rμ = 8314 Дж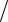 (кмоль×К )- універсальна газова стала; R - питома газова стала, Дж
(кмоль×К )- універсальна газова стала; R - питома газова стала, Дж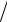 (кг× К ).
(кг× К ).
Суміші газів.
Під газовою сумішшю розуміють механічну суміш окремих газів, які не вступають між собою у хімічну реакцію, і при цьому кожний компонент суміші зберігає свої властивості і поводить себе так, наче б то він один займає весь об’єм. Зрозуміло, що опис стану суміші газу відрізняється від опису стану ідеальних газів, де потрібно знати всього два параметри, так як тут необхідно ще знати і склад суміші (тобто, знати газову сталу суміші або її молекулярну масу). Але в цілому, газові суміші також доволі точно підкоряються основному рівнянню стану.

10
Крім того, суміші ідеальних газів підкоряються закону Дальтона, згідно якому сума парціальних тисків компонентів газу дорівнює тиску газової
п
суміші, тобто p1 + p2 +...+ pп = å pі = pсум (1.2) і закону Амага , за яким сума
і=1
приведених (парціальних) об’ємів окремих компонентів суміші дорівнює
п
об’єму суміші:V1 +V2 +...+Vп = åVі =Vсум (1.3). (Парціальний об'єм – це об’єм,
і=1
який займав би компонент суміші в тій же кількості при температурі і тиску суміші. Парціальний тиск – це такий тиск, який створював би кожний компонет суміші газу, якби він один займав той же об’єм, у тій же кількості і при тій же температурі, що і суміш). Склад суміші газів може бути заданий масовими, об'ємними і мольними частками (у випадку ідеальних газів мольні частки дорівнюють об'ємним).
Масова частка - це відношення маси компоненту до маси суміші:
g1 = m1 |
;g2 = m2 |
;...gn = mn |
|
n |
|
mсм |
, отже ågі =1. |
(1.4) |
|||
|
mсм |
mсм |
i=1 |
|
Об'ємна частка – це відношення парціальног об'єму компоненту до об'єму суміші:
r1 =V1 |
;r2 =V2 |
;...rn =Vn |
n |
|
,де årі =1. |
(1.5) |
|||
|
Vсм |
Vсм |
Vсм i=1 |
|
Молярна частка – це відношення кількості молів компонента суміші до кількості молів самої суміші :
x =γi |
γ |
|
= mi ×μсм |
mсм |
×μ |
= ρi ×Vi ×μсм |
ρ ×V ×μ |
, |
|
|
(1.6) |
|||||||||||||||||||||||||
|
i |
|
|
см |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
ρi |
|
|
|
|
= μi |
|
i |
|
|
|
|
|
x =γi |
см |
|
|
см |
i |
|
|
|
|
||||||
але так як |
ρсм |
|
μсм |
, |
то |
γсм |
= r |
, |
тобто молярні та о’бємні |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i |
|
|
|
|
i |
|
|
|
|
|
|||||||
частки ідеальних газів чисельно рівні. |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
Розглянемо зв’язок між об’ємною та массовою частками : |
|
|
|
|||||||||||||||||||||||||||||||||
g |
i |
= mi |
m |
= ρiVi |
ρ V |
|
= ρi |
ρ |
|
|
×r = μi |
μ |
|
×r = Rсм |
R |
×r , |
|
|
(1.7) |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
см |
|
i |
|
см |
i |
|
|
|
|
i |
|
|
|
||||||||||||
|
|
|
|
|
|
см |
|
|
|
см |
|
см |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i |
|
|
|
|
|||||
але так |
|
ρ = 1υ ,υ =Vμ μ , ρ = μV ;μ = Rμ R , то маємо: |
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
μ |
|
|
|
Rμ |
|
|
|
|
|
|
|
|
|
ri |
|
= gi × |
ρ |
см ρ |
= gi × |
μ |
см μ |
|
= gi |
× |
R |
|
R |
;Rсм = |
μ |
|
;Rсм = ågi ×Ri = Rμ å |
g |
i μ . |
(1.8) |
||||||||||||||||
|
|
|
i |
|
i |
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
см |
|
|
|
|
|
|
см |
|
|
|
i |
|
||
Якщо суміш задано об’ємними частками, то маємо: |
|
|
|
|||||||||||||||||||||||||||||||||
μ |
|
|
= |
|
|
|
r μ = R |
å |
r |
|
|
|
;R |
|
|
= |
Rμ |
|
|
|
= |
|
1 |
|
|
. |
|
|
(1.9) |
|||||||
|
|
|
|
|
i |
Ri |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
см |
|
å i i |
|
|
μ |
|
см |
|
|
|
|
åri ×μi |
|
|
|
årі × Ri |
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Теплоємність газів.
Однією з важливих величин, пов’язаних з енергією системи, є теплоємність. З практики відомо, що для того, щоб нагріти дві різні речовини з однаковою масою і температурою до якоїсь іншої певної температури потрібно затратити різну кількість енергії. І ця кількість необхідної енергії залежить від
