
Основы токсикологии
.pdf
-нарушение синтеза нуклеотидов
-разрушение РНК
-нарушение механизмов регуляции синтеза РНК
3. Синтез белка. Трансляция
-нарушение организации и процессии рибосом и полисом
-нарушение полимеризации аминокислот
-нарушение образования аминоацетил-tРНК
-нарушение формирования конформации белка и его третичной и четвертичной структур
-нарушение механизмов регуляции трансляции
5.1.Синтез ДНК. Репликация
Как указывалось ранее, нарушение репликации может явиться следствием химического взаимодействия ДНК с токсикантами. Однако возможны и иные механизмы повреждения (таблица 4).
Таблица 4. Механизмы действия ингибиторов синтеза нуклеиновых кислот и белков
>Механизм действия |
|
|
>Примеры |
|
|
Ковалентное связывание с ДНК |
|
иприт, циклофосфан |
|
||
Индукция однонитевых разрывов |
|
этиленоксид, этиленимин |
|
||
Интеркалация |
|
|
|
профлавин, этидиумбромид |
|
Нековалентное связывание с ДНК |
|
актиномицин |
|
||
Взаимодействие с РНК-полимеразой |
|
-аманитин |
|
||
Взаимодействие с ревертазой |
|
стрептоварицин |
|
||
Взаимодействие с ДНК-полимеразой |
|
эдеин, налидиксовая кислота |
|
||
Влияние на синтез нуклеотдиов |
|
фаллоидин, цитозин-арабинозид |
|||
Нарушение |
обмена |
фолиевой |
кислоты, |
аминоптерин, аминопурин, азогуанин, |
|
пиримидина, пурина |
|
|
азоцитозин |
|
|
Нгнетение образования аминоацетил-tРНК |
6-флюоротриптофан, |
триптазан, |
|||
порвалин |
|
||||
|
|
|
|
|
|
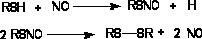
1. Угнетение активности ДНК-полимераз и других ферментов синтеза.
Эдеин и налидиксовая кислота угнетают активность ДНК-полимераз, а N-диметилрифампицин подавляет РНК-зависимый синтез ДНК (ингибитор ревертазы). Соединения, нарушающие конформацию ДНК, могут подавлять реакцию её полимеризации, не изменяя активность соответствующих энзимов.
2. Влияние на синтез дезоксирибонуклеотидов.
Элементарной единицей ДНК являются дезоксирибонуклеотидтрифосфаты. Их синтез осуществляется в организме и может быть прерван на различных этапах (синтез пуринов, пиримидинов, нуклеотидов). Вещества, нарушающие синтез нуклеотидов, называются антиметаболитами. В качестве антиметаболитов могут выступать различные аналоги естественных предшественников нуклеотидов, которые вытесняют их из связи с энзимами. Частично эти аналоги перерабатываются и встраиваются в структуру нуклеиновой кислоты (2- аминопурин, 5-флюороурацил), при этом нарушается строение и функция последней.
Некоторые вещества (нуклеозидные антибиотики - кордицепин) блокируют встраивание дезоксирибонуклеотидов в молекулу ДНК.
3. Влияние на регуляцию синтеза ДНК.
В качестве регуляторов репликации, у эукариотов выступают цитоплазматические факторы - специальные белки, ответственные за процесс инициации. Их проникновение в ядро показано экспериментально. Определенную роль играют также гуморальные факторы роста, гормоны. Так, кортикоиды и глюкагон усиливают синтез ДНК.
4. Действие на разрушение ДНК и её репарацию.
Эндонуклеазы и лигазы - энзимы, участвующие в репарации мутированных или неправильно синтезированных молекул ДНК. Так, поврежденный нуклеотид может быть вырезан из молекулы ДНК (эндонуклеазы), а на его место встроен неповрежденный фрагмент (лигазы). Резкое повышение внутриклеточной концентрации Са2+, наблюдающееся при острой интоксикации некоторыми токсикантами (см. выше), сопровождается активацией эндонуклеаз и разрушением ДНК.
Ингибиторы лигаз угнетают процессы репарации ДНК и повышают частоту мутаций (например, бензамид и его производные).
5. Другие механизмы действия.
Помимо повреждения ДНК и ферментов, участвующих в её синтезе и репарации, существуют и другие способы токсического нарушения процесса репликации. Так, в фазе приготовления к митозу возможно повреждение центриолей и синтеза митотического аппарата, образующего клеточное веретено. Веретено формируется SH-содержащими протеинами, которые благодаря -S-S- связям образуют нитевидные структуры. Естественно, токсиканты, взаимодействующие с SH-группами способны повреждать митотические веретена. Примерами таких токсикантов являются мышьяк, ртуть и их соединения, колхицин, подофилотоксин и др.
5.2. Синтез РНК. Транскрипция
В клетках определяются несколько форм РНК. Особое функциональное значение имеют: м- РНК, как матрица для синтеза полипептидов, t-РНК - молекула-переносчик аминокислот на рибосомы для их последующей полимеризации, r-РНК - составная часть рибосом. Возможны следующие механизмы повреждения РНК:
1. Нарушение конформации и свойств ДНК (см. выше).
На поврежденной ДНК синтезируется измененные молекулы РНК, не свойственные организму.
2. Угнетение активности РНК-полимераз.
Ингибитором РНК-полимеразы является, в частности, аманитин - яд бледной поганки.
3. Влияние на РНК-процессинг.
Это явление изучено недостаточно. Полагают, что кордицепин (см. выше) ингибирует начало процесса синтеза РНК.
4. Угнетение синтеза нуклеотидов.
Как уже указывалось, целый ряд веществ, так называемых антиметаболитов, способен угнетать синтез пуриновых и пиримидиновых оснований и нуклеотидов. Такие вещества, прежде всего, нарушают обмен РНК, находящихся в состоянии активного обращения. Возможно извращение синтеза РНК вследствие встраивания в молекулу "ложных" нуклеотидов (5-бромурацил, 8-азагуанин).
5. Нарушение регуляции синтеза РНК.
Синтез РНК контролируется целым рядом факторов. Большая часть генома находится в репримированном состоянии, т.е. блокирована специальными белками (гистонами) и не участвует в процессе транскрипции. Активация этих отрезков молекулы ДНК осуществляется низкомолекулярными хромосомными РНК, цитоплазматическими протеинами и другими факторами (например гормонами). Так, стероиды (эстрогены, андрогены, кортикостероиды) стимулируют синтез РНК и, следовательно, белка. Аналогичные эффекты описаны для инсулина и глюкагона. Многочисленные синтетические соединения (барбитураты, толбутамид, бензпирен, метилхолентрен, диоксин и т.д.) вызывают индукцию синтеза микросомальных энзимов, ответственных за метаболизм ксенобиотиков. По всей видимости, они взаимодействуют с репрессорными протеинами, вызывают депримирование ДНК и активируют тем самым синтез РНК и соответствующих белков.
5.3. Синтез белков. Трансляция
Объединение аминокислот в полипептидную цепь осуществляется на рибосомах или полисомах. Токсиканты могут вмешиваться в процессы синтеза белка и на этом этапе. Возможны следующие механизмы токсического действия:
1. Нарушение конформации рибосом и организации полисом.
Этот механизм экспериментально показан для целого ряда антибиотиков, действующих на рибосомы и полисомы бактериальных клеток.
2. Угнетение процесса образования полипептидной цепи.
Многие антибиотики вмешиваются в процесс синтеза белка на рибосомах бактерий. При этом выявляются нарушения:
-процессов считывания информации с кода мРНК;
-образования формилметионил-tРНК и повреждение тем самым инициации синтеза полипептидной цепи;
-образования пептидных связей (таков, в частности, один из механизмов токсического действия дифтирийного токсина);
-затруднение транслокации пептидил-tРНК и мРНК.
3. Угнетение синтеза и формирования аминоацил-tРНК.
Необходимым этапом полимеризации аминокислот и образования полипептидной цепи является их активация, путем образования комплекса с tРНК (образование аминоацил-tРНК). На первом этапе происходит взаимодействие аминокислот с АМФ (активация), и лишь затем образуется связь с РНК. Введение в среду, где инкубируется экспериментальный материал (делящиеся клетки, бактерии), ненормальных аминокислот, например D-форм или таких как этионин, тиенилаланин, алкилвалин и др., приводит к угнетению активности синтезирующих энзимов, а следовательно и процесса синтеза белка в целом.
4. Нарушение конформации синтезируемой белковой молекулы.
Синтезированная полипептидная цепь спонтанно формирует свою третичную структуру. Отчасти процесс проходит при участии различных кофакторов. Угнетение синтеза таких кофакторов или поступление в организм их неактивных аналогов (антивитаминов) нарушает процесс.
5. Влияние на регуляцию процесса трансляции.

Имеются данные о том, что процесс трансляции, особенно его инициация и терминация, подлежат контролю. Отвечают за это особые виды регуляторных РНК и протеинов, а также механизмы контролирующие уровень цАМФ в клетках. Образованию полисом способствует повышение содержания эстрадиола; инсулин активирует процесс инициации синтеза белка на малых субъединицах рибосом. Витамин К блокирует на уровне трансляции образование протромбина и других факторов свертывания крови и т.д. Усиление или угнетение рассмотренных процессов может лежать в основе токсического действия некоторых веществ.
5.4. Биологические последствия действия токсикантов на нуклеиновый обмен и синтез белка
Токсикологическое значение веществ, вмешивающихся в процесс синтеза белка и клеточное деление, обусловлено их цитостатическим, иммуносупрессорным, мутагенным, тератогенным и канцерогенным действием (см. соответствующие разделы).
Повреждающее действие химических веществ на ДНК называется генотоксическим. Наиболее чувствительны к генотоксическому действию клетки, способные к делению (эмбриональные, герменативные, костного мозга, эпителия почек, кожи, слизистой желудочно-кишечного тракта и т.д.). Последствия повреждения ДНК зависят от дозы токсиканта. Высокие дозы вызывают цитостатический эффект (гибель пула делящихся клеток), более низкие - канцерогенное, тератогенное, мутагенное действие. В основе канцерогенного, тератогенного, мутагенного действия лежат по сути общие механизмы, однако превращение конкретного вещества в канцероген, тератоген, мутаген зависит от целого ряда условий (таблица 5).
Таблица 5. Условия воздействия генотоксиканта, определяющие форму развития токсического процесса: канцерогенеза, мутагенеза, тератогенеза
>Токсический |
>Чувствительная |
>Оптимальное |
>Продолжительность |
|||
процесс |
ткань |
время воздействия |
действия и доза |
|||
Канцерогенез |
Любая |
Неопределеное; |
Обычно |
хроническое, |
||
пролиферирующая |
||||||
любая стадия митоза |
беспороговое |
|||||
|
ткань |
|||||
|
|
|
|
|
||
Мутагенез |
Герменативные |
Все |
стадии |
Острое |
и хроническое, |
|
клетки |
гаметогенеза |
|
беспороговое |
|||
|
|
|||||
|
Все зародышевые |
Наивысшая |
- на |
Только |
острое, в дозах |
|
Тератогенез |
ранних |
стадиях |
||||
ткани |
дифференциации |
выше пороговых |
||||
|
||||||
|
|
тканей |
|
|
|
|
Существует представление, согласно которому проникновение в организм даже единственной молекулы генотоксиканта (в отличие от токсикантов с иным механизмом токсического действия) может привести к пагубным последствиям. Дело в том, что химическое повреждение единичной молекулы ДНК в единичной клетке макроорганизма, при стечении обстоятельств, может стать причиной мутогенеза, тератогенеза, канцерогенеза. Вероятность такого события бесконечно мала, но теоретически возможна. Такой характер действия веществ на биосистемы называется беспороговым.
Другим, важным с позиции токсикологии, последствием действия химических веществ на процессы синтеза белка является индукция микросомальных ферментов и, следовательно, изменение скорости и характера метаболизма ксенобиотиков. Значение этого эффекта неоднозначно, поскольку в итоге токсичность одних веществ уменьшается, других - возрастает (см. раздел "Метаболизм ксенобиотиков").
ГЛАВА 2.3. ДЕЙСТВИЕ ТОКСИКАНТОВ НА МЕХАНИЗМЫ РЕГУЛЯЦИИ КЛЕТОЧНОЙ АКТИВНОСТИ Существование высших форм организации живого стало возможным только благодаря
кооперативному взаимодействию частей в рамках целостного организма. Так как состояние клеток, в силу их специфических свойств, определяет функциональное состояние организма в целом, клеточная активность должна регулироваться в соответствии с потребностями макроорганизма. Таким образом, кооперация, прежде всего, означает регуляцию. Можно выделить три основных механизма регуляции клеточной активности: прямое межклеточное взаимодействие, нервный и гуморальный контроль. Каждый из этих механизмов может стать
объектом |
|
токсического |
воздействия. |
1. |
Прямое |
межклеточное |
взаимодействие |
Самая простая форма взаимодействия - влияние на соседние клетки продуктами собственного метаболизма. Межклеточное пространство для большинства тканей составляет около 15 нм, поэтому метаболиты за счет простой диффузии преодолевают это расстояние с большой скоростью. Кроме того между отдельными клетками возможен прямой обмен веществом через области межклеточных контактов, так называемые коннексоны. Во многих тканях клетки вырабатывают специальные биологически активные вещества, влияющие на функциональное состояние соседних структур. Особенно богато такими локальными биорегуляторами сосудистое русло. Здесь синтезируются и действуют оксид азота, эндотелины, лейкотриены, тромбоксаны, простогландины, фактор агрегации тромбоцитов. К числу таких веществ относится большая группа цитокинов и т.д. Механизм действия некоторых токсикантов может быть связан с активацией процесса образования этих веществ, ингибированием разрушения, имитацией их действия (агонисты). Так, полагают, что в основе регулирующего действия оксида азота на тонус сосудов лежит его способность образовывать с некоторыми эндогенными SH-содержащими веществами нестабильные нитрозотиолы. Период полусуществования такого соединения в организме 3 - 5 секунд:
Падение артериального давления, наблюдаемое при отравлении такими веществами, как NaNO2, нитропруссид, органические нитраты и нитриты может быть обусловлено образованием нитрозотиолов, т.е. вещества в данном случае могут проявлять свойства агонистов NO. Тесный контакт между клетками обеспечивает сдерживание их размножения. Механическое разобщение клеток (пороз) провоцирует клеточный рост. Установлено, что у клеток злокачественных опухолей повреждены структуры, воспринимающие сигналы контактного ингибирования, поэтому даже в условиях полного окружения другими клетками они продолжают бурно размножаться. Не исключено, что в этом состоит один из механизмов
канцерогенного |
|
действия |
токсикантов. |
2. |
Механизмы |
гуморальной |
регуляции |
С увеличением массы тела и сложности организации многоклеточного организма механизмы межклеточного взаимодействия становятся недостаточными для обеспечения регуляции его функций. Формируются специальные типы клеток, функция которых состоит в контроле за физиологической активностью других клеточных систем (эндокринные железы). Их влияние передаётся через кровь и межклеточную жидкость. В качестве переносчиков информации (веществ-регуляторов) выступают продукты метаболизма этих специальных клеток (гормоны). В регулируемых же клетках формируется специальный рецепторный аппарат, чутко реагирующий на изменение концентрации в окружающей среде соответствующих регуляторов (см. раздел "Селективные рецепторы"). Активация рецепторов приводит к изменению функциональной активности клеток. Рецепторная система усиливает воспринимаемый сигнал. Так, инсулин или глюкагон, концентрация которых в плазме составляет около 0,1 нМ, регулирует уровень глюкозы, содержание которой в крови - около 5 мМ. Гормоны модулируют специфическую активность определенных энзимов, влияют на скорость их синтеза и разрушения, регулируют транспорт химических веществ через биологические мембраны. Действие гормона на органы и системы определяется его концентрацией в крови, а также наличием и количеством рецепторов чувствительных к нему в данной ткани. Концентрация гормона, в свою очередь, зависит от интенсивности процессов его синтеза и разрушения.
Возможна интоксикация гормональными препаратами при их необоснованном введении или применении в дозах, существенно превышающих рекомендуемые.
Так как поступивший в кровь гормон разносится по всему организму, специфичность действия определяется характером распределения в тканях соответствующих рецепторов. Если рецепторы к гормону имеются у всех клеток организма, то и действие он оказывает на все
органы |
и |
ткани |
(инсулин, |
катехоламины |
и |
т.д.). |
Можно |
выделить |
две основные |
группы гормонов |
с учетом механизма |
их |
действия. |
1. Гормоны, регулирующие процессы синтеза белка. К числу таких относятся эстроген, андроген, тироксин, трииодтиронин, соматотропин, глюкокортикоиды, инсулин, АКТГ и некоторые другие. Эти гормоны усиливают белковый синтез. Их действие нарушается блокаторами синтеза белка: актиномицином, пуромицином и др. (см. выше). Индуцирующая активность гормонов по-разному реализуется в разных тканях. Эффект наступает после продолжительного латентного периода (от нескольких часов, до суток). Практически значимыми являются проблемы, связанные с хроническим отравлением этими гормонами или их синтетическими аналогами. 2. Гормоны, регулирующие содержание вторичных месенджеров (цАМФ, цГМФ, диацилглицерол, фосфоинозитиды и др.) в клетках. К числу гормонов, действующих подобным образом относятся катехоламины, окситоцин, вазопрессин, инсулин, глюкогон, паратгормон и другие. Аналогичным образом действуют такие биологически активные вещества, как простогландины, серотонин, гистамин, ангиотензин и др. Эти гормоны взаимодействуют с соответствующими рецепторами, локализующимися на клеточной поверхности, что и приводит к изменению содержания в клетках регуляторов клеточной активности (см. выше). Распределение этих рецепторов в тканях определяет характер действия на них гормонов. Гормоны, относящиеся к этой группе, действуют быстро. Латентный период продолжается несколько минут. Эффект не блокируется ингибиторами синтеза белка, но усиливается некоторыми веществами, например ингибиторами фосфодиэстераз (энзимы, активирующие процесс разрушения циклических нуклеотидов в клетках). Возможно острое отравление гормонами данной группы или их синтетическими аналогами. Например, в эксперименте острое отравление инсулином (острую гипогликемию) можно вызвать у крыс, предварительно
голодавших |
в |
течение |
нескольких |
суток. |
3. |
Механизмы |
нервной |
|
регуляции |
Высший уровень регуляции функционального состояния клеток, органов, систем появляется с формированием у живых организмов нервной системы. Структурной единицей нервной системы является нервная клетка (нейрон), осуществляющая контакт, как с большим количеством других нейронов, так и клетками периферических органов. Мозг человека, по некоторым данным состоит из 1010 нейронов, каждый из которых имеет около 104 контактов с другими клетками. Под контролем нервной системы находятся все органы и системы организма. Так как скорость передачи сигнала по нервным волокнам велика, то и эффект реализуется с минимальным латентным периодом. Это свойство нервной системы чрезвычайно важно, поскольку позволяет организму быстро реагировать на изменяющиеся условия окружающей среды, используя органы чувств, управляя двигательной активностью, регулируя состояние внутренних органов. Между собой и с периферическими структурами нервные клетки связаны нервными волокнами. Передача информации по волокнам осуществляется с помощью электрического и химического механизмов. Распространение сигнала по волокну имеет электрическую природу. Область контакта между окончанием нервного волокна и иннервируемой клеткой называется синапсом. Нервный импульс, достигнув нервного окончания (пресинаптические структуры), вызывает высвобождение химического вещества (нейромедиатора), которое, диффундируя через пространство, отделяющее нервное окончание от поверхности иннервируемой клетки (синаптическая щель), действует на селективные рецепторы (постсинаптические) и вызывает их возбуждение. Возбуждение рецептора приводит к изменению потенциала постсинаптической мембраны. Таким образом, инициируется ответная реакция клетки, находящейся под контролем нейрона. Выделившийся в синаптическую щель нейромедиатор взаимодействует с постсинаптическими рецепторами, подвергается энзиматическому расщеплению либо обратному захвату пресинаптическими структурами. Часть высвободившегося нейромедиатора взаимодействует с пресинаптическими рецепторами, возбуждая их, и по механизму обратной связи прерывает дальнейший выброс и активирует обратный захват. Для передачи нервного импульса в синапсах в качестве медиаторов различные нейроны используют различные химические вещества. Нейромедиаторы синтезируются в пресинаптических структурах и находятся здесь в связанной форме, главным образом в

специальных клеточных органелах, так называемых синаптических везикулах. В каждой везикуле, в среднем, содержится до 104 молекул нейромедиатора. В настоящее время в ЦНС и на периферии идентифицировано более 17 типов регуляторных систем (классификация по строению нейромедиатора), на которые оказывают влияние, в том числе, и токсиканты: холинергическая (мускариночувствительная - 4 подтипа, никотиночувствительная - 2 подтипа), адренергическая (9 подтипов), дофаминергическая (5 подтипов), серотонинергическая (5 подтипов), ГАМК-ергическая (2 подтипа), глутаматергическая (4 подтипа), глицинергическая (1 подтип), гистаминергическая (3 подтипа), опиоидная (4 подтипа), пуринергическая (6 подтипов), пептидергическая (более 5 типов) и т.д. Помимо "классических" медиаторов нервного импульса в нервной ткани определяются другие вещества, как правило пептидной природы, модулирующие эффекты нейромедиаторов на синаптические рецепторы. В настоящее время таких нейромодуляторов в ЦНС млекопитающих идентифицировано более 60 (таблица 1). Помимо ЦНС эти вещества определяются и в других органах (сосуды, желудочно-кишечный тракт и др.). Некоторые из них одновременно являются
гормонами |
(см. |
|
|
|
|
|
выше). |
|
Таблица 1. Некоторые пептидные модуляторы нервной системы млекопитающих |
|
|||||||
|
Рилизинг-гормоны |
|
|
(РГ) |
|
гипоталамуса |
||
|
- тиреотропин-РГ - гонадотропин-РГ |
|
||||||
|
- соматотропин-РГ - кортикотропин-РГ |
|
||||||
|
Гормоны |
|
|
|
|
нейрогипофиза |
||
|
- вазопрессин - окситоцин |
|
|
|
||||
|
- нейрофизин |
|
|
|
|
|
|
|
|
Пептиды |
|
|
|
|
гипофиза |
||
|
- |
АКТГ |
|
- |
|
пролактин |
||
|
- лютеинизирующий гормон - соматотропин |
|||||||
|
- |
-меланотропин - |
|
-эндорфин |
|
|||
|
|
|
||||||
|
|
|
||||||
|
- тиреотропин - глицил-глутамин |
|
||||||
|
Гастро-интестинальные |
|
пептиды |
|||||
|
- |
гастрин |
- |
|
субстанция |
Р |
||
|
- |
нейротензин |
|
- |
|
энкефалины |
||
|
- |
инсулин |
|
- |
|
глюкагон |
||
|
- секретин - бомбезин |
|
|
|
||||
|
- соматостатин - мотилин |
|
|
|
||||
|
Другие |
|
|
|
|
пептиды |
||
|
- |
ангиотензин |
|
11 |
- |
брадикинин |
||
|
- карнозин - кальцитонин |
|
|
|
||||
- нейропептид Y
В основе действие токсикантов на передачу нервного импульса лежат следующие механизмы
(рис. |
|
|
|
|
|
1): |
|
- |
влияние на синтез, хранение, высвобождение |
и обратный |
захват |
нейромедиатора; |
|||
- |
непосредственное |
действие |
на |
селективные |
рецепторы; |
||
- |
изменение |
сродства |
рецепторных |
|
структур |
к |
нейромедиаторам; |
- |
изменение скорости синтеза, |
разрушения и |
распределения |
рецепторов в тканях; |
|||
- модификация состояния механизмов сопряжения между рецептором и эффекторной системой клеток.

Рисунок 1. Места действия токсикантов на синапс. Схема этапов оборота нейромедиатора,
воздействуя |
на |
которые |
токсикант может |
инициировать |
токсический |
процесс: |
1 |
|
|
- |
|
|
синтез |
2 |
|
|
- |
|
|
хранение |
3 |
|
|
- |
|
метаболизм |
|
4 |
|
|
- |
|
|
выделение |
5 |
|
- |
|
обратный |
|
захват |
6 |
|
|
- |
|
разрушение |
|
7 |
|
|
- |
|
|
рецептор |
8 |
- |
|
механизм |
проведения |
|
сигнала |
4. Особенности |
токсического |
повреждения механизмов регуляции |
клеточной |
активности |
||
В результате токсического действия ксенобиотиков на регуляторные механизмы формируются нарушения восприятия, памяти, мышления, двигательной активности, гемодинамики, дыхания, вегетативных процессов, метаболизма в органах и тканях и др. При этом обращают на себя внимание следующие закономерности:
1.Чем в большей степени токсикант структурно напоминает естественный биорегулятор, тем специфичнее его действие на организм, при этом, в зависимости от свойств, он либо имитирует эффект биорегулятора (агонист), либо блокирует его (антагонист). Таким образом, влияют на синаптические механизмы нервной регуляции многие алкалоиды (атропин, никотин, анабазин, мускарин, скополамин, курарин и т.д.) и огромное количество синтетических ядов.
2.Будучи аналогом биологически активного вещества, токсикант, тем не менее, может оказывать влияние лишь на часть эффектов, контролируемых в организме этим биорегулятором. Лучше всего этот феномен изучен для веществ, действующих на холинэргические синапсы (нейромедиатор - ацетилхолин). С помощью ацетилхолина нервный импульс передается в центральной нервной системе, вегетативных ганглиях, нервномышечных синапсах, нервных окончаниях парасимпатических волокон, иннервирующих гладкомышечные образования и железистую ткань. Однако рецепторы, взаимодействующие с медиатором, в перечисленных структурах имеют существенные особенности и оказываются чувствительными лишь к некоторым токсикантам. Так, алкалоид атропин действует преимущественно на нервные окончания парасимпатических волокон и некоторые виды холинергических синапсов ЦНС. При этом нервно-мышечные и ганглионарные синапсы остаются интактными. Алкалоид никотин, напротив, преимущественно действует на нервно-
мышечные и ганглионарные синапсы. Помимо различий структурно-функциональной организации рецепторов неодинаковое сродство органов и тканей к токсикантам - аналогам биорегуляторов, может быть обусловлено особенностями токсикокинетики ксенобиотиков. 3. Вещества, изменяющие количество нейромедиатора, находящегося в синаптической щели в момент передачи нервного импульса, как правило, обладают высокой токсичностью. Это обусловлено тем обстоятельством, что степень возбуждения постсинаптических рецепторов определяется количеством образующихся комплексов медиатор - рецептор в единицу времени, а, следовательно, зависит от концентрации медиатора в синаптической щели. В основе токсического действия таких веществ лежит нарушение механизмов синтеза нейромедиаторов (гидразин и его производные), их высвобождения (тетанотоксин, ботулотоксин) и разрушения (ФОС, карбаматы).

Действие токсикантов на рецепторы не редко сопровождается существенным изменением
количественных |
и |
качественных |
характеристик |
последних. |
|||
4.1. |
Изменение |
числа |
рецепторов, |
вызываемое |
действием |
ксенобиотиков. |
|
Число селективных рецепторов на клеточной мембране определяется соотношением скоростей процессов их разрушения и синтеза. Период полуобращения известен для очень ограниченного количества рецепторов. В среднем это время для различных рецепторов колеблется от трех суток до нескольких недель. Поскольку рецепторы представляют собой белковые молекулы, их биосинтез ничем не отличается от синтеза других белков. Достаточно подробно, например, изучен процесс синтеза никотинэргического рецептора. После "сборки" полипептидной цепи на соответствующих полисомах белковая молекула встраивается в мембрану шероховатого эндоплазматического ретикулума, а затем с фрагментами этой мембраны переходит в везикулы аппарата Гольджи. Везикулы перемещаются в окончания нервных отростков с цитоплазматическим током, сливаются с клеточной мембраной, а в следствие экзоцитоза, молекула оказывается на поверхности клетки. Время синтеза рецепторной структуры составляет около 150 минут. Некоторые ксенобиотики (особенно при длительном воздействии на организм) в состоянии оказывать влияние на синтез, биодоступность и разрушение тех или иных рецепторов. В итоге изменяются свойства как биорецепторных систем, так и организма в целом, в частности, его
чувствительность |
|
к |
|
|
токсикантам. |
|
4.1.1. |
Уменьшение |
количества |
рецепторов |
при |
воздействии |
токсикантов |
Уменьшение количества рецепторов, как правило, является следствием длительного действия токсиканта - агониста эндогенного лиганда рецептора, либо самого лиганда в несвойственных организму концентрациях. Примерами рецепторов, для которых экспериментально доказана возможность такой реакции, являются рецепторы к ацетилхолину, инсулину, пролактину, а также рецепторы с тирозинкиназной активностью. В данном случае разрушение интернализировавшегося рецептора и его синтез идут параллельно. При хроническом стимулировании структуры развивается постепенное, но стойкое снижение числа рецепторов за счет неспособности процессов синтеза компенсировать усиленный распад рецептора. Указанный эффект имеет особое значение при длительном использовании некоторых лекарств. Так, прием агонистов 
 2-адренорецепторов (изопреналин) лицами, страдающими бронхиальной астмой, со временем приводит к нарушению механизмов нервной регуляции дыхательных путей. Систематический прием психофармакологических препаратов может приводить к нарушению функций ЦНС.
2-адренорецепторов (изопреналин) лицами, страдающими бронхиальной астмой, со временем приводит к нарушению механизмов нервной регуляции дыхательных путей. Систематический прием психофармакологических препаратов может приводить к нарушению функций ЦНС.
4.1.2. Увеличение числа мембраносвязанных рецепторов при воздействии токсикантов
Противоположным, описанному выше, является процесс увеличения числа рецепторов при действии ксенобиотиков. Это может быть следствием длительной блокады рецепторов антагонистом эндогенного лиганда (нейромедиатора, гормона), либо повреждения токсикантом проводящих путей, по которым нервный импульс поступает к клеткам-мишеням. До настоящего времени не ясно, является ли увеличение числа рецепторов следствием угнетения процесса их разрушения или усиления синтеза. Для клеток, способных к дифференциации (клетки иммунной системы), имеет значение индукция экспрессии рецепторов. В этой связи хорошо изученной является модуляция числа рецепторов интерлейкина-2. Количество этих рецепторов может быть оценено как путем определения количества связывающегося клетками вещества, так и с помощью специфических моноклональных антител. В процессе индукции иммунного ответа незрелые Т-лимфоциты стимулируются таким образом, что начинают синтезировать рецепторы интерлейкина и встраивать их в клеточную мембрану. Вследствие этого у клеток и появляется способность взаимодействовать с этими биологически активными веществами, что необходимо для
дальнейшей |
дифференциации |
и |
специализации |
Т-клеток. |
4.2. |
Десенсибилизация |
|
рецепторов |
|
Термин "десенсибилизация" используют в нескольких смыслах. Иногда это понятие применяют для обозначения явления снижения выраженности реакции клеток на токсикант, развивающегося вследствие уменьшения числа рецепторов к нему (см. выше). Более правильно этим термином обозначать явление быстро развивающегося понижения реактивности рецепторно-эффекторного комплекса клеток вследствие действия на него

агониста. То есть, в узком смысле слова, десенсибилизация - это переход рецептора в новое состояние (иную конформацию) после его взаимодействия с агонистом, при котором продолжение действия вещества не приводит к дополнительной активации эффекторной системы. Рецептор, находящийся в этой конформации переходит в неактивное состояние. Этот феномен в эксперименте выявляется при действии на биологический объект различных ксенобиотиков в возрастающей концентрации. Каково значение явления десенсибилизации в обычных физиологических условиях остаётся не ясным. Между тем известно, что в нормальных условиях в активном состоянии находится лишь малая часть рецепторов к эндогенным лигандам.
РАЗДЕЛ 3. ТОКСИКОМЕТРИЯ
ГЛАВА 3.1. ЗАВИСИМОСТЬ "ДОЗА-ЭФФЕКТ" В ТОКСИКОЛОГИИ
1. Общие замечания
Спектр проявлений токсического процесса, определяются строением токсиканта. Однако выраженность развивающегося эффекта является функцией количества действующего агента. Для обозначения количества вещества, действующего на биологический объект, используют понятие - доза. Например, введение в желудок крысе весом 250 г и кролику весом 2000 г токсиканта в количестве 500 мг, означает, что животным введены дозы равные соответственно 2 и 0,25 мг/кг (более подробно понятие "доза" будет рассмотрено ниже).
Зависимость "доза-эффект" может быть прослежена на всех уровнях организации живой материи: от молекулярного до популяционного. При этом в подавляющем большинстве случаев будет регистрироваться общая закономерность: с увеличением дозы - увеличивается степень повреждения системы; в процесс вовлекается все большее число составляющих её элементов.
В зависимости от действующей дозы практически всякое вещество в определенных условиях может оказаться вредным для организма. Это справедливо для токсикантов, действующих как местно (таблица 1), так и после резорбции во внутренние среды (таблица 2).
Таблица 1. Зависимость между концентрацией формальдегида во вдыхаемом воздухе и выраженностью токсического процесса
|
Концентрация |
Клинические проявления |
|
|||
|
|
|||||
|
(см3/м3 - ppm) |
|
|
|
||
|
0,01 |
- 0,05 |
Раздражение глаз |
|
|
|
|
0,05 |
- 1,00 |
Непереносимый запах |
|
|
|
|
0,05 |
- 3,00 |
Раздражение верхних дыхательных путей |
|
||
|
3,00 |
- 10,00 |
Сильное раздражение слизистой дыхательных путей |
|||
|
10,00 |
- 30,00 |
Раздражение глубоких дыхательных путей |
|
||
|
50,00 |
- 100,00 |
Воспалительный процесс в легких; токсический отек |
|||
(P.M. |
Misiak, |
|
J.N. |
Miceli, |
1986) |
|
Таблица 2. Зависимость между концентрацией этанола в крови и выраженностью токсического процесса
Концентрация |
Клинические проявления |
мг/100 мл |
Изменение настроения; прогрессирующее нарушение координации |
20 - 99 |
|
|
движений, сенсорных функций; изменение поведения |
100 - 199 |
Выраженные нарушения мышления; увеличение времени реакции на |
|
внешние раздражители; атаксия |
200 - 299 |
Тошнота; рвота; выраженная атаксия |
300 - 399 |
Гипотермия; дизартрия; амнезия; 1 стадия анестезии |
400 - 700 |
Кома; угнетение дыхания; смерть |
