
Основы токсикологии
.pdf(T.G. Tong, D. Pharm, 1982)
На проявление зависимости "доза-эффект" оказывает существенное влияние внутри- и межвидовая изменчивость организмов. Действительно, особи, относящиеся к одному и тому же виду, существенно отличаются друг от друга по биохимическим, физиологическим, морфологическим характеристикам. Эти отличия в большинстве случаев обусловлены их генетическими особенностями. Еще более выражены, в силу тех же генетических особенностей, межвидовые различия. В этой связи дозы конкретного вещества, в которых оно вызывает повреждение организмов одного и того же и, тем более, разных видов, порой очень существенно различаются. Следовательно, зависимость "доза-эффект" отражает свойства не только токсиканта, но и организма, на который он действует. На практике это означает, что количественную оценку токсичности, основанную на изучении зависимости "доза-эффект", следует проводить в эксперименте на различных биологических объектах, и обязательно
прибегать |
к |
статистическим |
методам |
обработки |
получаемых |
|
данных. |
||
2. |
Зависимость |
"доза-эффект" |
на |
уровне |
отдельных |
клеток |
и |
органов |
|
2.1. |
|
|
Предварительные |
|
|
|
замечания |
||
Самым простым объектом, необходимым для регистрации биологического действия токсиканта, является клетка. При изучении механизмов токсического действия это положение не редко опускают, концентрируя внимание на оценке характеристик взаимодействии химического вещества с молекулами-мишенями (см. выше). Такой упрощенческий подход, оправданный на начальных этапах работы, совершенно не допустим при переходе к изучению основной закономерности токсикологии - зависимости "доза-эффект". На этом этапе необходимо изучить количественные и качественные характеристики реакции всего эффекторного аппарата биообъекта на возрастающие дозы токсиканта, и сопоставить их с
закономерностями |
действия |
ксенобиотика |
на |
молекулярном |
уровне. |
2.2. |
|
Основные |
|
|
понятия |
Рецепторная концепция действия токсикантов на клетку или орган предполагает, что в его основе лежит реакция вещества с определенной биологической структурой - рецептором (см. раздел "Механизм действия"). Наиболее глубоко эти представления развивались в ходе исследований на моделях взаимодействия ксенобиотиков с селективными рецепторами эндогенных биорегуляторов (нейромедиаторов, гормонов и др.). Именно в такого рода опытах установлены базовые закономерности, лежащие в основе зависимости "доза - эффект". Общепризнанно, что процесс образования комплекса вещества с рецептором подчиняется закону действующих масс. Однако гипотетичными до настоящего времени остаются представления, позволяющие связать количественные и качественные характеристики этой первичной реакции и выраженность эффекта со стороны целостной биологической системы. Для преодоления возникающих сложностей принято выделять две токсикометрические
характеристики |
ксенобиотика: |
1. Афинность - отражает степень сродства токсиканта |
к рецептору данного типа; |
2. Эффективность - характеризует способность веществ вызывать определенный эффект после взаимодействия с рецептором. При этом ксенобиотики, имитирующие действие эндогенного биорегулятора, называются его агонистами. Вещества, блокирующие действие
агонистов, |
называются |
антагонистами. |
2.3. |
|
Афинность |
Измерение афинности токсиканта к рецептору, по сути, представляет собой экспериментальное изучение зависимости между количеством вещества, добавляемого в инкубационную среду, и количеством образующегося в результате взаимодействия токсикантрецепторного комплекса. Обычный методический прием - радиолигандные исследования (см. выше).
При использовании закона действующих масс для определения афинности необходимо учитывать, что исследователю известны количественные характеристики содержания в среде только одного из участников процесса - токсиканта [P]. Количество рецепторов [R]T, участвующих в реакции, всегда не известно. Существуют методические приемы и допущения, позволяющие в ходе эксперимента и на этапе анализа обработки полученных результатов преодолеть эту сложность.

2.3.1. Описание взаимодействия "токсикант-рецептор" в соответствии с законом действующих масс
В простейшем случае для описания процесса образования комплекса вещества и рецептора применяют кинетические характеристики реакции второго порядка.
В |
|
|
|
|
|
|
соответствии |
с |
|
законом |
действующих |
масс: |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
KD - константа диссоциации комплекса "токсикант-рецептор". 1/KD - константа ассоциативного процесса, является мерой сродства токсиканта к рецептору. Поскольку общее количество рецепторов в изучаемой системе (культура клеток, изолированный орган и т.д.) есть сумма свободных [R] и вступивших во взаимодействие с веществом [RP] рецепторов, то:
[R]T = [RP] + [R] (3)
С учетом уравнений (2) и (3), имеем
[RP]/[R]T = y = [P]/([P] + KD) (4)
Степень насыщения рецептора токсикантом "у" есть отношение связавшегося с веществом рецептора к общему количеству рецепторов. Поскольку количество образовавшегося комплекса [RP] может быть определено экспериментально появляется возможность рассчитать значение КD в соответствии с уравнением (4). В графическом представлении зависимость насыщения рецептора от концентрации токсиканта в среде имеет вид гиперболы, что также может быть использовано для определения значения константы диссоциации.
2.3.2. |
Более |
сложные |
модели |
взаимодействия |
"токсикант-рецептор" |
Экспериментально получаемые кривые связывания токсиканта на рецепторах не редко более крутые или более пологие, чем следует ожидать, исходя из закона действующих масс. Иногда выявляются кривые со сложной зависимостью степени насыщения рецептора токсикантом от его концентрации. Эти отклонения обычно объясняют тремя обстоятельствами: 1. Реакция между веществом и рецептором не является бимолекулярной. В этом случае требуется иная форма задания зависимости, чем представленная уравнением (4):
y = [P]n/([P]n + KD) (5)
где n (константа Хила) - формально отражает число молекул токсиканта, принимающих участие в образовании одного комплекса "токсикант-рецептор". 2. Популяция рецептора, с которым взаимодействует токсикант, гетерогенна. Так, если в биологическом объекте в равных количествах содержатся два подтипа рецептора, различающихся в 3 раза величиной константы ассоциации комплекса "токсикант-рецептор", то суммарное значение константы Хила, исследуемой зависимости будет равно 0,94. При больших различиях значений констант ассоциации интегральная её величина в ещё большей степени будет отличаться от 1,0. 3. Определенное влияние на процесс образования комплекса "токсикант-рецептор" оказывают такие явления, как изменение конформации рецептора, кооперативности его отдельных

субъединиц, различные аллостерические эффекты. Так, нередко кривая связывания токсиканта с рецептором имеет S-образный вид. Это свидетельствует о взаимном влиянии соседних участков связывания токсиканта с макромолекулой (например, образование комплекса с одной субъединицей рецептора приводит к изменению его сродства к другим, свободным субъединицам). Подобный эффект наблюдается при изучении связывания ацетилхолина препаратом тканевых мембран, содержащих холинорецептор. Увеличение концентрации свободного [3Н]-ацетилхолина в инкубационной среде сопровождается возрастанием афинности вещества к рецепторным протеинам (рисунок 1). Местный анестетик прилокаин при добавлении в инкубационную среду нарушает явление кооперативности рецепторов и, тем самым, ограничивает увеличение сродства к ним ацетилхолина. Об этом свидетельствует изменение формы кривой зависимости "связывание - концентрация токсиканта" и превращение её из S-образной в обычную гиперболическую.
Рисунок 1. Влияние прилокаина на процесс связывания ацетилхолина с холинорацептором
(J.B. |
Cohen |
et |
al., |
1974) |
2.4. |
|
|
|
Эффективность |
В многочисленных опытах показано, что между способностью вещества образовывать комплекс с рецептором определенного вида и выраженностью формирующегося при этом биологического эффекта (например, сокращение гладкомышечных волокон стенки кишечника, изменение сердечного ритма, выделение секрета железой и т.д.) далеко не всегда прослеживается прямая зависимость. Для описания результатов экспериментальных исследований, в которых эта зависимость изучалась, предложен ряд теорий. Как указывалось ранее, все токсиканты, взаимодействующие с рецептором условно могут быть подразделены на агонисты и антагонисты. В этой связи ниже, при обозначении концентрации токсиканта в среде, будут использоваться соответственно символы: [А] - концентрация
агониста; |
[В] |
- |
концентрация |
антагониста. |
2.4.1. |
|
Оккупационные |
|
теории |
Самая первая из предложенных теорий принадлежала Кларку (1926), который предположил, что выраженность наблюдаемого эффекта линейно связана с количеством рецепторов,
оккупированных |
|
токсикантом |
|
([RP]/[R]). |
||
Как |
|
следует |
|
из |
уравнения |
(4) |
[RA]/[R]T = [A]/([A] + KA) = EA/EM (6) |
|
|
|
|
||
где |
ЕА - |
выраженность эффекта |
от |
действия агониста в примененной концентрации; |
||
ЕМ - максимально возможный эффект |
со стороны исследуемой биологической системы; |
|||||
КА |
- |
константа |
диссоциации |
комплекса |
"агонист-рецептор". |
|
Согласно теории Кларка 50% выраженности эффект развивается при такой дозе агониста, при которой оккупировано 50% рецепторов ([А]50). Эта доза вещества называется
среднеэффективной |
(ЕД50). |
Аналогично, в соответствии с законом действия масс, с рецептором взаимодействует и антагонист, не вызывая при этом эффекта

КВ = [В][R]/[ВR] (8) |
|
|
|
|
||
где |
КВ |
- |
константа |
диссоциации |
комплекса |
"рецептор-антагонист". |
Если агонист и антагонист действуют на рецептор одновременно, то, естественно, количество рецепторов, способных связаться с агонистом понижается. Общее количество рецепторов в
биообъекте |
может |
быть |
обозначено |
как |
[R]T = [R] + [RA] + [RB] (9) |
|
|
|
|
В соответствии с рассматриваемой теорией токсикант может быть либо агонистом, либо антагонистом. Однако результаты многочисленных исследований указывают на то, что подобная классификация веществ оказывается недостаточной для описания наблюдаемых эффектов. Так установлено, что максимальный эффект, вызываемый различными агонистами, действующими на одну и туже рецепторную систему, не одинаков. Для преодоления этого противоречия Стефенсоном (1956) были предложены три допущения: - максимальный эффект может быть вызван агонистом даже в том случае, если оккупирована
лишь |
незначительная |
часть |
рецепторов; |
- развивающийся |
эффект не линейно |
связан с количеством |
оккупированных рецепторов; |
- токсиканты обладают неодинаковой эффективностью (относительной возбуждающей активностью), т.е. способностью вызывать эффект, взаимодействуя с рецептором. Следовательно, вещества с различной эффективностью для того, чтобы вызвать одинаковый по выраженности эффект, должны оккупировать различное количество рецепторов. В соответствии с этими представлениями сила эффекта зависит не только от числа занятых рецепторов, но и от величины некоего стимула "S", формирующегося при образовании
комплекса |
|
|
|
|
|
"токсикант-рецептор": |
|
ЕА/ЕМ |
= |
(S) |
= |
(e[RA]/[R]T) |
= |
(eyA) |
(10) |
где е - безразмерная величина, характеризующая эффективность агониста. По Стефенсону - это мера способности токсиканта вызывать эффект, при образовании комплекса с рецептором. Количественно Стефенсон определил е = 1, при условии, что максимальный эффект от действия вещества на биосистему составляет 50% от теоретически возможной ответной реакции этой биосистемы на возбуждающий стимул. Фурхготт (1964) предположил, что значение "е" прямо зависит от общей концентрации рецепторов в биологической системе [R]Т, и ввел дополнительное понятие "внутренняя эффективность" вещества (  ), величина которой обратно пропорциональна концентрации
), величина которой обратно пропорциональна концентрации
рецепторов |
|
|
в |
|
|
|
|
системе |
|||
|
|
= |
|
|
е/[R]Т |
|
|
|
|
|
(11) |
|
|
|
|
|
|
|
|
||||
Как |
следует |
|
из |
|
|
|
уравнения |
|
(10) |
||
ЕА/ЕМ |
= |
|
|
( |
|
[R]ТуА) |
|
(12) |
|||
|
|
|
|
||||||||
Подстановка |
выражения |
(6) |
в |
уравнение |
(12) |
приводит |
к |
||||
ЕА/ЕМ |
= |
(е[А]/([А] |
+ |
|
К)) |
(13) |
|||||
Если концентрация готовых к взаимодействию с агонистом рецепторов уменьшается в q раз (при необратимой блокаде рецепторов антагонистом), то реальная эффективность изучаемого вещества становится равной qе, тогда уравнение (13) принимает вид
ЕА*/ЕМ* |
= |
(qe[A*]/([A*] |
+ |
K)) |
|
(14) |
Данная |
закономерность |
графически |
представлена |
на |
рисунке |
2. |
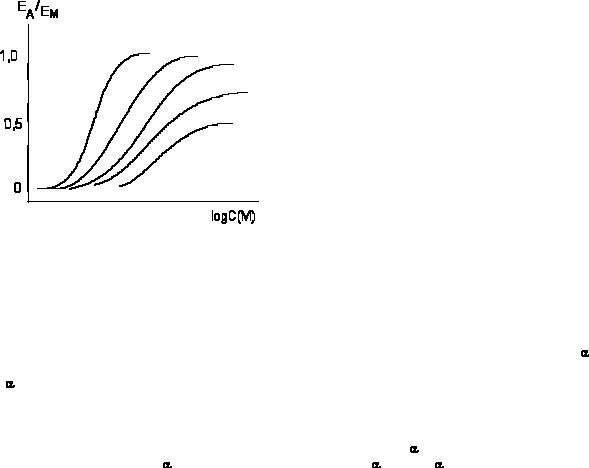
Рисунок 2. Действие гистамина на препарат тонкой кишки морской свинки в условиях возрастающей блокады рецепторов дибенамином (ЕД50 = 0,24мкМ; КА = 10мкМ; е = 21) (R.F.
Furchgott, |
1966) |
Еще одна концепция, позволяющая описать зависимость между действующей концентрацией вещества и выраженностью развивающегося эффекта, предложена Ариенсом (1954). Автор предлагает характеризовать исследуемое вещество величиной, обозначаемой как "внутренняя
активность" |
( Е) |
( Е) = ЕА.MAX/EM (15) |
|
Поскольку теоретически возможный максимальный эффект можно определить в эксперименте
лишь при использовании сильного агониста, обычно значение |
Е для большинства веществ |
лежит в интервале 0< Е <1. Для полного агониста Е = |
1, Е антагониста равна 0. |
Таким образом, максимально возможный биологический эффект может развиться при оккупации токсикантом части рецепторов. В этом случае необратимое связывание некоторого количества рецепторов должно приводить лишь к смещению кривой "доза-эффект" вправо, без снижения величины максимального эффекта. Только при переходе определенной границы связывания рецепторов с антагонистом начинает снижаться и величина максимального эффекта.
Обычно в ходе исследований зависимости "доза-эффект" с позиций оккупационных теорий для характеристики токсикантов определяют следующие параметры: 1. КА - константу ассоциации комплекса "агонист-рецептор" (рКА = -lgКА). Так как значение этой величины часто оценивают непрямым методом (т.е не по количеству образовавшегося комплекса "токсикант-рецептор", а по величине развившегося эффекта при добавлении в среду определенного количества токсиканта) на основании концепции "стимулов", лучше говорить о "кажущейся" константе ассоциации. 2. ЕС50 или ЕД50 - такие концентрации или дозы токсиканта, при действии которых формируется ответная реакция биологического объекта равная по интенсивности 50% от
максимально возможной (рД2 = -lgЕД50). 3. КВ - константу диссоциации комплекса "рецептор-антагонист". Сила действия конкурентного
антагониста может быть выражена лишь с помощью одного параметра - сродства к рецептору. Этот параметр оценивается при обязательном внесении в инкубационную среду агониста.
2.4.2. Теория "скорости взаимодействия"
Для объяснения данных, выявляемых в процессе изучения зависимости "доза-эффект", которые не могут быть поняты с позиций оккупационной теории, Пэтоном (1961) была предложена теория "скорости взаимодействия". Пэтон предположил, что выраженность ответной реакции биологической системы на действие вещества определяется не только числом оккупированных им рецепторов, но и скоростью, с которой вещество вступает во взаимодействие с рецептором, а затем отсоединяется от него. Автором было использовано такое сравнение: рецептор, это не клавиша органа, на которую чем дольше нажимаешь, тем дольше извлекаешь звук, но это клавиша фортепиано - здесь звук извлекается в момент удара, а затем, даже если долго держишь клавишу нажатой, звук все равно затухает.

В соответствии с теорией Пэтона, сильные агонисты - это вещества, быстро оккупирующие и быстро покидающие рецептор; антагонисты - это вещества, на долго связывающие рецептор.
2.4.3. |
Теории |
конформационных |
изменений |
рецептора |
Для многих веществ кривая "доза-эффект" существенно отклоняется от гиперболической функциональной зависимости. Коэффициент Хила для этих кривых не равен 1 (см. выше). Как уже указывалось, эти особенности, а также S-образный характер кривых "доза-эффект" иногда может быть объяснен явлением кооперативного взаимодействия рецепторных белков. Показано также, что многочисленные химические модификаторы рецепторов (например дитиотреитол - восстановитель сульфгидрильных групп), необратимые блокаторы холинорецепторов (например 

 -галогеналкиламины), другие антихолинергические препараты (атропин), конкурентные миорелаксанты, местные анестетики и многие другие вещества, изменяют вид кривой "доза-эффект" для агонистов, превращая её из S-образной в гиперболическую.
-галогеналкиламины), другие антихолинергические препараты (атропин), конкурентные миорелаксанты, местные анестетики и многие другие вещества, изменяют вид кривой "доза-эффект" для агонистов, превращая её из S-образной в гиперболическую.
Для объяснения этих и других феноменов, трудно интерпретируемых с позиций оккупационных теорий (сенсибилизация и десенсибилизация рецепторов при действии агонистов), Катцем и Теслефом еще в 1957 году, на примере изучения действия миорелаксантов, была выдвинута циклическая (конформационная) модель взаимодействия токсиканта с рецептором. В основе модели лежит представление, согласно которому как рецептор [R], так и комплекс "токсикант-рецептор" [RP] могут находиться в активном (RA, RPA) и неактивном состоянии (RI, RPI). Схематически это представлено на рисунке 3.
Рисунок 3. Схема взаимодействия токсиканта с рецептором в соответствии с моделью Катца - Теслефа.
Эта модель позволяет объяснить действие на рецептор агонистов и конкурентных антагонистов.
Агонист, например ацетилхолин, взаимодействует с RA, поскольку имеет более высокое сродство к RA, чем к RI , при этом образуется комплекс RPA. Равновесие между RPA и RPI сдвинуто в сторону RPA, так как RI имеет низкое сродство к агонисту, а комплекс RPI диссоциирует с образованием свободного RI. Развитие эффекта формируется на этапе конформационного превращения RPA в RPI. Интенсивность стимула, возникающего в биологической системе, зависит от количества таких превращений в единицу времени. Конкурентные антагонисты, например d-тубокурарин, имеют большее сродство к RA и снижают эффект агониста, выключая часть рецепторов из процесса взаимодействия с последним. Основываясь на этой модели, практически не возможно экспериментально определить значение соответствующих констант превращений или внутреннюю активность агонистов. Поэтому до настоящего времени в эксперименте по-прежнему широко используют
оккупационные |
|
|
|
модели. |
|
3. |
Зависимость |
"доза-эффект" |
на |
уровне |
организма |

3.1. Предварительные замечания
Биологическими системами, в отношении которых в токсикологии изучается зависимость "дозаэффект" являются ткани, органы, целостный организм. Чувствительность различных органов и систем организма к токсиканту не одинакова. Вот почему этот этап исследований необходим для развернутой характеристики токсичности исследуемого вещества. Изучение изолированных органов в искусственных условиях, моделирующих естественную среду, имеют большое значение для выяснения механизмов взаимодействия токсиканта и организма. Описанные выше теории рецепторного действия токсикантов сформулированы, в основном, на основе данных, полученных в опытах именно на изолированных органах. Не удивительно, что и в настоящее время исследования на этих объектах занимают важное место
в |
|
токсикологии. |
3.2. |
Кривая |
"доза-эффект" |
В общем виде можно предположить, что кривая "доза-эффект" агониста в полулогарифмических координатах (логарифм дозы - выраженность эффекта) принимает S- образную форму не зависимо от целого ряда качественных и количественных особенностей оцениваемой функции. Метод, с помощью которого изучается зависимость, то ли постепенное добавление токсиканта в инкубат, то ли однократное действие вещества на биообъект в возрастающих концентрациях, не оказывают существенного влияния на результат, если эффект не оценивается в абсолютных значениях, а выражается в процентах от максимально возможного (100%). Применение относительных величин целесообразно хотя бы потому, что любой биологический препарат, при самом тщательном приготовлении, уникален во всех своих свойствах, в том числе и по чувствительности к химическим веществам. Кроме того, в ходе эксперимента реакционная способность препарата падает. Эти обстоятельства и предполагают обязательную стандартизацию объекта перед исследованием. Графическое представление кривой "доза-эффект" токсиканта Р в сравнении с кривой для некоего стандартного вещества дает всю необходимую информацию о действии Р, включая его токсикометрические характеристики. Поскольку непосредственное сравнение кривых, получаемых в ходе эксперимента,
осуществлять технически сложно, чаще |
сравнивают важнейшие параметры кривых. |
||
3.2.1. |
Среднеэффективная |
доза |
(ЕД50) |
Основным параметром зависимости "доза-эффект" для определенного токсиканта и биологического объекта является величина среднеэффективной дозы (ЕД50), т.е. такая доза вещества, при действии которой на объект развивается эффект, равный 50% от максимально возможного. При работе на изолированных органах обычно используют величину ЕС50 (среднеэффективная концентрация вещества в пробе). Эффективные дозы обычно измеряют в единицах массы токсиканта на единицу массы биологического объекта (например, мг/кг); эффективные концентрации - в единицах массы токсиканта на единицу объема используемой среды (например, г/литр; М/литр). Вместо величины ЕД50 иногда используют её отрицательный логарифм: -log ED50 = pD2 (таблица 3).
Таблица 3. Величины рД2 для некоторых токсикантов, полученных в эксперименте на изолированном органе (оцениваемый эффект - сокращение мышечных волокон препарата) (J.M. Van Rossumm, 1966)
Вещество |
Изолированный орган |
рД2 |
||
ацетилхолин |
кишка |
|
крысы |
6,5 |
ареколин |
- |
,, |
- |
6,3 |
пилокарпин |
- ,, - |
|
|
4,8 |
3.2.2. Относительная активность
Другим параметром зависимости "доза-эффект" является относительная активность токсиканта, величина, определяемая как отношение эффекта, вызываемого токсикантом в данной дозе, к максимально возможному эффекту, развивающемуся при действии на биосистему. Это характеристика определяется, как указывалось выше, величиной внутренней активности вещества ( 
 Е).
Е).

В узком смысле слова это понятие описывает феномен различия свойств агонистов, с учетом четко очерченных представлений о механизме их токсического действия. Однако в настоящее время его не редко трактуют в расширенном смысле, как показатель сравнения активности веществ, обладающих определенными свойствами, без учета механизмов, посредством которых они инициируют наблюдаемый эффект. На рисунке 4 представлены кривые "дозаэффект" серии веществ, различающихся значением величин 
 Е и, соответственно, ЕД50, действующих на парасимпатический отдел вегетативной нервной системы.
Е и, соответственно, ЕД50, действующих на парасимпатический отдел вегетативной нервной системы.
Рисунок 4. Кривые "доза-эффект" серии парасимпатомиметиков (0 < 
 Е < 1,0), полученные на
Е < 1,0), полученные на
препарате |
изолированной тонкой кишки крысы. (J.M. Van Rossumm, 1966) |
|
3.3. |
Биологическая |
изменчивость |
Уже указывалось, что на одном и том же биологическом объекте можно поставить ограниченное количество токсикологических экспериментов (в простейших случаях - ввести животному дозу вещества; добавить в инкубационную среду, содержащую изолированный орган, вещество в возрастающей концентрации и т.д.). Поиск зависимости "доза-эффект" для одного, и тем более, нескольких токсикантов требует постановки множества экспериментов, что предполагает использование большого количества биологических объектов. В этой связи исследователь сталкивается с явлением биологической изменчивости. Даже при тщательном отборе встречаются объекты, как чрезвычайно чувствительные, так и малочувствительные к действию химических веществ, что приводит к известной вариабельности получаемых результатов. Необходимо иметь в виду, что способ учета этого феномена в ходе анализа экспериментальных данных часто оказывает влияние на итоговые значения изучаемых характеристик токсикантов. В основе учета феномена биологической изменчивости лежит метод усреднения полученных данных. При установлении величины ЕД50, оказывается безразличным проведено ли усреднение доз, вызывающих одинаковый эффект на нескольких биообъектах, либо значений эффектов, полученных при действии определенных доз токсиканта (рисунок 5). Если же поставлена задача получить результирующую кривую "доза-эффект", то усреднению подлежат только дозы, вызывающие со стороны биообъекта эффекты определенной выраженности. При ином подходе (усреднение эффектов) наблюдается существенное снижение крутизны итоговой кривой "доза-эффект" в сравнении исходными данными.

Рисунок 5. Построение усредненной кривой доза-эффект с использованием данных, полученных на нескольких биопрепаратах с различной чувствительностью к исследуемому токсиканту. Использование метода усреднения доз, вызывающих одинаковые эффекты (А) дает правильный результат. Метод усреднения эффектов (В) приводит к "уплощенной"
результирующей |
|
|
|
|
кривой. |
|
3.4. |
Совместное |
действие |
нескольких |
токсикантов |
на |
биообъект |
При совместном действии на биообъект агонистов и антагонистов возможны различные модификации зависимости "доза-эффект" (не связанные с различного рода химическими и физико-химическими взаимодействиями ксенобиотиков). Наиболее часто регистрируются такие
изменения |
|
|
|
как: |
|
- |
параллельный |
сдвиг |
кривой |
"доза-эффект"; |
|
- |
снижение |
максимальных |
значений |
кривой |
"доза-эффект"; |
- |
параллельный |
сдвиг с одновременным снижением максимальных значений. |
|||
В настоящее время для объяснения |
наблюдаемых эффектов наиболее часто применяют |
|||
представления |
оккупационной |
теории |
взаимодействия |
"токсикант-рецептор". |
3.4.1. |
Параллельный |
сдвиг |
кривой |
"доза-эффект" |
Главное и наиболее часто используемое объяснение параллельного сдвига кривой "дозаэффект" для вещества (А) при одновременном действии на биопрепарат (внесение в инкубационную среду) вещества (В) с внутренней активностью 
 Е = 0, базируется на допущении, что (В) является конкурентным антагонистом (А). При сравнении на основе оккупационной теории равноэффективных концентраций агониста в отсутствии ([А]) и при добавлении антагониста ([А*]) в определенной концентрации [В], имеем
Е = 0, базируется на допущении, что (В) является конкурентным антагонистом (А). При сравнении на основе оккупационной теории равноэффективных концентраций агониста в отсутствии ([А]) и при добавлении антагониста ([А*]) в определенной концентрации [В], имеем
[А*]/[А] |
= |
1 |
+ |
[В]/КВ |
(16) |
Поскольку координаты, в которых регистрируются эффекты, и наблюдается параллельный сдвиг, полулогарифмические, при логарифмировании обеих частей уравнения (16) имеем
log[A*] - log[A] = log(1 + [B]/KB) = S (17)
или
-logKB = log([A*]/[A] - 1) - log[B] (18)
Из уравнения (17) видно, что величина сдвига кривой (S) зависит только от концентрации [В] и величины константы диссоциации комплекса антагонист-рецептор КВ (рисунок 6). Соотношение между величиной стимула, вызываемого агонистом, и эффектом со стороны биосистемы не играет никакой роли. Часто для характеристики сродства антагониста к рецептору используют

величину рА2 = Из уравнений (16) и (17) следует, что рА2 численно равна отрицательному десятичному
логарифму концентрации конкурентного антагониста, при которой необходимо удвоить содержание в среде агониста чтобы получить эффект, регистрируемый в отсутствии антагониста.
Рисунок 6. Теоретические кривые доза-эффект для агониста при отсутствии (А) и наличии (А*) в инкубационной среде антагониста в определенной концентрации [В]. В приведенном примере сдвиг S равен 1,3 и определяется как S = log[A*] - log[A]. Исходя из того, что S = log(1 + [B]/KD),
КВ |
может |
быть |
определено |
|
экспериментально. |
3.4.2. |
Снижение |
максимальных |
значений |
кривой |
"доза-эффект" |
В ряде случаев при изучении зависимости "доза-эффект" для агониста (А*) в присутствии антагониста выявляется, что максимальный наблюдаемый эффект существенно слабее, чем наблюдавшийся от действия того же вещества в отсутствии антагониста (А). Это снижение максимального эффекта, которое может быть оценено в процентах, с позиции оккупационной теории трактуется следующим образом. Неконкурентный антагонист (В*) реагирует с рецептором (R*) биосистемы, не являющимся рецептором R для агониста (А), при этом образование комплекса [R*B*] приводит к понижению эффективности комплекса [RA] понижается. Это приводит к некоему кажущемуся снижению
внутренней |
активности |
Е |
агониста, |
зависящему |
от |
[В*]. |
|
Снижение максимальных значений кривой "доза-эффект" может быть объяснено и необратимым ингибированием рецептора для агониста конкурентным антагонистом (В). Для количественной характеристики активности неконкурентного антагониста используют величину отрицательного логарифма константы диссоциации комплекса антагонист-рецептор
-logKB* = pD*2
Для расчета этой величины необходимо экспериментально определить максимально возможное снижение эффекта агониста в присутствии насыщающей концентрации антагониста
(ЕАВ*М). |
|
|
|
|
|
|
|
|
|
|
Тогда |
pD*2 |
= |
-log[B*] |
- |
log[(ЕАВ*М |
- |
ЕА)/(ЕАВ* |
- |
ЕА) |
- |
1] |
(21) |
С учетом (21) рD2 можно рассматривать как отрицательный логарифм концентрации неконкурентного антагониста, при которой эффект агониста снижается на половину максимально достижимого уровня. В этом случае (ЕАВ*М - ЕА)/(ЕАВ* - ЕА) = 2. Обычно для упрощения расчетов вместо эффекта ЕА используют максимальные эффекты, развивающиеся
при действии А в разных условиях: ЕАМ, ЕАМВ, ЕАМВМ. Если с помощью неконкурентного антагониста возможно полностью заблокировать эффект
агониста, то величину рD*2 можно рассчитать по более простой формуле
pD*2 |
= |
-log[B*] |
+ |
log(EA/EAB* |
-1) |
(22) |
