
- •Федеральное агентство по образованию
- •«Алтайский государственный технический университет
- •Им. И.И. Ползунова»
- •Растворы
- •Введение
- •1 Теоретическая часть
- •1.1 Классификация растворов
- •1.2 Способы выражения состава растворов
- •1.3 Общие свойства растворов
- •1.4 Электролитическая диссоциация
- •1.5 Диссоциация воды
- •1.6 Растворы сильных электролитов
- •1.7 Произведение растворимости
- •1.8 Гидролиз солей
- •2 Экспериментальная часть
- •2.1 Задание первое
- •2.2 Задание второе
- •2.3 Задание третье
- •2.4 Контрольные вопросы на допуск к лабораторной работе
- •2.5 Примеры решения задач
- •100 Г 60 %-ного р-ра – 60 г соли,
- •90 Г 60 %-ного р-ра – х г соли,
- •100 Г 10 %-ного р-ра – 10 г соли,
- •210 Г 10 %-ного р-ра – y г соли,
- •2.6 Тесты
- •2.7.1 Способы выражения состава растворов
- •2.7.2 Свойства растворов
- •2.7.3 Слабые и сильные электролиты
- •2.7.4 Гидролиз солей
- •Согласно заданному варианту выберите задачи по таблице 2.10 и предоставьте их решение преподавателю.
- •2.8 Контрольные вопросы для защиты работы
- •3 Техника безопасности
- •Приложение а
- •Приложение б
- •Литература
- •Федеральное агентство по образованию
- •«Алтайский государственный технический университет
- •Им. И.И. Ползунова»
- •Растворы
1 Теоретическая часть
1.1 Классификация растворов
Растворы– это гомогенные (однофазные) химические системы переменного состава, образованные двумя или несколькими веществами. Состав растворов можно изменять в определенных пределах без нарушения однородности.
Раствор − это не механическая смесь, поскольку при растворении наблюдаются объемные и энергетические эффекты.
В зависимости от размера растворенных частиц различают следующие типы растворов:
1) истинные растворы размером частиц менее 1 нм;
2) коллоидные растворы размером частиц от 1 до 100 нм;
3) грубодисперсные системы частицы размером частиц более 100 нм.
По агрегатному состоянию растворы бывают:
1) газообразные: газ-газ, газ-твердое вещество (пыль), газ-жидкое вещество (туман);
2) жидкие: жидкость−газ (пена), жидкость−жидкость (эмульсия), жидкость−твердое вещество (суспензия);
3) твердые: твердое вещество−газ (пенопласт), твердое вещество−твердое вещество (металлические сплавы), твердое вещество−жидкость.
Аэрозоляминазывают дым и туман. Жидкие растворы могут быть водные и неводные. Твердым раствором называется кристалл, кристаллическая решетка которого состоит из двух или более компонентов.
Идеальным называется раствор, в котором не происходит химической реакции между компонентами, отсутствуют тепловые и объемные эффекты.
Растворы делятся на растворы электролитов и неэлектролитов. Растворы веществ, которые полностью или частично распадаются на ионы и проводят электрический ток, называются электролитами.
1.2 Способы выражения состава растворов
Для характеристики состава раствора используются следующие способы выражения концентрации.
1) Массовая доля ()– это доля, которую составляет масса растворенного вещества (mв) от массы раствора (mр-ра):
 , (1.1)
, (1.1)
где mв – масса вещества, кг.
mр-ра– масса раствора, кг.
Массовая доля в процентах (%) – это выраженная в процентах доля, которую составляет масса растворённого вещества от массы раствора:

 . (1.2)
. (1.2)
2) Молярная концентрация (СМ) – характеризует количество растворенного вещества (nв) в одном литре раствора:
 моль/л
(1.3)
моль/л
(1.3)
так как
 то
то
 , (1.4)
, (1.4)
где Vр-ра– объем раствора, л;
МВ– молярная масса вещества, кг/моль.
Размерность моль/л сокращенно обозначается большой буквой М.
3) Молярная концентрация эквивалентов
вещества (нормальная концентрация)
( ) характеризует
количество вещества эквивалентов (nэ),
содержащегося в одном литре раствора:
) характеризует
количество вещества эквивалентов (nэ),
содержащегося в одном литре раствора:
 моль/л
(1.5)
моль/л
(1.5)
так
как
 то
то
 ,
(1.6)
,
(1.6)
где fэ– фактор эквивалентности.
Размерность (моль/л) сокращенно обозначается буквой н.
Растворы с концентрацией 0,1 М; 0,1 н; 0,01 М; 0,01 н имеют следующие названия: децимолярный и децинормальный растворы, сантимолярный и сантинормальный растворы, соответственно.
4) Моляльная концентрация (Сm)характеризует количество растворного вещества (nB), содержащегося в 1000 г растворителя (mр-ля):

 , (моль/1000 г) (1.7)
, (моль/1000 г) (1.7)
или

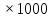 , (моль/1000 г). (1.8)
, (моль/1000 г). (1.8)
5) Титр (Т)характеризует массу вещества, содержащуюся в одном мл раствора:
 г/мл.
(1.9)
г/мл.
(1.9)
6) Мольная доля (х)характеризует долю, которая составляет количество растворенного вещества от суммы количества веществ всех компонентов раствора. Мольная доля – величина безмерная.
 ,
(1.10)
,
(1.10)
где nB– количество молей растворенного вещества;
nр-ля– количество молей растворителя.
7) Объемная доля характеризует долю, которую составляет объем растворенного вещества от объема раствора:
 .
(1.11)
.
(1.11)
