
- •Федеральное агентство по образованию
- •«Алтайский государственный технический университет
- •Им. И.И. Ползунова»
- •Растворы
- •Введение
- •1 Теоретическая часть
- •1.1 Классификация растворов
- •1.2 Способы выражения состава растворов
- •1.3 Общие свойства растворов
- •1.4 Электролитическая диссоциация
- •1.5 Диссоциация воды
- •1.6 Растворы сильных электролитов
- •1.7 Произведение растворимости
- •1.8 Гидролиз солей
- •2 Экспериментальная часть
- •2.1 Задание первое
- •2.2 Задание второе
- •2.3 Задание третье
- •2.4 Контрольные вопросы на допуск к лабораторной работе
- •2.5 Примеры решения задач
- •100 Г 60 %-ного р-ра – 60 г соли,
- •90 Г 60 %-ного р-ра – х г соли,
- •100 Г 10 %-ного р-ра – 10 г соли,
- •210 Г 10 %-ного р-ра – y г соли,
- •2.6 Тесты
- •2.7.1 Способы выражения состава растворов
- •2.7.2 Свойства растворов
- •2.7.3 Слабые и сильные электролиты
- •2.7.4 Гидролиз солей
- •Согласно заданному варианту выберите задачи по таблице 2.10 и предоставьте их решение преподавателю.
- •2.8 Контрольные вопросы для защиты работы
- •3 Техника безопасности
- •Приложение а
- •Приложение б
- •Литература
- •Федеральное агентство по образованию
- •«Алтайский государственный технический университет
- •Им. И.И. Ползунова»
- •Растворы
2.4 Контрольные вопросы на допуск к лабораторной работе
Растворы и их классификация.
Способы выражения состава растворов.
Сильные и слабые электролиты.
Диссоциация воды.
Произведение растворимости.
Гидролиз солей.
Техника безопасности при проведении лабораторной работы.
Методика проведения лабораторной работы.
2.5 Примеры решения задач
Задача 1. Рассчитайте, сколько нужно взять граммов безводной соли K2CrO4 и какой объем воды для приготовления 300 мл 6 % раствора K2CrO4 (6% (K2CrO4) = 1,048 г/см3).
Решение
|
Дано: ωB= 0,06K2CrO4 Vр-ра=300 мл ρр-ра= 1,048 г/см3 ρводы≈ 1 г/см3 Найти: mB Vводы |
Находим массу 300 мл 6 % раствора K2CrO4: mр-ра
=Vр-ра Масса растворенного вещества равна произведению массы раствора на массовую долю растворенного вещества. Находим массу безводной соли K2CrO4: mB =ωB Находим массу воды mводы=mр-ра-mB= 314,4 – 18,86 = 295,54 г Vводы=mводы/ ρводы= 295,45 мл. |
|
Ответ.Масса соли равна 18,86, объем воды 295,45 мл. | |
Задача 2. Определите массу (г) кристаллогидрата сульфата меди составаCuSO4 .5H2Oи объем (мл) воды, необходимые для приготовления 150 мл 10 %-ного раствора при комнатной температуре (р-ра = 1,11 г/см3).
Если для приготовления раствора используют не безводное вещество, а его кристаллогидрат В .nH2O, то следует учитывать при расчетах воду, которая входит в состав кристаллогидрата (кр). Массу кристаллогидратаmкропределяют по формуле
mкр=mB·М кр/МB, (2.3)
где Мкр– молярная масса кристаллогидрата;
mB− расчетная масса вещества в растворе заданного состава.
Определение массы воды mводы, которую необходимо добавить к рассчитанной массе кристаллогидрата для получения раствора заданного состава с массойm(р), проводят по формулеmводы=m(р)-mкр.
Решение
|
Дано: Vр-ра= 150 мл ω(CuSO4) = 0,1 Мкр= 250 г/моль М(CuSO4) = 160 г/моль ρр-ра= 1,11 г/см3 ρводы≈ 1 г/см3 Найти: m кр Vводы |
Находим массу раствора: mр-ра
=Vр-ра Рассчитываем массу кристаллогидрата: mкр=mВ(CuSO4) = ω(CuSO4) = 0,1 Определяем объем воды: Vводы=mводы/ρводы= = (mр-ра-mкр)/ρводы= (166,5 - 26,02) / 1 = = 140,48 мл. |
|
Ответ. Для приготовления раствораCuSO4надо взять 26,02 г кристаллогидрата составаCuSO4. 5H2Oи 140,48 мл воды | |
Задача 3.Определите, какой объем воды при комнатной температуре и какой объем 40 %-ного раствораNaOHс плотностью 1,430 г/см3нужно взять для приготовления 100 мл 10%-ного раствора (р-ра = 1,15 г/см3)..
В
лабораторной практике приходиться
готовить разбавленный раствор с массовой
долей растворенного вещества
 и массойmр-ра2из концентрированного раствора того
же вещества
и массойmр-ра2из концентрированного раствора того
же вещества иmр-ра1разбавлением последнего водой с массойmводы. Тогда все
величины связаны между собой отношением
иmр-ра1разбавлением последнего водой с массойmводы. Тогда все
величины связаны между собой отношением
 mр-ра2=
mр-ра2= (mр-ра1+mводы)
=
(mр-ра1+mводы)
= mр-ра1,
(2.4)
mр-ра1,
(2.4)
так как масса растворенного вещества остается постоянной при разбавлении концентрированного раствора водой и
mр-ра2 =mр-ра1+mводы.
При смешивании раствора с водой масса растворенного вещества не меняется. Это будет ключом к решению.
Решение
|
Дано:
ρр-ра1 = 1,430 г/см3
Vр-ра2=100 мл ρр-ра2 = 1,115 г/см ρводы≈ 1 г/см3 Найти: Vр-ра1 Vводы |
Находим массу раствора, который необходимо приготовить: mр-ра2
=Vр-ра2 Находим содержание в растворе вещества NaOH: m(NaOH)
= Определяем массу 40 %-ного раствора NaOH: mр-ра1=m(NaOH)/ Находим объем 40 %-ного раствора NaOH: Vр-ра1=mр-ра1/ρр-ра1= 27,88/1,430 = 19,50 мл. Находим объем воды: Vводы=mводы/ρводы =(mр-ра2-mр-ра1)/1= 111,5 – 27,88/1 = 83,62 мл. |
Ответ. Для приготовления 100 мл 10 %-ного раствораNaOHнужно взять 19,5 мл 40 %-ного раствора и 83,62 мл воды.
Задача 4. Определите, сколько нужно взять растворов соли 60 %-ной и 10 %-ной концентраций для приготовления 300 г раствора 25 %-й концентрации.
Если обозначить массу первого раствора через m1, а второго – через m2, то при смешивании общая масса смеси будет слагаться из суммы этих масс. Пусть массовая доля растворенного вещества в первом растворе – ω1, во втором – ω2, а в их смеси – ω3. Тогда общая масса растворенного вещества в смеси будет слагаться из масс растворенного вещества в исходных растворах:
m1 ω1
+ m2
ω1
+ m2 ω2
= ω3(m1
+ m2).
(2.5)
ω2
= ω3(m1
+ m2).
(2.5)
Отсюда
m1(ω1 –ω3) = m2(ω3 –ω2),
m1/m2 = (ω3 –ω2)/(ω 1 –ω3).
При решении задач на растворы с разными концентрациями чаще всего применяют диагональную схему правила смешения (Правило креста). При расчетах записывают одну над другой массовые доли растворенного вещества в исходных растворах, справа между ними – его массовую долю в растворе, который нужно приготовить, и вычитают по диагонали из большего меньшее значение. Разности их вычитаний показывают массовые доли для первого и второго растворов, необходимые для приготовления нужного раствора.

Дано:
ω1 = 60 %, ω2 = 10 %, ω3 = 25 %, ω3 = 300 г.
Найти:
m1, m2.
Решение
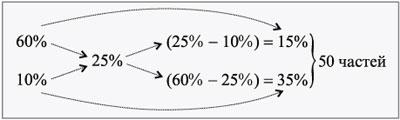
Масса одной части: 300/50 = 6 г.
Тогда
m1
= 6 15
= 90 г, m2
= 6
15
= 90 г, m2
= 6 35
= 210 г.
35
= 210 г.
Проверим правильность решения.

 ρр-ра= 300
ρр-ра= 300 1,048
= 314,4 г
1,048
= 314,4 г mр-ра=
0,06
mр-ра=
0,06 314,4
= 18,86 г
314,4
= 18,86 г ρр-ра=150
ρр-ра=150 1,11 = 166,5 г.
1,11 = 166,5 г. М кр/М(CuSO4)
=
М кр/М(CuSO4)
= mр-ра
mр-ра Мкр/М(CuSO4)
=
Мкр/М(CuSO4)
= 166,5
166,5 250
/ 160 = 26,02 г.
250
/ 160 = 26,02 г. = 0,4
= 0,4  = 0,1
= 0,1 ρр-ра2= 100
ρр-ра2= 100 1,115
= 111,5 г.
1,115
= 111,5 г. mр-ра2
= 0,1
mр-ра2
= 0,1 111,5
= 11,15 г.
111,5
= 11,15 г. =
11,15/0,4 = 27,88 г.
=
11,15/0,4 = 27,88 г.