
- •Методические указания Красноярск 2004
- •Печатается по решению Редакционно-издательского совета университета
- •660074, Красноярск, ул. Киренского, 28
- •Пример 2.
- •Пример 3.
- •Пример 4.
- •Задания
- •Пример 2.
- •Пример 3.
- •Пример 4.
- •Задания
- •Пример 2.
- •Пример 3.
- •Задания
- •Пример 2.
- •Пример 3.
- •Пример 4.
- •Задания
- •Пример 2.
- •Пример 3.
- •Задания
- •Пример 2.
- •Пример 4.
- •Пример 5.
- •Задания
- •Пример 2.
- •Пример 3.
- •Задания
- •Пример 2.
- •Задания
- •Пример 2.
- •Задания
- •Пример 4.
- •Задания
- •Пример 2.
- •Пример 3.
- •Пример 4.
- •Задания
- •Пример 2.
- •Пример 3.
- •Задания
- •Пример 2.
- •Пример 3.
- •Пример 4.
- •Задания
- •Пример 4.
- •Задания
- •Пример 2.
- •Пример 3.
- •Пример 4.
- •Пример 5.
- •Пример 6.
- •Пример 9.
- •Пример 10.
- •Пример 11.
- •Задания
- •Пример 2.
- •Пример 3.
- •Пример 4.
- •Пример 5.
- •Пример 6.
- •Пример 9.
- •Пример 10.
- •Пример 11.
- •Задания
- •Пример 2.
- •Пример 3.
- •Задания
- •Пример 2.
- •Пример 3.
- •Пример 4.
- •Пример 5.
- •Пример 6.
- •Пример 7.
- •Пример 10.
- •Задания
- •Органические соединения. Полимеры
- •Стандартная энергия Гиббса образования
- •Константы диссоциации слабых электролитов
- •Растворимость солей и оснований в воде
- •Ряд стандартных электродных потенциалов металлов
- •Оглавление
Пример 2.
Составьте молекулярные и ионные уравнения гидролиза, происходящего при сливании растворов Cr2(SO4)3 и H2S, зная, что образующийся сульфид хрома не существует в водной среде и полностью гидролизируется.
Решение.
При сливании растворов солей происходит следующая обменная реакция:
Cr2(SO4)3 + 3K2S Cr2S3 + 3K2SO4.
Соль K2SO4 образована сильным основанием KOH и сильной кислотой H2SO4 и гидролизу не подвергается. Соль Cr2S3 образована слабым основанием Cr(OH)3 и слабой кислотой H2S, поэтому гидролиз пойдет по катиону и по аниону до конца.
Краткое ионное уравнение гидролиза соли Cr2S3:
2Cr3+ + 3S2- + 6HOH 2Cr(OH)3 + 3H2S.
Молекулярное уравнение реакции с учетом гидролиза соли:
Cr2(SO4)3 + 3K2S + 6H2O 3K2SO4 + 2Cr(OH)3 + 3H2S.
Задания
201. Составьте ионно-молекулярное и молекулярное уравнения совместного гидролиза, происходящего при смешивании растворов K2S и CrCl3. Каждая из взятых солей гидролизуется необратимо до конца.
202. Какое значение рН (>7, 7 ,<7) имеют растворы солей МпСl2, Na2CO3, Ni(NO3)2? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
203. Какие из солей Al2(SО4)3, K2S, Pb(NO3)2, КС1 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей.
204. При смешивании растворов FeCl3 и Na2CO3, каждая из взятых солей гидролизуется необратимо до конца. Выразите этот совместный гидролиз ионно-молекулярным и молекулярным уравнениями.
205. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей CH3COOK, ZnSO4, AI(NO3)3. Какое значение рН (>7, 7, <7) имеют растворы этих солей?
206. Какое значение рН (>7, 7, <7) имеют растворы солей Li2S, А1Сl3, NiSO4? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
207. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей РЬ(NO3)2, Na2CO3, CoCl2. Какое значение рН (>7, 7, <7) имеют растворы этих солей?
208. Составьте ионно-молекулярное и молекулярное уравнения гидролиза соли, раствор которой имеет: а) щелочную реакцию; б) кислую реакцию. .
209. Какое значение рН (>7, 7, <7) имеют растворы солей Na3PO4, K2S, CuSQ4? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
210. Составьте ионные и молекулярные уравнения гидролиза солей CuCl2, Cs2CO3, ZnCl2. Какое значение рН (>7, 7, <7) имеют растворы этих солей?
211. Какие из солей RbCI, Cr2(SO4)3, Ni(NO3)2 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей.
212. При смешивании растворов CuSO4 и K2CO3 выпадает осадок основной соли (CuOH)2CO3 и выделяется CO2. Составьте ионно-молекулярное и молекулярное уравнения происходящего гидролиза
213. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей K2S, Cs2CO3, NiCl2, РЬ(СН3СОО)2. Какое значение рН (>7, 7, <7) имеют растворы этих солей?
214. При смешивании растворов AI2(SO4)3 и Na2CO3 каждая из взятых солей гидролизуется необратимо до конца. Составьте ионно-молекулярное и молекулярное уравнения происходящего совместного гидролиза.
215. Какие из солей NaBr, Na2S, K2CO3, СоСl2 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей.
216. Какие из солей KNO3, CrCl3, Cu(NО3)2. NаСN подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей.
217. Составьте ионно-молекулярное и молекулярное уравнения совместного гидролиза, происходящего при смешивания растворов Сг(NО3)3 и Na2S? Каждая из взятых солей гидролизуется необратимо до конца.
218 Какое значение рН (>7, 7, <7) имеют растворы следующих солей: К3РO4, Рb(NОз)2, Na2S? Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей.
219. Какие из солей К2СО3, FeCl3, K2SO4, ZnCl2 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей.
220. При смешивании растворов Al2(SO4)3 и Na2S каждая из взятых солей гидролизуется необратимо до конца. Выразите этот совместный гидролиз ионно-молекулярным и молекулярным уравнениями.
КОНТРОЛЬНОЕ ЗАДАНИЕ 2
Окислительно-восстановительные реакции
Пример 1.
Какие из приведенных ниже реакций являются окислительно-восстановительными? Укажите для каждой из них окислитель и восстановитель.
1. Fe + 2HCl = FeCl2 + H2.
2. FeCl2 + 2NaOH = Fe(OH)2 + 2NaCl.
3. Ba(NO3)2 + K2SO4 = BaSO4 + 2KNO3.
4. 2KI + Cl2 = 2KCl + I2.
Решение.
Окислительно-восстановительными называются реакции, протекающие с изменением степеней окисления атомов. Степень окисления – это условный заряд, появляющийся на атоме в результате смещения электронного облака к более электроотрицательному атому. Степень окисления может быть отрицательной, положительной и нулевой.
Окисление – это процесс отдачи электронов, сопровождающийся повышением степени окисления. Атомы, молекулы и ионы, отдающие электроны, называются восстановителями.
Восстановление – процесс присоединения электронов, сопровождающийся понижением степени окисления. Атомы, молекулы и ионы, принимающие электроны, называют окислителями.
Определим степени окисления атомов.
1.
![]() + 2
+ 2![]() Cl
=
Cl
=
![]() Cl2
+
Cl2
+
![]() 2.
2.
Железо и водород меняют степени окисления. Следовательно, данная реакция относится к окислительно-восстановительным:
![]() 2
2![]() =
=
![]() – процесс окисления, железо –
восстановитель.
– процесс окисления, железо –
восстановитель.
2![]() + 2
+ 2![]() =
=
![]() 2
– процесс восстановления, ион водорода
– окислитель.
2
– процесс восстановления, ион водорода
– окислитель.
2.
![]()
![]() 2
+ 2
2
+ 2
![]()
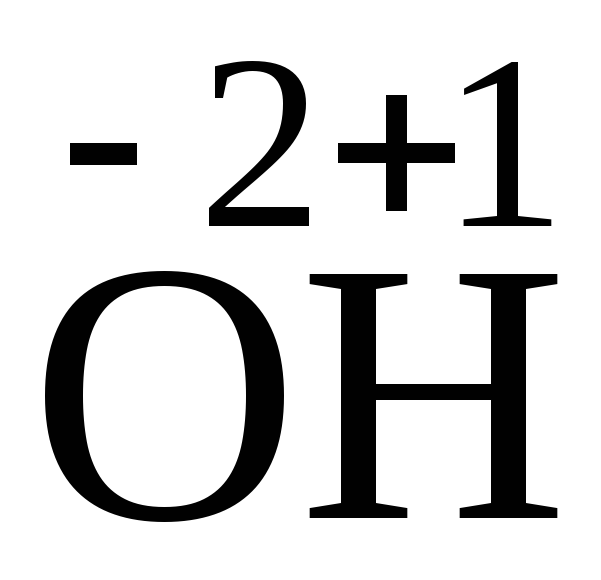 =
=
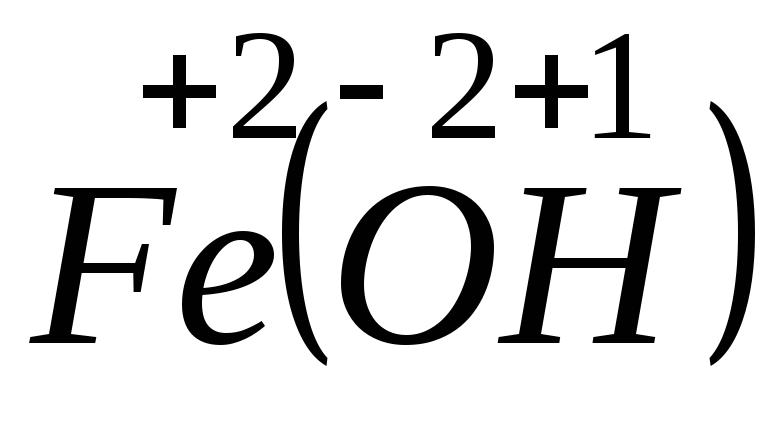 2
+ 2
2
+ 2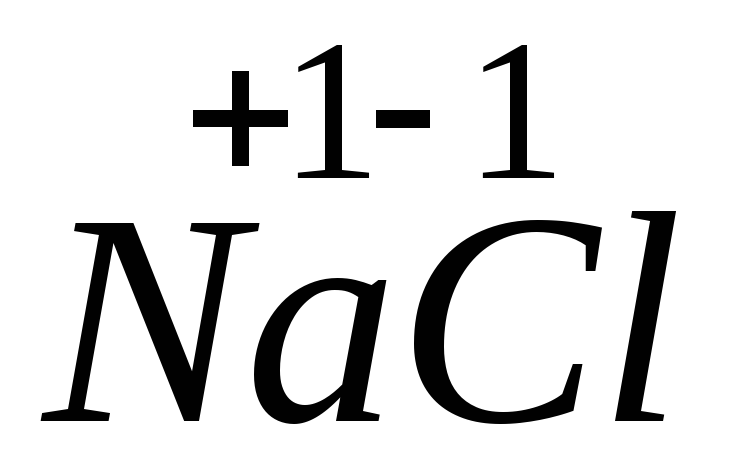 .
.
С![]()
![]() тепени
окисления атомов в веществах не
изменяются, поэтому реакция не является
окислительно-восстановительной.
тепени
окисления атомов в веществах не
изменяются, поэтому реакция не является
окислительно-восстановительной.
3.
![]() (
(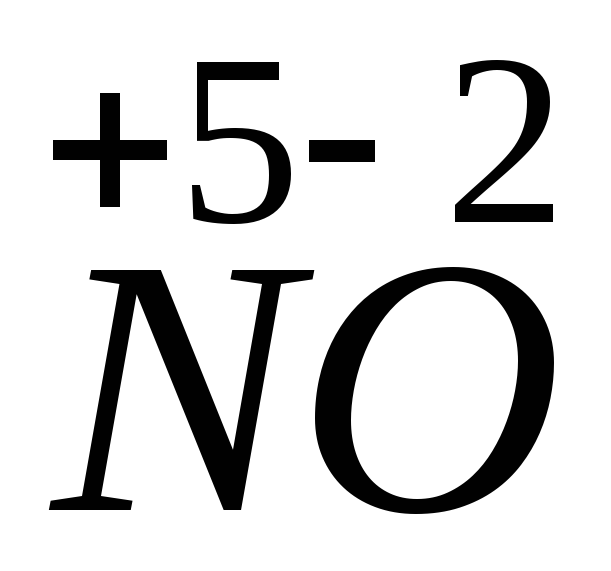 3)2
+
3)2
+
![]() = 2
= 2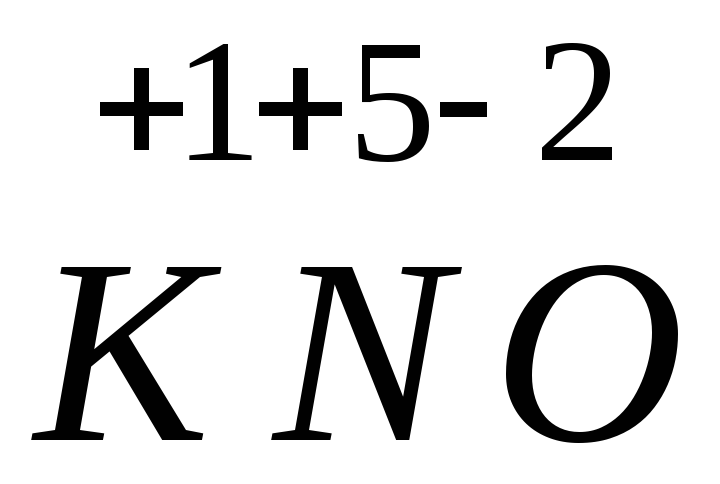 3
+
3
+
![]()
Эта реакция также не относится к окислительно-восстановительным, степени окисления атомов постоянны.
4.
2K![]() +
+
![]() 2
= 2K
2
= 2K![]() +
+
![]() 2.
2.
Хлор и йод меняют степени окисления, это окислительно-восстано-вительная реакция:
2![]()
2
2![]() =
=
![]() 2
– процесс
окисления, ион йода – восстановитель,
2
– процесс
окисления, ион йода – восстановитель,
![]() 2
+ 2
2
+ 2![]() = 2
= 2![]() – процесс
восстановления, молекула хлора –
окислитель.
– процесс
восстановления, молекула хлора –
окислитель.
Пример 2.
Какой процесс окисления или восстановления происходит при следующих превращениях:
![]()
![]()
![]() ;
;
![]()
![]()
![]() ;
;
![]()
![]()
![]() ;
;
![]()
![]()
![]() ;
;
![]()
![]()
![]() ;
;
![]()
![]()
![]() ?
?
Решение.
Повышение степени окисления происходит в результате отдачи электронов (окисления), понижение – за счет присоединения электронов (восстановления):
![]()
![]()
![]()
![]()
![]() 6
6![]() =
=
![]() – окисление,
– окисление,
![]()
![]()
![]()
![]()
![]() 8
8![]() =
=![]() –
окисление,
–
окисление,
![]()
![]()
![]()
![]()
![]() +
3
+
3![]() =
=![]() –
восстановление,
–
восстановление,
![]()
![]()
![]()
![]()
![]() 2
2![]() =
=
![]() – окисление,
– окисление,
![]()
![]()
![]()
![]()
![]() 3
3![]() =
=
![]() – окисление,
– окисление,
![]()
![]()
![]()
![]()
![]() +
1
+
1![]() =
=
![]() – восстановление.
– восстановление.
Пример 3.
Реакция выражается схемами:
1.
KClO3
![]() KClO4
+ KCl.
KClO4
+ KCl.
2.
(NH4)2S
+ K2Cr2O7
+ H2O
![]() S + Cr(OH)3
+ NH3
+ KOH.
S + Cr(OH)3
+ NH3
+ KOH.
Составьте электронные уравнения, расставьте коэффициенты, укажите окислитель и восстановитель.
Решение.
Для подбора коэффициентов уравнения воспользуемся методом электронного баланса.
1. Записываем уравнение реакции и находим атомы, меняющие степень окисления:
KCl+5O3 KCl+7O4 + KCl1.
2. Составляем электронные уравнения и находим окислитель и восстано-витель:
Cl+5
– 2![]() = Cl+7,
Cl+5
– восстановитель,
= Cl+7,
Cl+5
– восстановитель,
Cl+5
+ 6![]() = Cl–1,
Cl+5
– окислитель.
= Cl–1,
Cl+5
– окислитель.
В этом уравнении Cl+5(KClO3) является одновременно и окислителем, и восстановителем. Такая окислительно-восстановительная реакция называется реакцией диспропорционирования (самоокислениясамовосстановления).
3. Находим коэффициенты для окислителя, восстановителя и продуктов их превращения. Число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем. Для этого находим наименьшее общее кратное и множители:

 Cl+5
– 2
Cl+5
– 2![]() = Cl+7
3 (1)
= Cl+7
3 (1)
6
Cl+5
+ 6![]() = Cl–
1 (2)
= Cl–
1 (2)
Ставим эти множители в уравнение (1). Перед KClO3 (Cl+5) ставится суммарный множитель (3 + 1 = 4). Коэффициенты у формул остальных веществ подбираются как обычно, путем сопоставления числа атомов в правой и левой частях уравнения:
4KClO3 = 3KClO4 + KCl.
По той же методике расставим коэффициенты во втором уравнении:
3(NH4)2S–2 + K2Cr2+6O7 + H2O = 3S0 + 2Cr+3(OH)3 + 2KOH + 6NH3


S–2
– 2![]() = S0
3
= S0
3
6
Cr+6
+ 6![]() = 2Cr+3
1
= 2Cr+3
1
