
- •Методические указания Красноярск 2004
- •Печатается по решению Редакционно-издательского совета университета
- •660074, Красноярск, ул. Киренского, 28
- •Пример 2.
- •Пример 3.
- •Пример 4.
- •Задания
- •Пример 2.
- •Пример 3.
- •Пример 4.
- •Задания
- •Пример 2.
- •Пример 3.
- •Задания
- •Пример 2.
- •Пример 3.
- •Пример 4.
- •Задания
- •Пример 2.
- •Пример 3.
- •Задания
- •Пример 2.
- •Пример 4.
- •Пример 5.
- •Задания
- •Пример 2.
- •Пример 3.
- •Задания
- •Пример 2.
- •Задания
- •Пример 2.
- •Задания
- •Пример 4.
- •Задания
- •Пример 2.
- •Пример 3.
- •Пример 4.
- •Задания
- •Пример 2.
- •Пример 3.
- •Задания
- •Пример 2.
- •Пример 3.
- •Пример 4.
- •Задания
- •Пример 4.
- •Задания
- •Пример 2.
- •Пример 3.
- •Пример 4.
- •Пример 5.
- •Пример 6.
- •Пример 9.
- •Пример 10.
- •Пример 11.
- •Задания
- •Пример 2.
- •Пример 3.
- •Пример 4.
- •Пример 5.
- •Пример 6.
- •Пример 9.
- •Пример 10.
- •Пример 11.
- •Задания
- •Пример 2.
- •Пример 3.
- •Задания
- •Пример 2.
- •Пример 3.
- •Пример 4.
- •Пример 5.
- •Пример 6.
- •Пример 7.
- •Пример 10.
- •Задания
- •Органические соединения. Полимеры
- •Стандартная энергия Гиббса образования
- •Константы диссоциации слабых электролитов
- •Растворимость солей и оснований в воде
- •Ряд стандартных электродных потенциалов металлов
- •Оглавление
Пример 2.
Составьте электродные уравнения процессов, протекающих на электродах при электролизе раствора сульфата никеля в случае никелевого анода.
Решение.
Материалом для анода могут служить как металлы, так и любые токопроводящие материалы, например, графит или уголь.
При электролизе сульфата никеля с никелевым анодом он будет активным (растворимым). Металл анода окисляется, в отличие от угольного электрода, который является инертным и служит только как проводник электронов. Процесс с растворимым анодом нашел широкое применение в технике.
Напишем схему электролиза сульфата никеля с никелевым анодом:
NiSO4 Ni2+ + SO42–
H2O H+ + OH–
катод ();
Ni2+;
H+;
Ni2+ +
2![]() = Ni0;
= Ni0;
анод (+); Ni0;
OH–;
SO42–;
Ni0
2![]() = Ni2+.
= Ni2+.
Пример 3.
В одном сосуде имеется раствор, содержащий ионы меди, в другом раствор, содержащий ионы висмута. Через оба раствора пропущено одинаковое количество электричества. Сколько выделилось висмута, если масса выделившейся меди равна двум граммам?
Решение.
По второму закону электролиза Фарадея: “Массы выделившихся на электродах веществ пропорциональны молярным массам эквивалентов ”:
![]() =
=
![]() .
.
Молярная масса эквивалента металла равна частному от деления атомной массы металла на его валентность:
тЭ
(Cu)
=
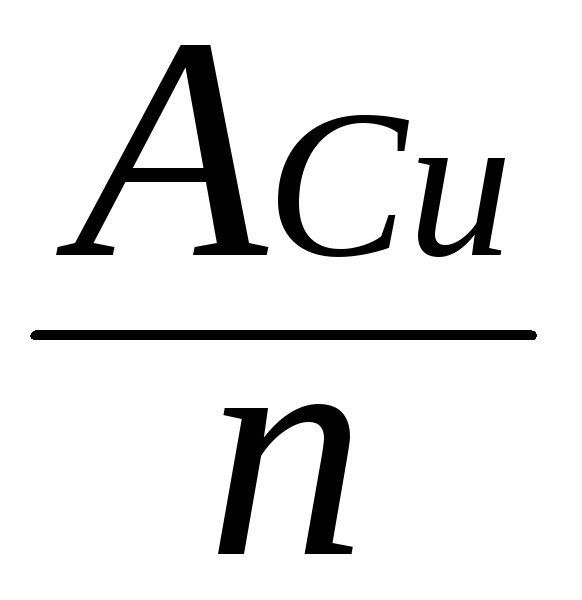 =
=
 = 31,8 г/моль.
= 31,8 г/моль.
тЭ
(Bi)
=
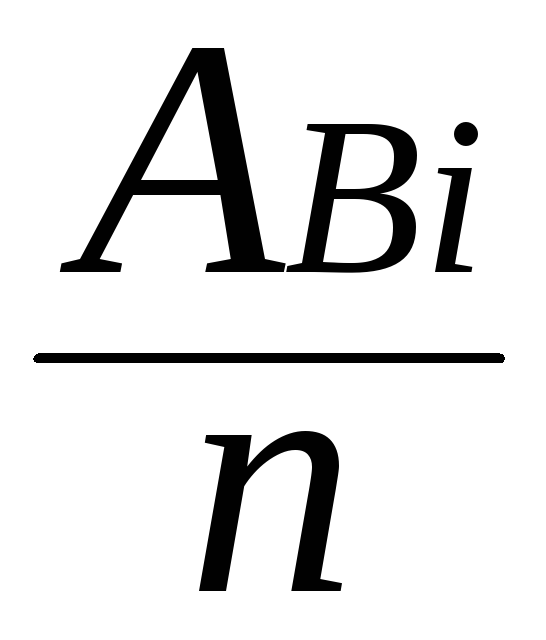 =
=
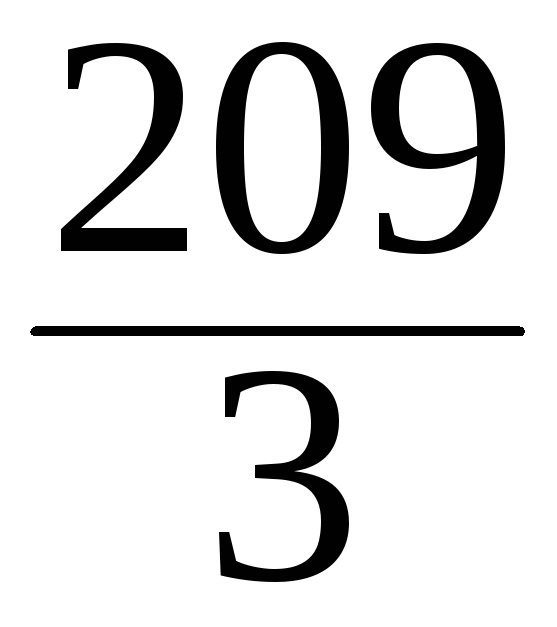 = 69,6 г/моль.
= 69,6 г/моль.
![]() =
=
![]()
mBi
=
mBi
=![]() =
=
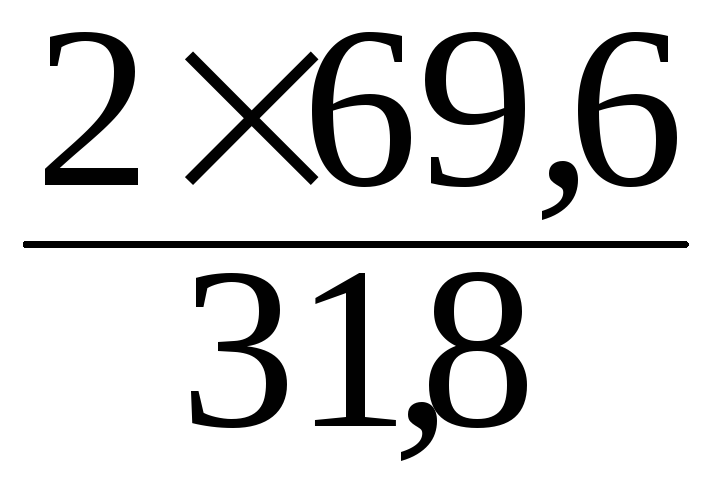 = 4,4 г.
= 4,4 г.
Задания
261. Электролиз раствора K2SO4 проводили при силе тока 5 А в течение 3 ч. Составьте электронные уравнения процессов, происходящих на электродах, вычислите объем выделяющихся на электродах веществ.
262. Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов AlCl3, NiSО4. В обоих случаях анод угольный.
263. При электролизе раствора CuSO4 на аноде выделилось 168 см3 кислорода (н.у.). Сколько граммов меди выделилось на катоде?
264. Сколько граммов воды разложилось при электролизе раствора Nа2SO4 при силе тока 7 А в течение 5 ч?
265. Электролиз раствора нитрата серебра проводили при силе тока 2 А в течение 4 ч. Сколько граммов серебра выделилось на катоде?
266. Электролиз раствора сульфата некоторого металла проводили при силе тока 6 А в течение 45 мин, в результате чего на катоде выделилось 5,49 г металла. Вычислите эквивалентную массу металла.
267. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора KOH, расплава KOH.
268. Электролиз раствора сульфата цинка проводили в течение 5 ч, в результате чего выделилось 6 л кислорода (н.у.). Вычислите силу тока.
269. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора Al2(S04)3 в случае угольного анода; в случае алюминиевого анода.
270. Какие вещества и в каком количестве выделятся на угольных электродах при электролизе раствора NaJ в течение 2,5 ч, если сила тока равна 6 А?
271. При электролизе раствора AgNO3 масса серебряного анода уменьшилась на 5,4 г. Сколько кулонов электричества израсходовано на этот процесс?
272. Какие вещества и в каком количестве выделяются на угольных электродах при электролизе раствора KВr в течение 1 ч 35 мин при силе тока 15 А?
273. Составьте электронные уравнения процессов, происходящих при электролизе CuCl2, если анод медный, если анод угольный?
274. На электролиз раствора CaCl2 израсходовано 10722,2 Кл электричества. Вычислите массу выделяющихся на угольных электродах и образующегося возле катода веществ.
275. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора КСl; расплава КСl.
276. Сколько времени проводят электролиз раствора электролита при силе тока 5 А, если на катоде выделяется 0,1 эквивалент вещества? Сколько вещества выделится на аноде?
277. При электролизе растворов MgSO4 и ZnCl2 соединенных последовательно с источником тока, на одном из катодов выделилось 0,25 г водорода. Сколько граммов вещества выделится на другом катоде; на анодах?
278. Чему равна сила тока, если при электролизе раствора MgCl2 в течение 30 мин на катоде выделилось 8,4 л водорода (н.у.). Вычислите массу вещества, выделяющегося на аноде.
279. Сколько граммов H2SО4 образуется возле анода при электролизе раствора Na2SO4, если на аноде выделяется 1,12 л кислорода, измеренного при н.у.? Вычислите массу вещества, выделяющегося на катоде.
280. Вычислите силу тока, зная, что при электролизе раствора KOH в течение 1 ч 15 мин 20 с на аноде выделилось 6,4 г кислорода. Какое вещество и в каком количестве выделяется на катоде?
Коррозия металлов
Пример 1.
Железная пластинка, погруженная в раствор серной кислоты, медленно разрушается, выделяя водород. Если к железной пластинке в растворе прикоснуться платиновой проволокой, то водород начинает выделяться на платине, а железо – разрушаться интенсивнее. Дайте объяснение этому явлению.
Решение.
Процесс самопроизвольного разрушения металла, вызываемый химическим или электрохимическим взаимодействием его с окружающей средой, называется коррозией.
При погружении железной пластинки в раствор серной кислоты протекает окислительно-восстановительная реакция:
Fe + H2SO4 = FeSO4 + H2,
Fe0
– 2![]() = Fe2+
– окисление,
= Fe2+
– окисление,
2H+
+ 2![]() = H2
– восстановление.
= H2
– восстановление.
Если к железной пластинке прикоснуться платиновой проволокой, то в среде электролита возникает в месте контакта металлов гальванический элемент, появляется электродвижущая сила и окислительно-восстановительная реакция ускоряется. Железо в этом элементе – анод, оно окисляется и разрушается; платина – катод, на ней протекает восстановление ионов водорода. Такой вид электрохимической коррозии называется микрогальванокоррозией. Схема коррозии железа в контакте с платиной в среде серной кислоты имеет вид:
Fe / H2SO4 / Pt ,
анод (Fe)
Fe0 – 2![]() = Fe2+ – окисление,
= Fe2+ – окисление,
катод (Pt)
2H+ + 2![]() = H2 – восстановление,
= H2 – восстановление,
Fe2+ + SO42– = FeSO4.
