
Влияние температуры на скорость химической реакции.
Это влияние определяется правилом Вант-Гоффа: при повышении температуры на 100С скорость гомогенной химической реакции увеличивается в 2 ÷ 4 раза.
V(t2) = V(t1) ∙ γ(∆t/10)
V(t2) и V(t1) – скорости реакции при температуре t2 и t1.
γ – температурный коэффициент = 2 ÷ 4, показывает во сколько раз увеличилась скорость реакции при увеличении температуры на 100С.
∆t = t2 – t1.
Для биохимических реакций температурный коэффициент при увеличении температуры на 100С получить нельзя, а только на 50С, и γ = 1,1 ÷ 1,8 раз.
Правило Вант-Гоффа работает при температуре от 00С до 1000С. Для более высоких температур используют правило Аррениуса. Аррениус предположил, что не всякое столкновение молекул ведет к химическому взаимодействию. В реакцию вступает только небольшая часть от общего количества молекул, обладающих необходимым или большим запасом энергии для протекания реакции. Энергия активации – Ea – избыточное количество энергии по сравнению со средней величиной, которой должна обладать молекула в момент столкновения, что бы быть способной к химическому взаимодействию. Чем меньше энергия активации, тем выше скорость реакции.
U ак A
+ B = C + D
U –
внутренняя энергия
ак A
+ B = C + D
U –
внутренняя энергия
активированный комплекс
Еа
∆Н
A+B
C+D
 ход реакции
ход реакции
Рис.: энергия активации.
Энергия активации затрачивается на ослабление связей между атомами в молекулах реагирующих веществ. При этом вещества переходят в неустойчивое промежуточное состояние, называемое активированным комплексом.
Уравнение Аррениуса для расчета энергии активации:
(dlnK / dT) = (Ea /RT2)
Ea = (RT1T2 / (T2-T1)) ∙ ln(KT2/KT1)
где KT2 и KT1 – константы равновесия при температуре T2 и T1, соответственно.
Высокое значение энергии активации реакции нежелательно, так как это означает, что на пути к ее осуществлению стоит высокий энергетический барьер. Для большей части биохимических реакций Еа ниже в 2 ÷ 3 раза, чем для химических, так как они протекают в присутствии ферментов, которые понижают Еа. Тем не менее, энергия активации разрушения биологических структур очень высокая, что способствует защите клеток от повреждений. Скорость реакции можно увеличить путем снижения энергии активации, которое осуществляется за счет введения в реакционную среду катализатора.
Катализ и катализаторы.
Катализ – процесс изменения скорости химической реакции путем введения в реакционную среду катализатора.
Катализатор – вещество, участвующее в ходе химической реакции и изменяющее ее скорость, но остающееся после реакции в неизменном виде.
Различают положительный катализ, (скорость реакции увеличивается), отрицательный катализ, (скорость реакции уменьшается), аутокатализ (катализатор образуется в ходе химической реакции), гомогенный катализ (катализатор находится в одинаковом агрегатном состоянии с реагирующими веществами), гетерогенный катализ (катализатор находится в другом агрегатном состоянии, чем реагирующие вещества).
Важной особенностью процесса катализа является снижение энергии активации. Катализатор, попадая в реакционную среду, образует активированный комплекс с одним из реагирующих веществ. Затем активированный комплекс вступает в реакцию с другими реагирующими веществами, образуя продукты реакции и катализатор. Действие катализатора сводится к открытию нового реакционного пути, на котором катализатор непосредственно взаимодействует хотя бы с одним из реагирующих веществ, и при этом энергия образования активированного комплекса значительно ниже.
U ак A
+ B = C + D
А + К = АК
ак A
+ B = C + D
А + К = АК
активированный комплекс АК + В = С + D + K
Еа
A+B АК+В
C+D
 ход реакции
ход реакции
Рис.: энергия активации в присутствии катализатора.
Роль катализаторов в организме отводится ферментам. Ферментный катализ имеет ряд особенностей:
-
Высокая каталитическая активность. По своей активности ферменты в миллионы раз превосходят химические катализаторы, поэтому для реакций их надо очень мало.
-
Высокая специфичность. Каждый фермент действует на строго определенную реакцию или группу реакций.
-
Ферменты проявляют свою активность при строго определенном значении рН среды.
-
Ферменты наиболее активны при температуре 370С ÷ 400С, при более низкой температуре ферменты становятся менее активны, а при более высокой – происходит денатурация ферментов.
Пример реакции: фермент + субстрат = фермент-субстратный комплекс
фермент-субстратный комплекс = продукт + фермент

 Vp
Vp
Vp
– скорость реакции
Vp
Vp
Vp
– скорость реакции
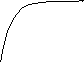
 Vp
max
[E] – фермент
(энзим)
Vp
max
[E] – фермент
(энзим)
[S] – субстрат
 1/2Vp
max
1/2Vp
max = К – const
Михаэлиса
1/2Vp
max
1/2Vp
max = К – const
Михаэлиса
Vp = ([E] · [S]) / (K + [S])


[E] [S]
Рис.: Зависимость скорости реакции от концентраций энзима и субстрата.
