
Ионообменные равновесия.
В общем виде ионообменная реакция между однозарядными ионами и ионами с различными зарядами может быть представлена уравнениями:
![]()
![]()
Как было указано выше, ионный обмен — обратимый стехиометрический процесс, протекающий до установления динамического равновесия. Поэтому в соответствии с законом действия масс для ионообменных реакций можно записать термодинамические константы равновесия:
![]() (1)
(1)
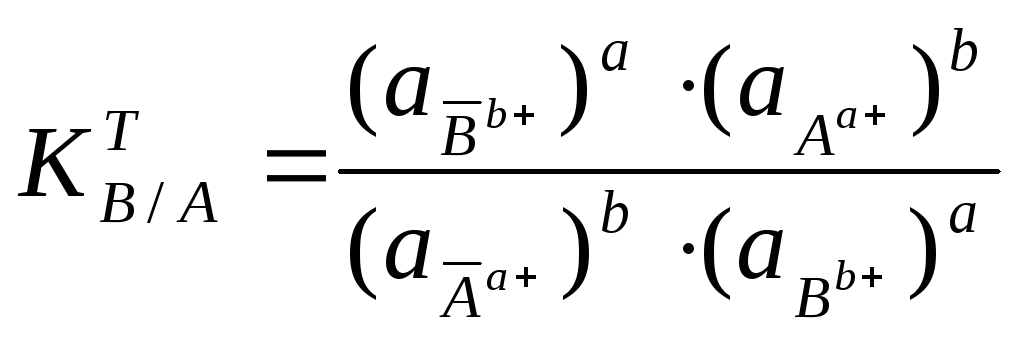 (2)
(2)
где,
![]() -
активности ионов А+,
В+,
Аa+,
Вb+
в ионообменнике (черточкой отмечены
ионы, находящиеся в фазе ионообменника);
-
активности ионов А+,
В+,
Аa+,
Вb+
в ионообменнике (черточкой отмечены
ионы, находящиеся в фазе ионообменника);
![]() -
активности А+,
В+,
Аa+,
Вb+
в растворе при равновесии; a,
b
– заряды ионов.
-
активности А+,
В+,
Аa+,
Вb+
в растворе при равновесии; a,
b
– заряды ионов.
Если ввести коэффициенты активности, то выражение термодинамической константы равновесия будет таким:
![]()
где
![]() —
аналитические концентрации индивидуальных
компонентов;
—
аналитические концентрации индивидуальных
компонентов;
![]() — коэффициенты активности.
— коэффициенты активности.
Для расчета термодинамической константы равновесия по уравнениям (1 и 2) активности ионов в растворе могут быть вычислены с учетом коэффициента активности по концентрации соответствующих солей, находящихся в системе. Активности ионов в фазе ионообменника определяют при помощи сложных математических расчетов.
В аналитической практике обычно вместо термодинамической константы равновесия ионного обмена используют концентрационную константу равновесия (т. е. не учитываются коэффициенты активности):
![]()
Эту константу равновесия часто называют коэффициентом селективности.
В случае, если обмениваются ионы разного заряда, то коэффициент селективности принимает вид:
![]() (3)
(3)
Коэффициент селективности не является постоянной величиной и зависит от свойств раствора, общей его концентрации, количественных соотношений ионов А+ и В+, от температуры. Он характеризует сродство данного ионообменника к иону В+ по сравнению с ионом А+.
Если KB/A = 1, то селективность ионообменника отсутствует, отклонение коэффициента селективности от единицы является мерой различия в сродстве противоионов в фазе раствора и ионита.
Коэффициент селективности рассчитывают по экспериментальным данным. Если обмениваются ионы одинакового заряда, то коэффициент селективности не зависит от единиц измерения концентрации иона в растворе и ионите. В случае обмена ионов с различными значениями зарядов, показатели в уравнении (3) будут различными, и, следовательно, коэффициент селективности будет зависеть от единиц измерения концентрации в обеих фазах. Обычно в практике ионного обмена концентрации растворов выражают через молярные или эквивалентные концентрации, а в фазе ионита — через молярные или эквивалентные доли.
С елективность
ионообменника к тому или иному иону
можно оценить с помощью изотерм обмена,
которые показывают зависимость
равновесной концентрации или эквивалентной
доли иона в ионообменнике от концентрации
или эквивалентной доли его в растворе
при заданной температуре.
елективность
ионообменника к тому или иному иону
можно оценить с помощью изотерм обмена,
которые показывают зависимость
равновесной концентрации или эквивалентной
доли иона в ионообменнике от концентрации
или эквивалентной доли его в растворе
при заданной температуре.
Если KB/A = 1, изотерма линейна (изотерма Генри), при этом сродство ионита к разделяемым ионам одинаково. При KB/A > 1 изотерма выпуклая (изотерма типа Ленгмюра), она линейна при малых концентрациях иона в растворе, а при больших концентрациях количество сорбированного вещества стремится к постоянному значению.
Ионообменник селективен к тому или иному иону, если 1 < KB/A < 1.
Ионы, имеющие одинаковый заряд, сорбируются ионообменником тем лучше, чем больше радиус иона, так как ион большого радиуса менее гидратирован.
Из щелочных металлов хуже всех на сульфокатионообменниках сорбируется наиболее гидратированный ион лития. Его коэффициент селективности условно принят за единицу. Ион Cs+ имеет большой коэффициент селективности (К= 3,25), он наименее гидратирован. Порядок селективности гидратированных ионов щелочных металлов на сульфокатионообменниках соответствует следующему ряду: Li+ < Na+ < K+ < Rb+ < Cs+ < <Ag+, т. е. с возрастанием порядкового номера элемента увеличивается селективность иона к ионообменнику.
Для щелочноземельных металлов селективность возрастает в ряду: Mg2+ < Са2+ < <Sr2+ < Ba2+. В случае ионов с разными зарядами сорбция их возрастает с увеличением заряда иона: М4+ > М3+ > М2+ > М+. При разбавлении раствора увеличивается сорбция ионов с более высоким зарядом, что используется при групповом ионообменном разделении ионов.
Если катион М+ образует с анионом L в растворе комплексы ML, ML,..... MLn, то поглощение комплексного иона будет оказывать влияние на ионообменное равновесие, так как образующиеся комплексы MLn могут быть нейтральными, катионными и анионными. Процессы комплексообразования широко применяются для разделения ионов в ионообменной хроматографии.
На селективность ионного обмена оказывает влияние температура, которая влияет на вязкость раствора. Ионообменное равновесие зависит также от ионной силы раствора, что особенно резко выражено при небольших ее значениях. Чем меньше ионная сила раствора, тем лучше сорбируется исследуемый ион.
