
Экспериментальная часть
Суть данной работы заключается в том, что анализируемый раствор пропускают через сильнокислотный катионообменник в Н-форме, в результате ионного обмена получается смесь кислот НСl и СН3СООН, содержание каждой кислоты определяют потенциометрически, титруя элюат раствором щелочи. Содержание свободной уксусной кислоты СН3СООН в исходной смеси определяют титрованием пробы исходного анализируемого раствора.
Приборы и реактивы
Хроматографическая колонка длиной 300 мм, диаметром 15 мм, содержащая 10 г катионообменника КУ-2.
Потенциометр со стеклянным и хлоридсеребряным электродами.
Магнитная мешалка.
Стаканы вместимостью 150 и 200 мл.
Пипетка вместимостью 10 мл.
Бюретка вместимостью 25 мл.
Мерная колба вместимостью 100 мл.
Стандартный раствор NaOH, 0,1 М.
Анализируемый раствор: смесь СН3СООН, CH3COONa и NaCl с концентрацией 1,0—3,0 мг/мл каждого компонента.
Выполнение работы
Переведение катионообменника в Н-форму.
Через колонку пропускают 200 мл 2 М раствора НСl (или H2SO4) со скоростью 1—2 капли/с. Затем катионообменник отмывают от кислоты 200—250 мл дистиллированной воды (скорость пропускания 2— 3 капли/с). При этом периодически отбирают на часовое стекло несколько капель раствора, вытекающего из колонки, и проверяют рН среды с помощью индикатора метилового оранжевого. Промывание проводят до получения желтой окраски метилового оранжевого.
Необходимо следить за тем, чтобы над слоем катионообменника все время находилась жидкость. В случае появления в колонке пузырьков воздуха катионообменник взрыхляют стеклянной палочкой.
Проведение ионного обмена.
Анализируемый раствор помещают в мерную колбу вместимостью 100 мл, доводят объем раствора до метки дистиллированной водой и тщательно перемешивают. Отбирают пипеткой 10 мл раствора и пропускают через колонку со скоростью 1 капля/с. Элюат собирают в стакан вместимостью 150 мл. Для полного вымывания выделившихся кислот (рН проверяют по метиловому оранжевому) через колонку пропускают 60—100 мл дистиллированной воды порциями по 10—15 мл, без потерь собирая элюат в тот же стакан.
П отенциометрическое
титрование.
отенциометрическое
титрование.
В стакан с элюатом, содержащим растворы кислот, погружают электроды (индикаторный — стеклянный, электрод сравнения — хлоридсеребряный), бюретку заполняют стандартным раствором NaOH, включают магнитную мешалку и приступают к титрованию. Результаты титрования записываются в таблицу.
|
Объем NaOH, мл |
рН (или Е, мВ) |
Сначала титрант добавляют порциями по 0,5 мл и постоянно следят за изменением рН (или потенциала Е) анализируемой смеси. Как только изменение рН (или Е) станет заметно отличаться от предыдущих значений (наступает скачок титрования), титрант добавляют меньшими порциями, по 2—3 капли.
После первого скачка новые одинаковые порции прибавляемого титранта будут вызывать почти одинаковые изменения рН (или потенциала) системы. На этом этапе титрант снова приливают порциями по 0,5 мл до тех пор, пока очередная порция раствора NaOH не вызовет резкого изменения рН (или потенциала) системы. Второй скачок титрования измеряют, приливая титрант порциями по 2—3 капли. После достижения второго скачка титрант добавляют по 0,5 мл до тех пор, пока не установится постоянное значение рН (или Е).
Получают кривую потенциометрического титрования смеси кислот, на которой первый скачок соответствует нейтрализации НСl (V1, мл NaOH), второй скачок — нейтрализации СН3СООН (V2, мл NaOH).
Для определения содержания исходной СН3СООН из мерной колбы отбирают пипеткой 10 мл анализируемого раствора, помещают в стакан вместимостью 150 мл, добавляют 50 мл дистиллированной воды и титруют раствором NaOH. По кривой потенииометрического титрования определяют объем раствора NaOH (V, мл), пошедший на титрование СН3СООН.
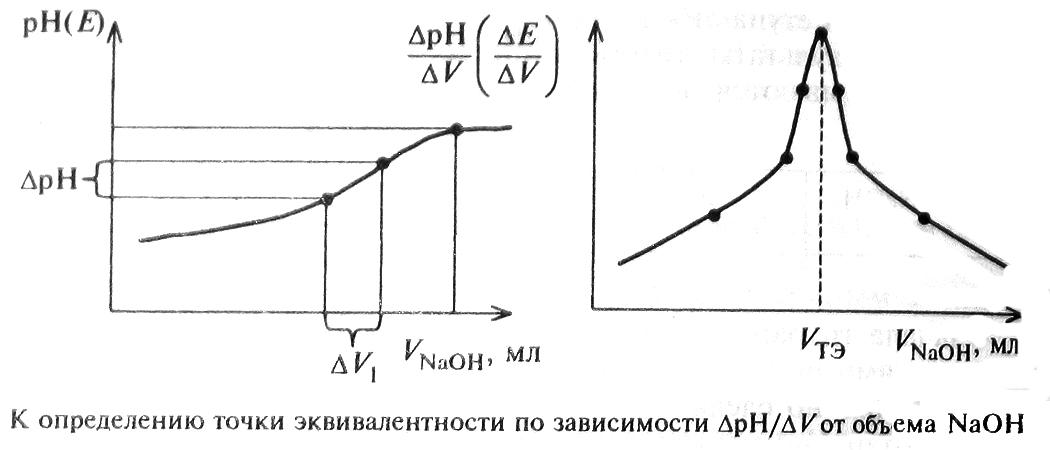
Для более точного определения точки эквивалентности поступают следующим образом. Используя результаты титрования, строят график зависимости ∆рН/∆V (или ∆E/∆V) от VNaOH, на участке кривой по обе стороны от предполагаемой точки эквивалентности выбирают по 3—4 точки и координаты этих точек обрабатывают, как показано на рисунке:
Содержание СН3СООН, СН3СООNa, NaCl (в г) вычисляют по формулам:
![]()
![]()
![]() ,
,
где VК и VП – вместимость колбы и пипетки, соответственно.
