
- •Фгбоу впо "Орловский государственный институт экономики и торговли»
- •Содержание
- •Правила ТехникИ безопасности при выполнении лабораторных работ (частЬ II)
- •Рекомендации к подготовке и выполнению лабораторных работ (частЬ II)
- •Лабораторная работа№4 изучение законов колебательного движения
- •2. Краткая теория
- •3. Описание установки
- •4. Порядок выполнения работы
- •Обработка результатов измерений
- •5. Контрольные вопросы
- •Лабораторная работа № 5 определение коэффициента внутреннего трения жидкостей
- •2. Краткая теория
- •3. Теория метода Стокса
- •4. Описание установки
- •5. Порядок выполнения работы
- •6. Обработка результатов измерений
- •Контрольные вопросы
- •Лабораторная работа № 6 определение коэффициента поверхностного натяжения жидкости
- •2. Краткая теория
- •3. Описание установки
- •4. Порядок выполнения работы
- •5. Обработка результатов измерений
- •Контрольные вопросы
- •Лабораторная работа №7 определение отношения теплоёмкостей газа при постоянном давлении и постоянном объёме методом адиабатического расширения
- •2. Краткая теория.
- •3. Описание установки и метода измерения
- •4. Порядок выполнения работы
- •Обработка результатов
- •Контрольные вопросы
- •Рекомендуемая литература
3. Описание установки и метода измерения
С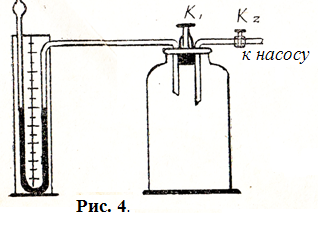 хема
лабораторной установки, используемой
при выполнении работы, показана на рис.
4. Основными элементами установки
являются толстостенный сосуд ёмкостью
15-20 литров,
хема
лабораторной установки, используемой
при выполнении работы, показана на рис.
4. Основными элементами установки
являются толстостенный сосуд ёмкостью
15-20 литров,
![]() -
образный манометр и насос. Стеклянный
сосуд соединён трубками и резиновыми
шлангами с насосом и с манометром. При
нажатии клапана
-
образный манометр и насос. Стеклянный
сосуд соединён трубками и резиновыми
шлангами с насосом и с манометром. При
нажатии клапана
![]() сосуд
может сообщаться с атмосферой. Кран
сосуд
может сообщаться с атмосферой. Кран
![]() служит для подачи воздуха в сосуд oт
насоса.
служит для подачи воздуха в сосуд oт
насоса.
Для
того, чтобы проанализировать процессы,
происходящие в сосуде, мысленно выделим
один моль газа, объём которого
![]() —
молярный объём,
—
молярный объём,
![]() —
давление,
—
давление,
![]() —
температура.
—
температура.
До
начала эксперимента воздух в сосуде
находится при атмосферном давлении. С
помощью насоса быстро накачивают немного
воздуха и закрывают кран
![]() .
Теперь давление воздуха в сосуде выше
атмосферного, о чём можно судить по
разности уровней жидкости в манометре.
Но кроме давления повысилась и температура
воздуха, так как над газом совершена
работа внешними силами (адиабатическое
сжатие при быстром накачивании в сосуд
дополнительной массы газа).
.
Теперь давление воздуха в сосуде выше
атмосферного, о чём можно судить по
разности уровней жидкости в манометре.
Но кроме давления повысилась и температура
воздуха, так как над газом совершена
работа внешними силами (адиабатическое
сжатие при быстром накачивании в сосуд
дополнительной массы газа).
По
истечении 2-3 минут разность уровней
жидкости в манометре уменьшается до
некоторой величины
![]() .
Это объясняется тем, что температура
воздуха в сосуде понизилась и сравнялась
с температурой окружающей среды (процесс
изохорический). При этом молярный объём
будет
.
Это объясняется тем, что температура
воздуха в сосуде понизилась и сравнялась
с температурой окружающей среды (процесс
изохорический). При этом молярный объём
будет
![]() ,
давление
,
давление
![]() и температура
и температура
![]() .
Состояние газа, соответствующее этим
параметрам, обозначено точкой 1 на
рис. 5.
.
Состояние газа, соответствующее этим
параметрам, обозначено точкой 1 на
рис. 5.
П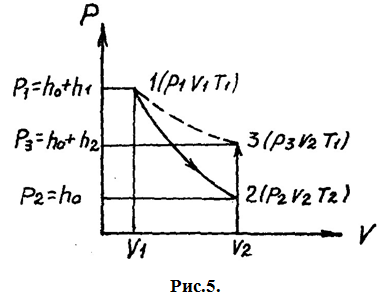 осле
этого газ переводится в новое состояние,
для чего открывают на некоторое время
клапан
осле
этого газ переводится в новое состояние,
для чего открывают на некоторое время
клапан
![]() (пока уровни жидкости в манометре не
сравняются) (рис. 4). Воздух в сосуде
быстро расширяется ( процесс адиабатический)
и его давление становится равным
атмосферному
(пока уровни жидкости в манометре не
сравняются) (рис. 4). Воздух в сосуде
быстро расширяется ( процесс адиабатический)
и его давление становится равным
атмосферному
![]() .
При
этом температура воздуха в баллоне
понизится до некоторого значения
.
При
этом температура воздуха в баллоне
понизится до некоторого значения
![]() ,
а мысленно выделенное количество газа
займёт другой объём
,
а мысленно выделенное количество газа
займёт другой объём
![]() причём
причём![]() .
.
Температура
![]() будет
ниже температуры окружающей среды
будет
ниже температуры окружающей среды
![]() ,
так
как при расширении газа совершается
работа за счёт
внутренней
энергии газа (воздуха). Новое состояние
газа, характеризуемое параметрами
,
так
как при расширении газа совершается
работа за счёт
внутренней
энергии газа (воздуха). Новое состояние
газа, характеризуемое параметрами
![]() ,
соответствует
на графике (рис.5) точке 2.
Точки
1
и
2 принадлежат
одной адиабате. Для адиабатического
перехода из состояния 1
в состояние 2
справедливо
уравнение Пуассона (7).
,
соответствует
на графике (рис.5) точке 2.
Точки
1
и
2 принадлежат
одной адиабате. Для адиабатического
перехода из состояния 1
в состояние 2
справедливо
уравнение Пуассона (7).
После
закрытия клапана
![]() давление
внутри сосуда в течение 3-4 минут возрастает
вследствие того, что воздух, охладившийся
при адиабатическом расширении, станет
нагреваться за счёт теплообмена через
стенки сосуда с окружающей средой
(изохорический процесс). Когда температура
воздуха внутри сосуда станет равной
температуре окружающей среды
давление
внутри сосуда в течение 3-4 минут возрастает
вследствие того, что воздух, охладившийся
при адиабатическом расширении, станет
нагреваться за счёт теплообмена через
стенки сосуда с окружающей средой
(изохорический процесс). Когда температура
воздуха внутри сосуда станет равной
температуре окружающей среды
![]() ,
давление внутри сосуда перестанет
возрастать. После этого делают отсчёт
по шкале манометра. Давление воздуха в
сосуде в этот момент
,
давление внутри сосуда перестанет
возрастать. После этого делают отсчёт
по шкале манометра. Давление воздуха в
сосуде в этот момент
![]() окажется выше атмосферного на величину,
измеряемую разностью уровней жидкости
в манометре
окажется выше атмосферного на величину,
измеряемую разностью уровней жидкости
в манометре
![]() :
:
![]() .
(24)
.
(24)
Объём
воздуха в сосуде
![]() не
изменится, так как кран был закрыт. Это
новое состояние газа, характеризуемое
параметрами
не
изменится, так как кран был закрыт. Это
новое состояние газа, характеризуемое
параметрами
![]() ,
соответствует
на графике точке 3. Из сравнения состояний
газа, изображаемых на графике точками
1 и 3,
следует,
что в этих состояниях газ имел одинаковую
температуру
,
соответствует
на графике точке 3. Из сравнения состояний
газа, изображаемых на графике точками
1 и 3,
следует,
что в этих состояниях газ имел одинаковую
температуру
![]() ,
т.
е. точки 1 и 3 принадлежат одной и той же
изотерме. Поэтому для этих состояний
применим закон Бойля-Мариотта
,
т.
е. точки 1 и 3 принадлежат одной и той же
изотерме. Поэтому для этих состояний
применим закон Бойля-Мариотта
![]() .
.
Возводя
это уравнение в степень ![]() и
деля его почленно на уравнение Пуассона
(7), получаем:
и
деля его почленно на уравнение Пуассона
(7), получаем:
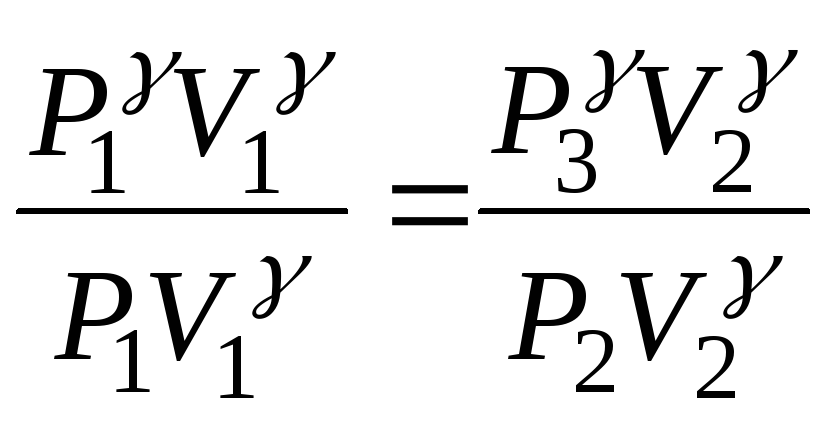 ,
,
откуда
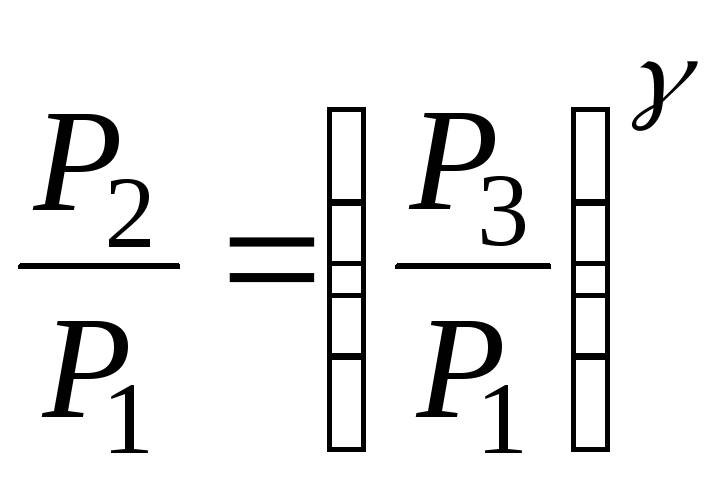 .
.
Логарифмируя
это равенство и разрешая его относительно
![]() ,
находим:
,
находим:
![]() ,
,
откуда
![]() .
(25)
.
(25)
Подставив
в это выражение значения
![]() ,
получим:
,
получим:
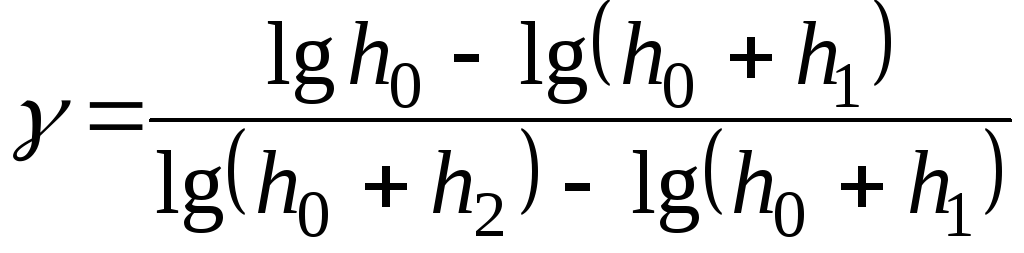 .
(26)
.
(26)
При приближённом вычислении разность логарифмов можно заменить разностями самих чисел, стоящих под знаками логарифмов. При этом условии выражение (26) приводится к виду:
![]() .
(27)
.
(27)
Таким
образом, измерив величины
![]() и
и
![]() ,
можно
определить
,
можно
определить ![]() ,
т. е. величину отношения теплоёмкости
идеального газа при постоянном давлении
к теплоёмкости этого же газа при
постоянном объёме.
,
т. е. величину отношения теплоёмкости
идеального газа при постоянном давлении
к теплоёмкости этого же газа при
постоянном объёме.
