
- •Фгбоу впо "Орловский государственный институт экономики и торговли»
- •Содержание
- •Правила ТехникИ безопасности при выполнении лабораторных работ (частЬ II)
- •Рекомендации к подготовке и выполнению лабораторных работ (частЬ II)
- •Лабораторная работа№4 изучение законов колебательного движения
- •2. Краткая теория
- •3. Описание установки
- •4. Порядок выполнения работы
- •Обработка результатов измерений
- •5. Контрольные вопросы
- •Лабораторная работа № 5 определение коэффициента внутреннего трения жидкостей
- •2. Краткая теория
- •3. Теория метода Стокса
- •4. Описание установки
- •5. Порядок выполнения работы
- •6. Обработка результатов измерений
- •Контрольные вопросы
- •Лабораторная работа № 6 определение коэффициента поверхностного натяжения жидкости
- •2. Краткая теория
- •3. Описание установки
- •4. Порядок выполнения работы
- •5. Обработка результатов измерений
- •Контрольные вопросы
- •Лабораторная работа №7 определение отношения теплоёмкостей газа при постоянном давлении и постоянном объёме методом адиабатического расширения
- •2. Краткая теория.
- •3. Описание установки и метода измерения
- •4. Порядок выполнения работы
- •Обработка результатов
- •Контрольные вопросы
- •Рекомендуемая литература
Лабораторная работа №7 определение отношения теплоёмкостей газа при постоянном давлении и постоянном объёме методом адиабатического расширения
1. Цель работы: Изучение изопроцессов, закономерностей адиабатического процесса и экспериментальное определение показателя адиабаты для воздуха при комнатной температуре.
2. Краткая теория.
Основные закономерности адиабатического процесса изучаются на примере поведения идеального газа.
Идеальный газ — это некий абстрактный газ, удовлетворяющий следующим условиям: 1) соударения молекул такого газа происходят как соударения упругих шаров; 2) размеры молекул пренебрежимо малы; 3) между молекулами отсутствуют силы взаимного притяжения и отталкивания.
В сякий
реальный газ по мере убывания его
плотности приближается по свойствам к
идеальному. Обычный воздух при комнатной
температуре и атмосферном давлении
можно приближённо считать идеальным
газом. Состояние некоторой массы газа
определяется значениями трёх параметров:
давления
сякий
реальный газ по мере убывания его
плотности приближается по свойствам к
идеальному. Обычный воздух при комнатной
температуре и атмосферном давлении
можно приближённо считать идеальным
газом. Состояние некоторой массы газа
определяется значениями трёх параметров:
давления![]() ,
объема
,
объема
![]() и
температуры
и
температуры
![]() .
В
том случае, когда из этих трёх параметров
при изменении состояния газа один
остаётся постоянным, процесс перехода
называется изопроцессом.
.
В
том случае, когда из этих трёх параметров
при изменении состояния газа один
остаётся постоянным, процесс перехода
называется изопроцессом.
Для идеального газа строго выполняются законы Бойля-Мариотта, Гей-Люссака и Шарля. Эти законы описывают состояния газа для случаев, когда один из параметров остаётся постоянным.
Закон
Бойля-Мариотта
описывает изотермический процесс, т.
е. процесс, протекающий при постоянной
температуре (![]() ):
для
данной массы газа при постоянной
температуре произведение давления газа
на объём есть величина постоянная
):
для
данной массы газа при постоянной
температуре произведение давления газа
на объём есть величина постоянная
![]() .
.
Графически это соотношение изображается гиперболой (рис. 1). Каждому значению температуры соответствует своя кривая. Эти кривые называются изотермами.
Закон
Гей-Люссака
описывает изобарический процесс, т. е.
процесс, протекающий при постоянном
давлении (![]() ):
отношение
объёма данной массы газа к температуре,
при которой он находится, есть величина
постоянная:
):
отношение
объёма данной массы газа к температуре,
при которой он находится, есть величина
постоянная:
![]() .
(2)
.
(2)
Закон
Шарля
описывает изохорический процесс, т. е.
процесс, протекающий при постоянном
объёме (![]() ):
отношение
давления газа к температуре, при которой
он находится, есть величина постоянная:
):
отношение
давления газа к температуре, при которой
он находится, есть величина постоянная:
![]() . (3)
. (3)
Графически
соотношения (2) и (3) изображены в координатах
![]() на
рис. 1.
на
рис. 1.
Первое
начало термодинамики
выражает закон сохранения энергии и
формулируется следующим образом:
количество
тепла
![]() сообщённое
системе, идёт на приращение внутренней
энергии
сообщённое
системе, идёт на приращение внутренней
энергии
![]() системы
и на совершение системой работы
системы
и на совершение системой работы
![]() против внешних сил:
против внешних сил:
![]() . (4)
. (4)
Для бесконечно малого изменения состояния системы уравнение (4) примет вид:
![]() . (5)
. (5)
Адиабатическим процессом называется процесс, протекающий без теплообмена с внешней средой. Близкими к адиабатическому могут быть быстро протекающие процессы, так как количество тепла, которым обменивается система с внешней средой, будет тем меньше, чем меньшее время длится процесс.
Для
адиабатического процесса
![]() ,
тогда из (5) следует:
,
тогда из (5) следует:
![]()
или
![]() , (6)
, (6)
т. е. работа в адиабатическом процессе совершается за счёт убыли внутренней энергии.
Для идеального газа при адиабатическом процессе функциональная связь между давлением и объёмом определяется уравнением Пуассона:
![]() ,
(7)
,
(7)
г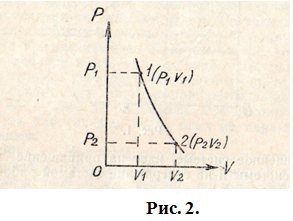 де
де![]() — показатель степени, численно равный
отношению молярных теплоёмкостей
данного газа, т. е.:
— показатель степени, численно равный
отношению молярных теплоёмкостей
данного газа, т. е.:
![]() .
(8)
.
(8)
Кривая,
изображающая адиабатический процесс
в координатах![]() называется
адиабатой
(рис. 2).
называется
адиабатой
(рис. 2).
Теплоёмкость газа — это физическая величина, численно равная количеству тепла, которое необходимо сообщить системе для нагревания её на один Кельвин (градус):
![]() . (9)
. (9)
В
системе СИ теплоёмкость имеет размерность
![]() .
.
Различают удельную и молярную теплоёмкости.
Теплоёмкость единицы массы вещества называют удельной теплоёмкостью:
![]() . (10)
. (10)
Она
обозначается буквой
![]() и
имеет и
имеет
размерность
и
имеет и
имеет
размерность
![]() .
.
Теплоёмкость одного моля вещества называется молярной:
![]() , (11)
, (11)
где
![]() — число молей вещества;
— число молей вещества;
![]() — масса вещества;
— масса вещества;![]() — молярная масса.Молярная
теплоёмкость
имеет
размерность
— молярная масса.Молярная
теплоёмкость
имеет
размерность
![]() .
.
Теплоёмкость моля вещества и удельная теплоёмкость связаны очевидным соотношением:
![]() .
.
Величина теплоёмкости газов существенно зависит от условий, при которых протекает процесс: при постоянном объёме или при постоянном давлении.
Если
нагревание газа происходит при постоянном
объёме, то
газ
не совершает работы против внешних сил,
так как
![]() .
Из
уравнения первого начала термодинамики
следует:
.
Из
уравнения первого начала термодинамики
следует:
![]() , (12)
, (12)
т. е. при изохорическом процессе всё тепло, сообщенное газу, идёт на приращение его внутренней энергии. Напомним, что внутренняя энергия идеального газа является функцией только температуры. Следовательно, для одного моля идеального газа имеем:
![]() . (13)
. (13)
Внутренняя энергия одного моля идеального газа определяется уравнением:
![]() ,
(14)
,
(14)
где
![]() —
число степеней свободы молекулы данного
газа (число независимых координат,
которые полностью определяют положение
молекулы в пространстве, называется
числом степеней свободы молекулы);
—
число степеней свободы молекулы данного
газа (число независимых координат,
которые полностью определяют положение
молекулы в пространстве, называется
числом степеней свободы молекулы);
![]() - универсальная газовая постоянная.
- универсальная газовая постоянная.
Для бесконечно малого изменения температуры из уравнения (14) следует:
![]() ,
,
откуда
![]() . (15)
. (15)
С учётом (15) выражение (13) приводится к виду
![]() .
(16)
.
(16)
Если
нагревание газа происходит при постоянном
давлении, то согласно первому началу
термодинамики тепло
![]() ,
сообщённое
газу, затрачивается не только на
увеличение его внутренней энергии
,
сообщённое
газу, затрачивается не только на
увеличение его внутренней энергии
![]() ,
но
и на совершение газом работы
,
но
и на совершение газом работы
![]() ,
то
есть:
,
то
есть:
![]() .
(17)
.
(17)
Для
изобарического процесса
![]() ,
поэтому (17) можно записать в виде:
,
поэтому (17) можно записать в виде:
![]()
Теплоёмкость моля газа при постоянном давлении равна:
![]() .
(18)
.
(18)
Первое слагаемое правой части этого равенства равно молярной теплоёмкости газа при постоянном объёме. Запишем уравнение состояния идеального газа для случая бесконечно малого изменения его параметров:
![]() ,
,
откуда
![]() .
(19)
.
(19)
Таким
образом, второе слагаемое равенства
(18) численно равно универсальной газовой
постоянной
![]() .
.
Выражение молярной теплоёмкости газа при постоянном давлении с учётом (15) и (19) приводится к виду:
![]() , (20)
, (20)
а так как
![]() ,
(21)
,
(21)
то
![]() .
(22)
.
(22)
Это выражение называется уравнением Майера.
Анализ
формул (16) и (20) приводит к выводу, что
для идеального газа
![]() и
и
![]() не
зависят от параметров состояния газа
не
зависят от параметров состояния газа![]() ,
а
определяются только числом степеней
свободы молекул. Для реальных газов
этот вывод удовлетворительно согласуется
с опытом при невысоких температурах.
При более высоких температурах становится
существенной зависимость теплоёмкости
и, следовательно, показателя адиабатического
процесса
,
а
определяются только числом степеней
свободы молекул. Для реальных газов
этот вывод удовлетворительно согласуется
с опытом при невысоких температурах.
При более высоких температурах становится
существенной зависимость теплоёмкости
и, следовательно, показателя адиабатического
процесса
![]() от
температуры, что необходимо учитывать
при расчётах.
от
температуры, что необходимо учитывать
при расчётах.
Разделив почленно (20) на (16), имеем:
![]() .
(23)
.
(23)
Так
как
![]() ,
то
показатель адиабаты
,
то
показатель адиабаты
![]() всегда больше единицы.
всегда больше единицы.
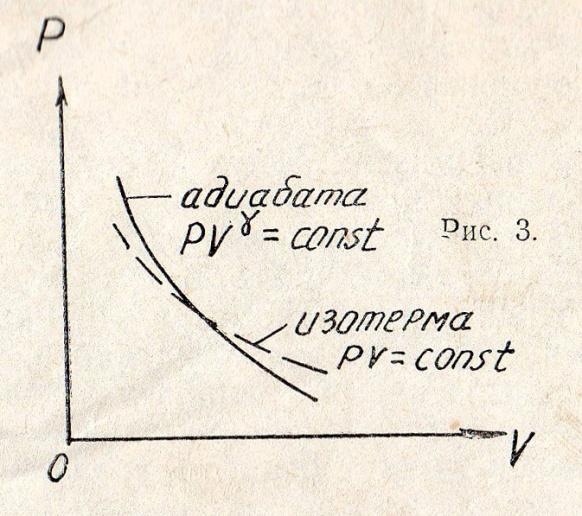
Поэтому адиабата круче спадает к оси абсцисс, чем изотерма (рис. 3).
 Соотношение
(23) позволяет вычислить величину
Соотношение
(23) позволяет вычислить величину
![]() для любого газа, если известно число
степеней свободы молекул этого газа.
Например, для одноатомных газов
для любого газа, если известно число
степеней свободы молекул этого газа.
Например, для одноатомных газов
![]() ;
для двухатомных газов
;
для двухатомных газов
![]() .
.
Этот результат можно проверить на опыте, что и является целью настоящей работы.
